斑馬魚PKR剪接異構體克隆、鑒定及轉錄表達分析①
歐湘瀅 邵 敏 高宗澤 代衛凱 熊嘉鴻 胡有生
(井岡山大學醫學部,吉安343009)
非特異免疫是脊椎動物抵抗病毒侵入的第一道防線,干擾素系統則是機體非特異免疫抵抗感染和清除病毒的主要功能分子體系,而斑馬魚PKR(zebrafish double-stranded RNA-dependent protein ki‐nase,ZPKR)是干擾素系統抗病毒作用的主要效應分子[1-6]。PKR可識別和結合病毒的雙鏈RNA,然后通過二聚化和自磷酸化激活其自身的蛋白激酶活性[4-5,7-9]。活化的PKR能夠磷酸化真核細胞翻譯起始因子2α(eIF2α),從而使其失去蛋白翻譯起始活性,導致蛋白翻譯起始的失敗,引起蛋白翻譯的抑制[5,7-11]。PKR一方面能抑制病毒RNA的復制,另一方面能抑制病毒和宿主細胞蛋白質的合成。最終導致病毒繁殖的抑制和感染病毒細胞的凋亡,并引起機體抗病毒免疫反應,限制病毒在體內的擴散[8-11]。近年來,有研究認為PKR還能在某些病理條件下激活炎性體,并且認為,PKR可能與過度營養導致的肥胖、高血壓和糖尿病等密切相關,但其分子機制并不清楚[12-17]。
PKR分子由N端的雙鏈RNA結合結構域(dou‐ble-stranded RNA binding domain,dsRBD)和C端的激酶結構域(kinase domain,KD)串聯而成[5,7,9,18]。PKR的dsRBD和KD通過一個鏈接區(Linker)連接起來。人類PKR的dsRBD和KD之間的鏈接區是一個非結構化的長度大約為80個氨基酸的序列[5,9,19]。不同物種的PKR的鏈接區長度具有一定差異[20]。定點刪除這個鏈接區后,人的PKR活性發生一定的改變,它與RNA的協同結合更為有效,整體結構更為伸展,但結構域之間的相互作用卻變得微弱[21]。完全刪去鏈接區,PKR仍具有活性。有實驗研究證實,完全刪除PKR的N端,包括dsRBD和鏈接區,單獨的KD仍然具有磷酸化eIF2α的作用,但是不能對雙鏈RNA發生反應[22-23]。說明dsRBD和鏈接區主要是對KD活化起調節作用。
有研究發現,PKR的dsRBD能夠與5′端三磷酸的單鏈RNA結合并引起PKR的活化,但其研究并沒有排除這種結合是否有鏈接區的參與[24]。MAYO等[25]最新研究認為,PKR與單鏈RNA的結合是由于鏈接區有一段富含堿性氨基酸的Basic Region的作用。富含堿性氨基酸的區域帶較多正電荷,能夠與單鏈RNA帶負電荷的磷酸基團結合,并由此促進KD的二聚化和活化。
本研究小組在斑馬魚胚胎組織中,不僅克隆了ROTHENBURG等[26]克隆到的含有3個dsRBM的ZPKR(AM421527.1),還克隆到了含有N端dsRBD和C端KD之間的鏈接區異常的ZPKR剪接異構體(zebrafish PKR transcript variant,ZPKRV)的mRNA(MH425504.1)。通過分析發現,其鏈接區缺失了28個氨基酸序列。而其缺失的28個氨基酸剛好包括了鏈接區的堿性氨基酸區域。在斑馬魚細胞內含有兩種不同的PKR,它們僅僅在鏈接區的長度上具有差異,這是在所有動物中首次發現的。至于它們是否在斑馬魚抗病毒免疫反應中具有不同的功能,仍需進一步的研究證實。
1 材料與方法
1.1 材料
1.1.1 實驗動物 本研究使用的斑馬魚購買于中國科學院水生生物研究所斑馬魚資源中心,由本校江西省發改委重點實驗室江西省人類疾病斑馬魚模型與藥物篩選工程實驗室繁育。
1.1.2 主要試劑與儀器 Taq DNA聚合酶、Prime‐star DNA聚合酶、dNTP、限制性內切酶(Xho I和EcoR I)、DL2000 Marker購于TaKaRa公司;瓊脂糖(Agarose)、無水乙醇、異丙醇、DEPC(焦碳酸二乙酯)均購于上海生工生物工程有限責任公司。RNA提取試劑盒和反轉錄試劑盒均購于TaKaRa公司。美國ABI公司PCR儀、美國Thermo公司微型高速離心機、上海博迅立式壓力蒸汽滅菌器(XQ-LS-100G)、蘇州凈化超凈工作臺(SW-CJ-ED)、杭州奧盛三聯多用途金屬浴、上海天能EPS300電泳儀等。
1.2 方法
1.2.1 引物設計與合成 在NCBI數據庫中檢索ZPKR基因(GenBank序列號:AM421527.1)序列,通過NCBI的在線保守結構域搜索系統CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),確定ZPKR的N端3個dsRBM和激酶結構域位置,根據ZPKR和ZPKRV(MH425504.1)序列及其差異設計ORF克隆引物和qPCR的引物,見表1。
1.2.2 提取P oly I:C刺激不同時間的斑馬魚組織總RNA 為了進一步研究ZPKR在抗病毒免疫反應中RNA表達水平的變化,本實驗購買人工合成的dsRNA類似物Poly I:C模擬病毒RNA對斑馬魚進行刺激實驗。斑馬魚被置于本實驗室適應性飼養1周后進行實驗(所選個體均為健康斑馬魚)。按500μg/100 g劑量腹部注射Poly I:C,每條斑馬魚稱重約為0.5 g。使用濃度為1 mg/ml的Poly I:C,則斑馬魚注射的劑量為2.5μ/l條。選取注射后0 h、6 h、12 h、24 h、48 h這5個時間段,隨機選取2條為一組提取斑馬魚組織總RNA,并通過瓊脂糖凝膠電泳檢測。同時利用反轉錄試劑盒,進行反轉錄合成cDNA。

表1 本研究使用的引物序列表Tab.1 List of primer sequences used in this study
1.2.3 半定量檢測Poly I:C刺激不同時間的ZPKR和ZPKRV轉錄表達 為了檢測斑馬魚總RNA和cD‐NA質量,以及初步了解ZPKR和ZPKRV表達差異,cDNA被用作對β-actin、ZPKR與ZPKRV之和及ZPKR進行PCR檢測。以反轉錄得到的cDNA作為模板,進行PCR擴增。PCR反應體系:cDNA模板1.00μl、ddH2O18.25μl、buffer 2.50μl、dNTP2.00μl、上下游引物分別0.50μl、Taq DNA聚合酶0.25μl。qPCR擴增反應,反應條件為:95℃10 min,95℃30 s,56℃30 s,72℃30 s,72℃7 min,反應28個循環。其中ZPKR+ZPKRV用的引物對是ZPQF和ZPQR;ZPKR用的引物對是ZPQ2F和QZP2R;β-actin用的引物對是ZACTINF和ZACTINR。反應結束后進行瓊脂糖凝膠電泳,EB染色后對瓊脂糖凝膠成像。
1.2.4 qPCR檢測Poly I:C刺激不同時間的ZPKR和ZPKRV轉錄表達 為了進一步區分ZPKR和ZPKRV的表達差異,用qPCR對β-actin、ZPKR與ZPKRV之和及ZPKR進行檢測。目的基因和β-actin基因的qPCR反應體系,總體積20μl:SYBR 10μl;定量引物(F+R)0.8μl;ddH2O7.2μl;cDNA模板2μl。每個cDNA樣品做3個重復,同時每個cDNA樣品做3個β-actin對照。制備兩種預混液,一是目的基因的預混液,包括SYBR、ddH2O、目的基因定量的上游引物和下游引物;另一個是β-actin的預混液,包括SYBR、ddH2O、β-actin基因定量的上游引物和下游引物。
qPCR反應參數:95℃5 min,95℃20 s,55℃30 s,72℃30 s,72℃7 min,40個循環。用2-ΔΔCt方法計算檢測基因相對β-actin的表達倍數,數據都以±s表示。分別計算出ZPKR+ZPKRV和ZPKR各時間的相對定量數據,再用ZPKR+ZPKRV的數據減去ZPKR的數據,可以得到ZPKRV的定量數據。定量引物對同1.2.3。
1.3 統計學分析 數據通過SPSS16.0統計分析,Poly I:C刺激后在0 h、6 h、12 h、24 h、48 h的ZPKR和ZPKRV的表達是否存在差異,該定量數據采用單因素方差分析,以P<0.05表示差異有統計學意義。
2 結果
2.1 ZPKR和ZPKRV克隆和結構分析 根據ROTHENBURG克隆的ZPKR序列設計克隆其ORF的引物,用斑馬魚cDNA為模板,將擴增的片段構建到pET32a上,并轉化大腸桿菌DH5α進行測序。測序分析得到了2個不同的ZPKR。其中ROTHEN‐BURG等[26]克隆的ZPKR的ORF全長2 049 bp,編碼682個氨基酸殘基,ZPKRV的ORF全長1 965 bp,編碼654個氨基酸殘基。ZPKRV比ZPKR的ORF短84 bp,相應的氨基酸序列則短28個氨基酸序列。通過將核苷酸序列翻譯成氨基酸序列,并用SMART預測其二級結構,結果如圖1所示。這兩種斑馬魚PKR的N端的dsRBD都含有3個dsRBM,C端都有1個KD。兩者的差異僅僅是N端和C端之間的鏈接區長度的差異。ZPKRV在其dsRBD和KD的鏈接區中,缺少了28個氨基酸序列(圖1B)。圖的橫線位置為qPCR引物設計所對應位置。因此,用引物對ZPQF、ZPQR既可對ZPKR的片段進行擴增,又可對ZPKRV的片段進行擴增;而引物對ZPQ2F、QZP2R只能對ZPKR的片段進行擴增。
2.2 ZPKR和ZPKRV氨基酸序列比對圖 通過對ZPKR和ZPKRV的氨基酸序列比對,發現兩者除linker缺少28個氨基酸外,ZPKR與ZPKRV的序列完全一致。而這缺少的28個氨基酸序列,恰好正是堿性氨基酸的聚集區(圖2)。
2.3 半定量檢測Poly I:C刺激下ZPKR+ZPKRV和ZPKR在不同時期的轉錄表達差異 圖3結果顯示,斑馬魚在Poly I:C刺激后,ZPKR+ZPKRV和ZPKR的轉錄表達在12 h都會明顯上調,其中ZPKR在刺激24 h又會下調,然后48 h又升高。說明在Poly I:C刺激過程中,ZPKR和ZPKRV的表達都發生了變化,但并不清楚ZPKRV的變化規律。
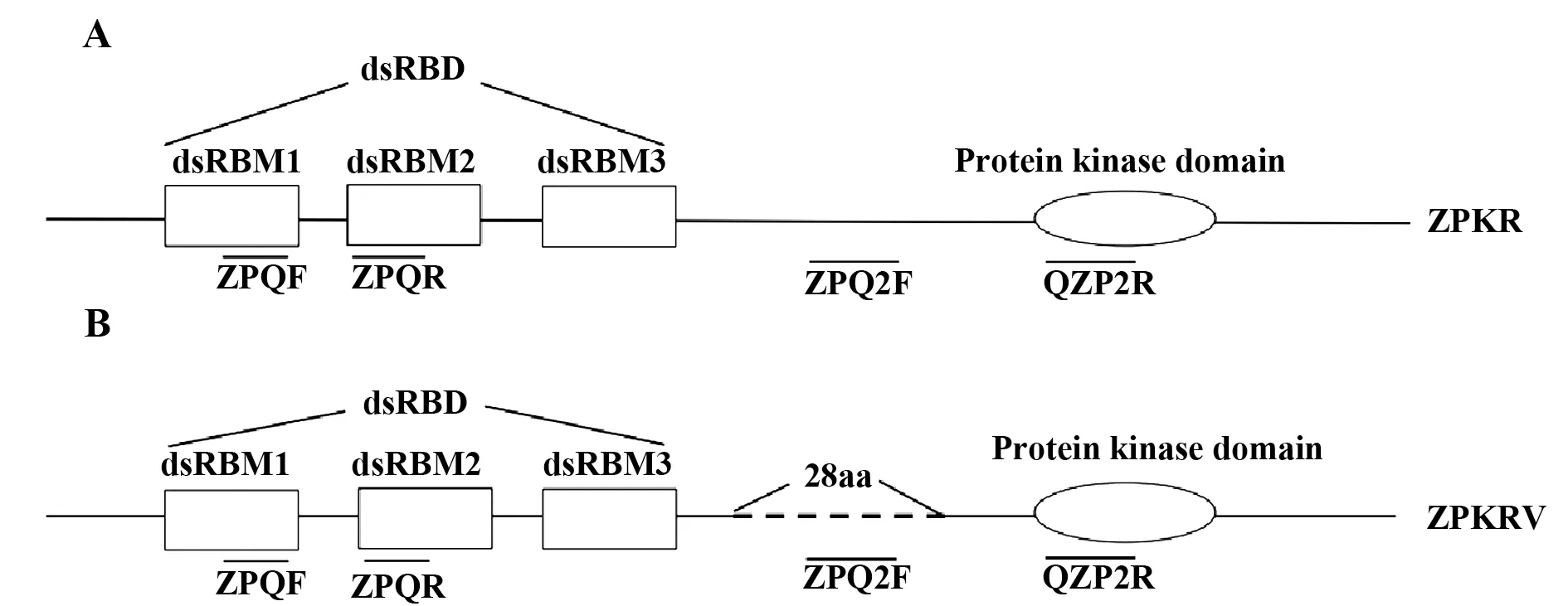
圖1 ZPKR和ZPKRV結構示意圖Fig.1 Schematic diagram of ZPKR and ZPKRV struc?tures

圖2 ZPKR和ZPKRV的鏈接區氨基酸序列比對圖Fig.2 Amino acid sequence alignment of linker of ZPKR and ZPKRV
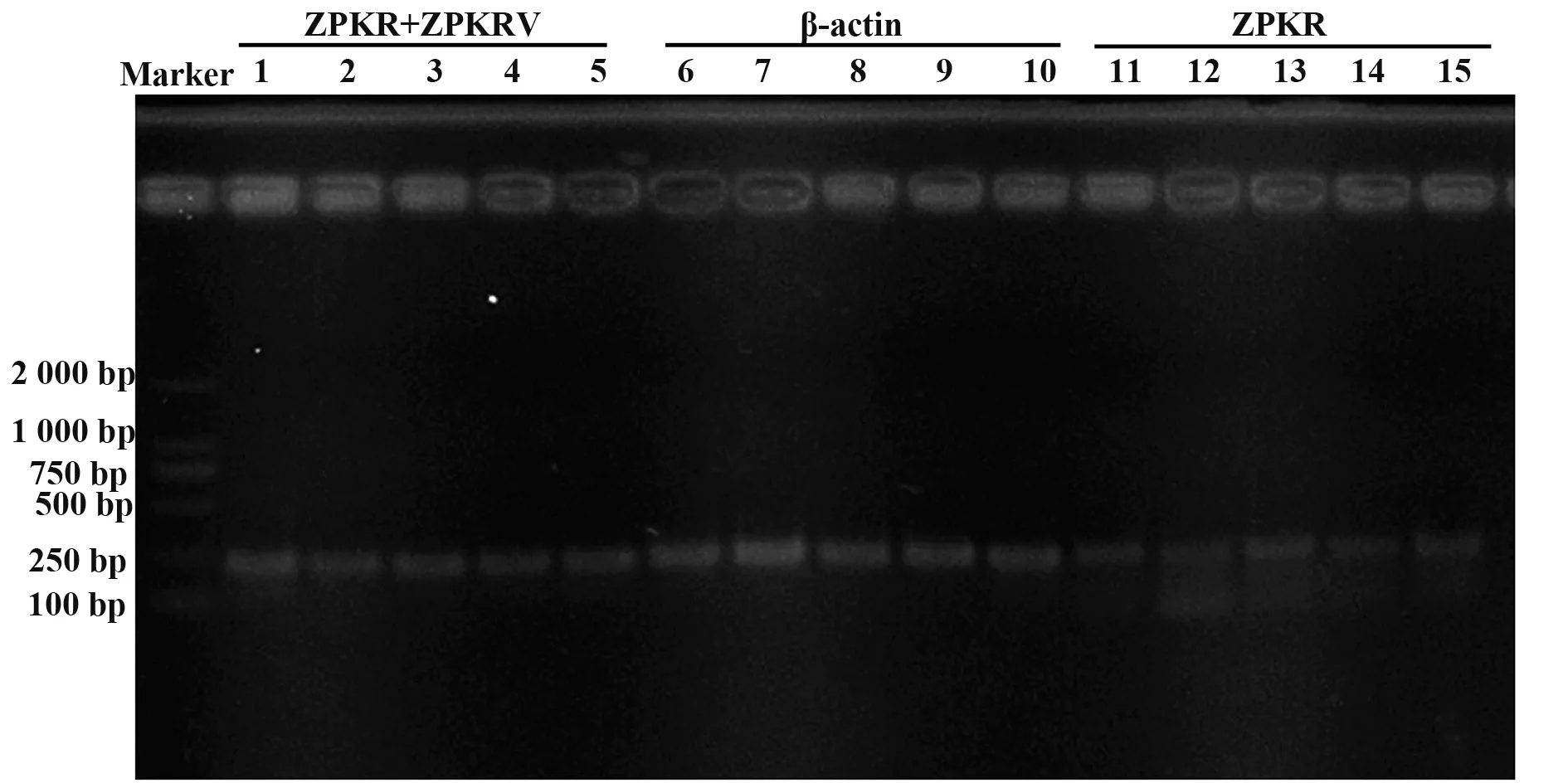
圖3 斑馬魚Poly I:C刺激后不同時段的ZPKR+ZPKRV、β-actin和ZPKR的PCR擴增產物瓊脂糖凝膠電泳Fig.3 Agarose gel electrophoresis of PCR products of ZP?KR+ZPKRV,β-actin,and ZPKR at different time after Poly I:C stimulation to Zebrafish
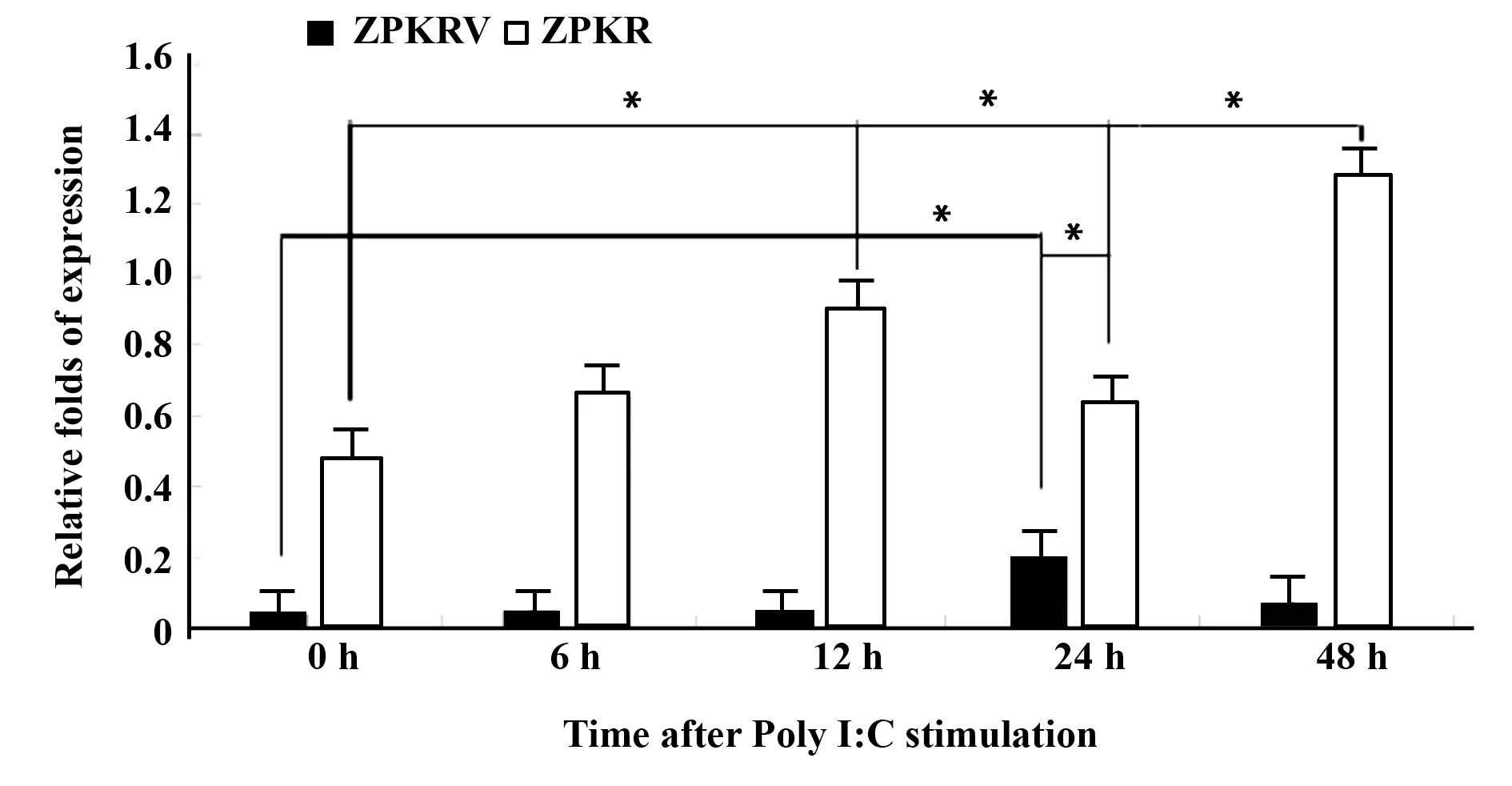
圖4 ZPKR和ZPKRV的qPCR分析Fig.4 Fluorescence qPCR analysisof ZPKR and ZPKRV
2.4 qPCR檢測ZPKR與ZPKRV相對β-actin的表達 所有數據在Mastercycler ep realplex上分析(圖4)。ZPKR在Poly I:C刺激的各時間段的表達趨勢與半定量的瓊脂糖電泳的一致,有2個上調過程:12 h時有第1個上調峰,然后24 h下調,再在48 h上調。ZPKRV表達總體遠低于ZPKR,并且只有1個上調峰,在Poly I:C刺激后24 h到達峰值,然后48 h又下調。而且,ZPKRV上調的最高點正好是ZPKR第1次上調后往下調點,即刺激后的24 h。ZPKR和ZP‐KRV相對β-actin表達量的比值在0 h、6 h、12 h、24 h、48 h分別是11.49、12.95、11.50、3.08、17.78,刺激后24 h比值最小,刺激后48 h比值最大。
2.5 ZPKR和ZPKRV的mRNA表達 經統計結果發現,ZPKRV在0 h和24 h的mRNA表達水平存在顯著差異(P<0.05),0 h的ZPKR分別與12 h、24 h和48 h的mRNA表達水平存在顯著差異(P<0.05),而24 h的ZPKRV和ZPKR的mRNA表達水平存在顯著差異(P<0.05)。
3 討論
在斑馬魚基因組內,雖然同時存在等位基因ZPKRa(基因登錄號:AM421526.1)和ZPKRb(基因登錄號:AM421527.1),但兩者的核苷酸序列相差很小,氨基酸序列則只有5個氨基酸的差異,且都不在關鍵的位點[26]。除此之外,本研究發現斑馬魚細胞內還同時存在ZPKR和ZPKRV(基因登錄號:MH425504.1)兩種不同結構的PKR的表達,ZPKRV僅僅在鏈接區缺失28個氨基酸殘基,其中包含缺失鏈接區內的功能模體堿性區。
PKR可被多種內源性和外源性RNA激活[27-28]。PKR還可以和含有5′端不同修飾的RNA結合并被激活[29]。NALLAGATLA等[29]研究證實,含有5′三磷酸的有限結構化RNA能與PKR的dsRBD結合并激活PKR。MAYO等[25]研究證實,人PKR能結合單鏈RNA并被單鏈RNA激活,含有5′三磷酸的單鏈RNA能與人PKR的dsRBD及堿性區結合并活化PKR。并提出,含有有限結構化的RNA通過與PKR的dsRBD和堿性區發生二價結合,進而提高其結合親和力,增強PKR的二聚化活化。因此,失去了鏈接區的堿性區的ZPKRV,可能失去單鏈RNA結合作用,從而失去與某些情況下產生的具有5′三磷酸帽結構的mRNA結合,避免了PKR的活化和eIF2α的磷酸化作用,從而促進mRNA的翻譯,起到對蛋白翻譯的促進作用[24-25,29]。
當斑馬魚細胞內同時表達ZPKR和ZPKRV時,ZPKR和ZPKRV可結合在同一RNA分子上,并發生異二聚化,導致顯性的負效應[30]。由于ZPKR和ZP‐KRV的dsRBD是完全一樣的,都可以結合RNA,但是它們的鏈接區長度不一樣,不能使KD發生二聚化,從而不能使激酶活性激活,不能磷酸化eIF2α,不能抑制蛋白翻譯。因此,當ZPKR和ZPKRV同時表達時,雖然總的PKR量表達上升,但導致總體PKR抑制蛋白翻譯的作用降低,可以有效促進蛋白翻譯過程。
用人工合成的Poly I:C刺激斑馬魚,ZPKR的轉錄表達在12 h內完成1次上調然后降低,然后在48 h又上調;而ZPKRV則只在Poly I:C刺激后24 h表達上調然后降低。因此推測,斑馬魚體內這2種PKR的轉錄表達,其翻譯表達的產物將在刺激后24 h共存于細胞內,通過顯性的負效應,可能減弱其PKR上調后對蛋白翻譯的抑制作用[30-32]。事實上,qPCR結果顯示,在Poly I:C刺激后的24 h,ZPKRV表達達到峰值,并且ZPKR和ZPKRV的比值最小,為3.08。這時兩者的相互作用產生的顯性負效應最大,對蛋白翻譯抑制作用最小。斑馬魚體內與抗病毒免疫相關的細胞因子,包括PKR、白介素、趨化因子、腫瘤壞死因子以及多種類型的干擾素等,隨后的翻譯表達就會有效的提高,從而增強細胞的抗病毒免疫能力[33-34]。
ZPKR和ZPKRV蛋白的相互作用,可用免疫共沉淀方法來進行研究,但由于ZPKR和ZPKRV兩者差異太小,并且差異區域為非結構化區域,要制備具有區分效果的單克隆抗體有難度。另外,在斑馬魚細胞系中以不同比例過表達ZPKR和ZPKRV,并且可檢測到被ZPKR抑制的特定蛋白翻譯水平,可以間接證實ZPKR和ZPKRV相互作用調控蛋白翻譯的功能。以上實驗都需要進一步研究證實。
本研究首次發現了ZPKRV,并且與ZPKR同時存在于斑馬魚體內。與ZPKR相比,ZPKRV僅在鏈接區缺失了與單鏈RNA結合作用相關的堿性區。進一步定量分析顯示,ZPKRV可能通過失去與單鏈RNA的結合作用,與ZPKR異二聚化導致顯性的負效應,從而增強抗病毒免疫相關蛋白的翻譯。

