18F-AlF-NOTA-octreotide聯合18F-FDG PET/CT顯像用于神經內分泌瘤
陳 博,馮洪波,宮曉艷,杜雪梅
(大連醫科大學附屬第一醫院核醫學科,遼寧 大連 116011)
神經內分泌瘤(neuroendocrine tumors, NET)是一組起源于肽能神經元和神經內分泌細胞的腫瘤,以往認為其發病率僅為1/100 000,但最新流行病學調查顯示,近20年來NET發病率上升了7倍[1]。18F-FDG顯像可作為NET治療前評估的基礎。大部分NET細胞表面表達生長抑素受體(somatostatin receptor, SSTR),利用PET/CT進行功能成像,可同時實現瘤內STTR靶向分子成像。68Ga標記生長抑素類物PET/CT顯像已成為NET診療指南性準則[2],但68Ge/68Ga發生器產量低,同時受運輸、權限等制約,其臨床應用受限。18F是目前PET顯像最常用的放射性核素,其半衰期相對較長,空間分辨率較高,輻射能量較低,比活度較高,是68Ga的最佳替代。18F-AlF-NOTA-octreotide(18F-OCT)和68Ga-生長抑素類似物顯像具有良好的一致性[3]。本研究觀察18F-OCT和18F-FDG PET/CT聯合顯像用于NET的臨床價值。
1 資料與方法
1.1 一般資料 回顧性收集2017年9月—2020年2月21例于大連醫科大學附屬第一醫院同期接受18F-OCT和18F-FDG PET/CT顯像的NET患者,男10例、女11例,年齡34~72歲,平均(57.5±10.7)歲;均經手術或穿刺病理學證實診斷。排除檢查前1~3個月內接受放射、化學治療及其他生物學治療者。
1.2 合成18F-OCT 利用Siemens Eclipse RD回旋加速器和Trasis Allinone化學模塊,首先將18F和前體混合溶液(包含1 ml乙腈、100 μl 2 mg/ml NOTA-octreotide溶液、280 μl pH 4醋酸緩沖液和20 μl 1 μg/μl三氧化二鋁)依次置于反應瓶中加熱至100℃,反應14 min后轉移至HLB柱進行純化,依次以無菌水沖洗、50%乙醇溶液洗脫、抗壞血酸鈉溶液沖洗,最后將洗脫液通過0.22 μm無菌過濾器收入接收瓶。所得產品外觀無色澄明,pH 4~6,放射化學純度>95%,細菌內毒素檢測合格。
1.3 PET/CT成像 檢查前囑患者禁食、禁水4~6 h,控制其空腹血糖<11.1 mmol/L;經靜脈注射18F-FDG 0.15 mCi/kg,待患者靜臥休息60 min后行18F-FDG顯像。間隔1~12(3.35±2.96)天,檢查前準備如前,經靜脈注射18F-OCT 5 mCi后,待患者靜臥45 min后行18F-OCT顯像。均采用Siemens Biograph 64層PET/CT掃描儀,掃描范圍自顱頂至大腿中上部,分別采集CT及PET圖像,每個床位1.5~2.0 min,采用有序子集最大期望值法進行PET圖像重建。
1.4 圖像分析 由具有8年及15年以上工作經驗的核醫學醫師各1名獨立閱讀PET/CT圖像,有分歧時與多名高年資醫師協商并達成一致。PET/CT顯像判定腫瘤陽性標準:①CT示明確病變,同機PET相應部位攝取異常增高;②CT無明顯形態或密度改變,同機PET攝取異常增高且高于肝臟[4]。判定轉移灶標準:PET掃描出現原發灶之外的非生理性攝取,經手術、穿刺活檢病理證實,或由影像學檢查證實為新發病灶,以及隨訪3~6個月病灶明顯增大或經規律抗腫瘤治療后明顯縮小。于后處理工作站選取病灶最長徑作為病灶大小;手動勾畫病灶3D ROI,自動獲得ROI內最大標準攝取值(maximum standard uptake value, SUVmax)。
1.5 統計學分析 采用SPSS 26.0統計分析軟件。以±s表示符合正態分布的計量資料,以中位數(上下四分位數)表示不符合者;采用Pearson相關分析評價病灶大小與SUVmax的相關性:│r│≥0.8高度相關性,0.5≤│r│<0.8中度相關性,0.3≤│r│<0.5低度相關性,0<│r│<0.3弱相關。以Wilcoxon秩和檢驗方法組內分析病灶攝取2種顯像劑的差異。P<0.05為差異有統計學意義。
2 結果
21例NET中,胰腺14例,胃NET 3例,卵巢及喉NET各1例,2例原發灶不明;其中7例已接受原發瘤根治性切除術。根據2010年WHO分級標準,將12例明確存在原發瘤者分為中/低級別組9例、高級別組3例;轉移灶主要分布于肝臟、骨骼、淋巴結、腦、肺、腹膜及皮下等部位。
2.1 NET原發腫瘤PET/CT顯像 原發腫瘤病灶大小與18F-FDG的SUVmax呈中度正相關(r=0.731,P=0.007),與18F-OCT的SUVmax無明顯相關(r=0.311,P=0.325),見圖1。中/低級別組9例原發瘤中,8例18F-OCT顯像陽性、7例18F-FDG顯像陽性;18F-OCT 的SUVmax中位數33.80(6.10,56.55),高于18F-FDG的3.80(1.40,8.80)(Z=-2.345,P=0.019)。高級別組3例原發瘤中,18F-FDG檢出3例,18F-OCT 2例。
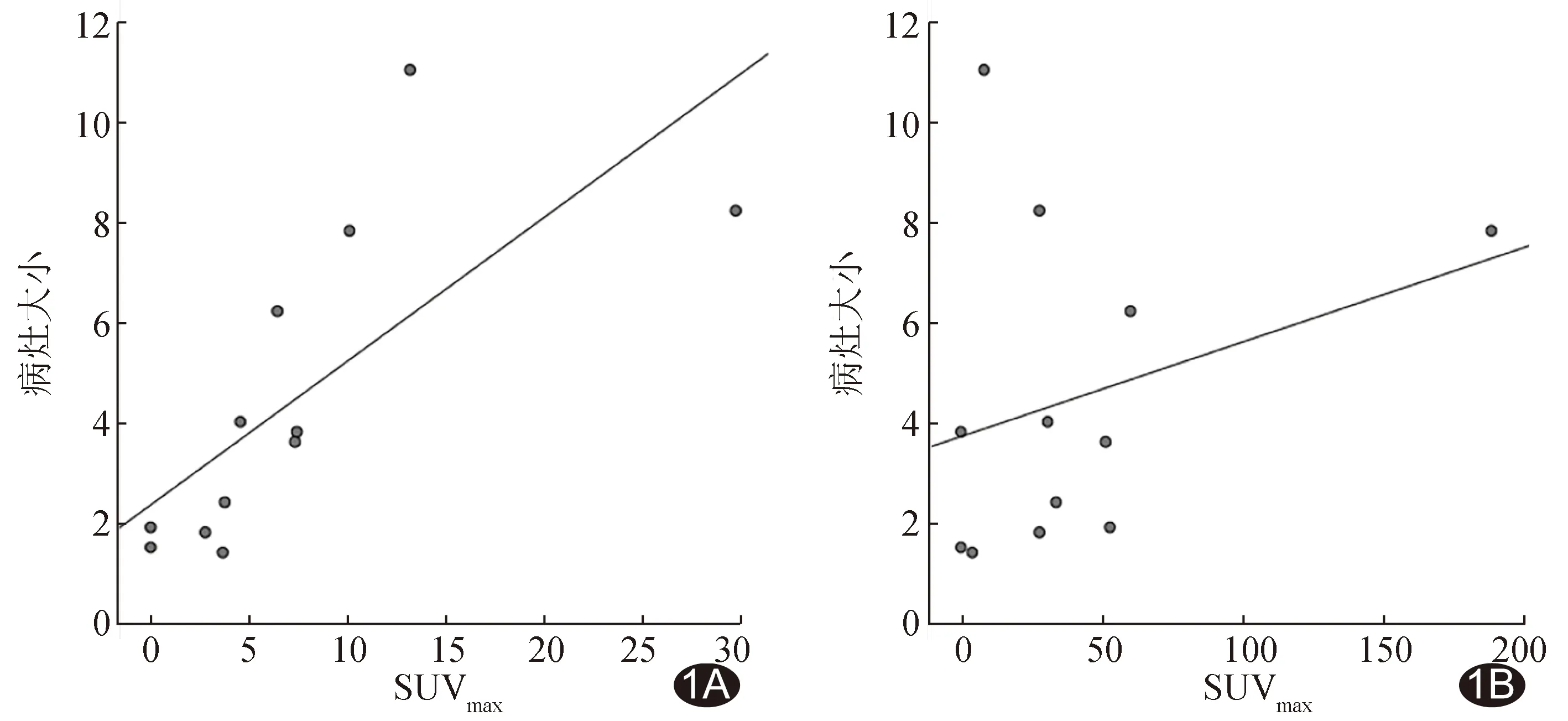
圖1 NET原發灶病灶大小與SUVmax相關性的散點圖 A.18F-FDG; B.18F-OCT
2.2 NET轉移灶PET/CT顯像18F-FDG與18F-OCT聯合檢出247個轉移灶,位于肝臟167個、骨骼48個、淋巴結18個、皮下6個、肺5個、腦2個及腹膜種植1個;單獨18F-FDG PET/CT、單獨18F-OCT PET/CT顯像分別檢出117個、226個轉移灶,對其中89個轉移灶診斷一致。3例NET轉移灶可見“趨異性分化”現象,即轉移灶對2種顯像劑攝取不完全趨同于原發腫瘤而呈現出不同程度親和力,見圖2。3例發生骨轉移,均以成骨性轉移為主,其在18F-OCT顯像中的陽性率(48/48,100%)明顯高于18F-FDG(25/48,52.08%)。1例腦轉移灶和1例腹膜轉移灶僅18F-OCT陽性;1例全身皮下多發轉移灶,18F-FDG均為陽性(6/6,100%)而18F-OCT僅部分陽性(3/6,50%),見圖3、4。
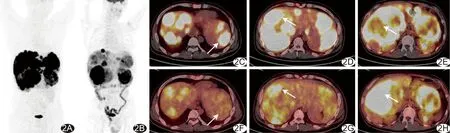
圖2 患者男,34歲,18F-OCT及18F-FDG顯像示胰腺G2級NET伴肝內多發占位 A.18F-OCT全身最大密度投影圖; B.18F-FDG全身最大密度投影圖; C、F.病灶18F-OCT明顯高攝取(SUVmax為24.4,C,箭)、18F-FDG無攝取(F,箭); D、G.18F-OCT(SUVmax為25.4,D)和18F-FDG(SUVmax為6.2,G)均攝取增高(箭); E、H.18F-OCT無攝取(E,箭)而18F-FDG明顯高攝取(SUVmax為24.7,H,箭)
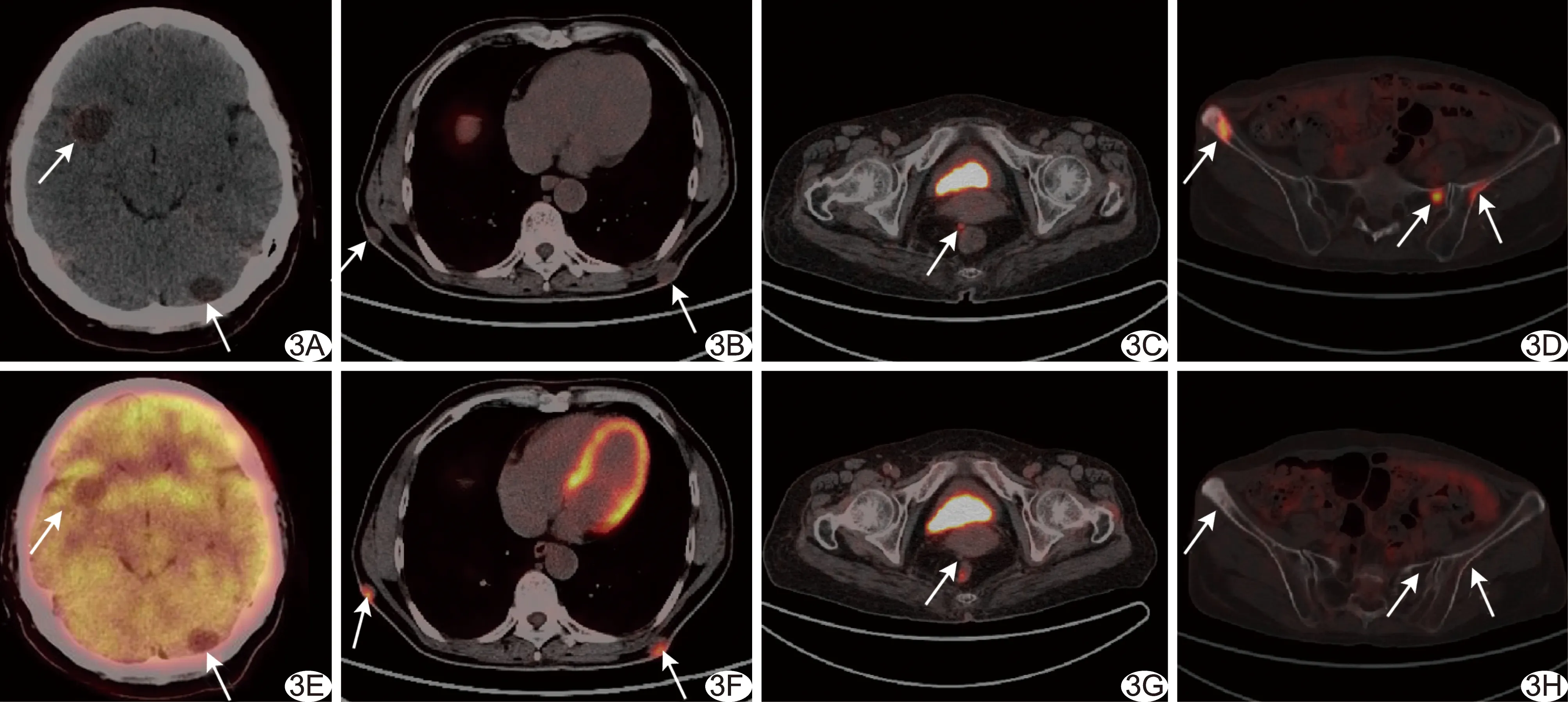
圖3 18F-OCT及18F-FDG顯像示NET轉移灶 A、E.患者女,49歲,右側顳葉及左側小腦半球病灶長徑分別為2.4 cm和1.7 cm,18F-OCT攝取增高(SUVmax分別為2.5和2.6,A,箭),18F-FDG無攝取(E,箭); B、F.患者男,62歲,后胸壁皮下結節,18F-OCT無攝取(B,箭)而18F-FDG明顯高攝取(SUVmax為12.8,F,箭); C、G.患者女,72歲,盆腔底部轉移灶長徑約0.8 cm,18F-OCT攝取增高(SUVmax為11.0,C,箭)而18F-FDG無攝取(G,箭); D、H.患者男,62歲,成骨性轉移灶,18F-OCT攝取增高(SUVmax為15.4,D,箭)、18F-FDG無攝取(H,箭)
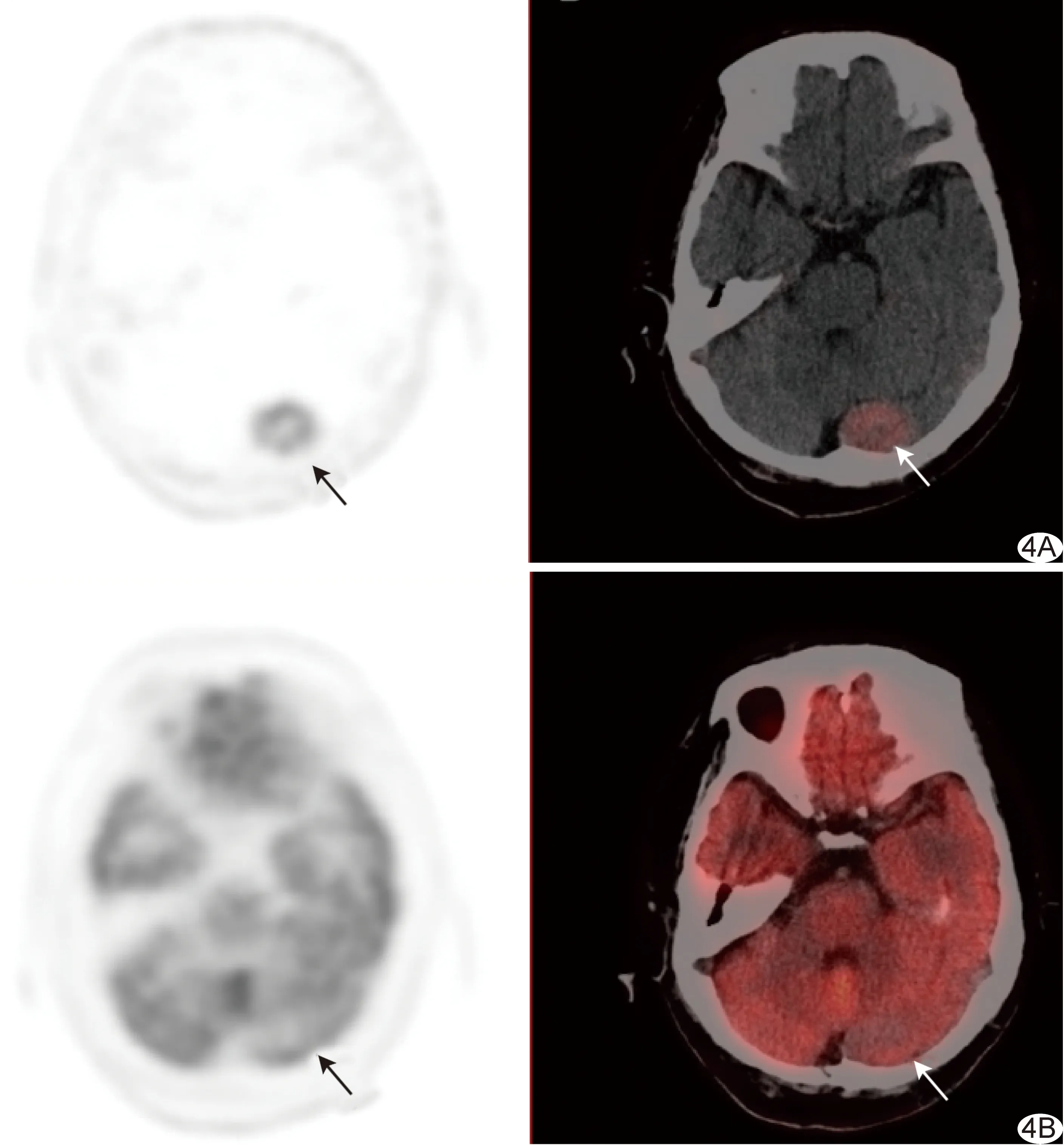
圖4 患者女,72歲,腦膜瘤,18F-OCT及18F-FDG顯像 左側枕葉2.7 cm稍高密度結節,18F-OCT攝取增高(SUVmax為6.7,A,箭),18F-FDG無攝取(B,箭)
2.3 奧曲肽治療前后PET/CT顯像 1例胰腺NET術后10年,18F-OCT及18F-FDG聯合顯像提示肝臟多發占位,1個肝右葉病灶18F-FDG高攝取而18F-OCT無攝取,其余病灶均呈現18F-OCT明顯高攝取而18F-FDG中/高攝取;經10個療程(每個療程28天,每日30 mg)奧曲肽治療后,肝右葉攝取18F-FDG病灶較前進展,其余病灶代謝活性均較前減低或消失,見圖5。
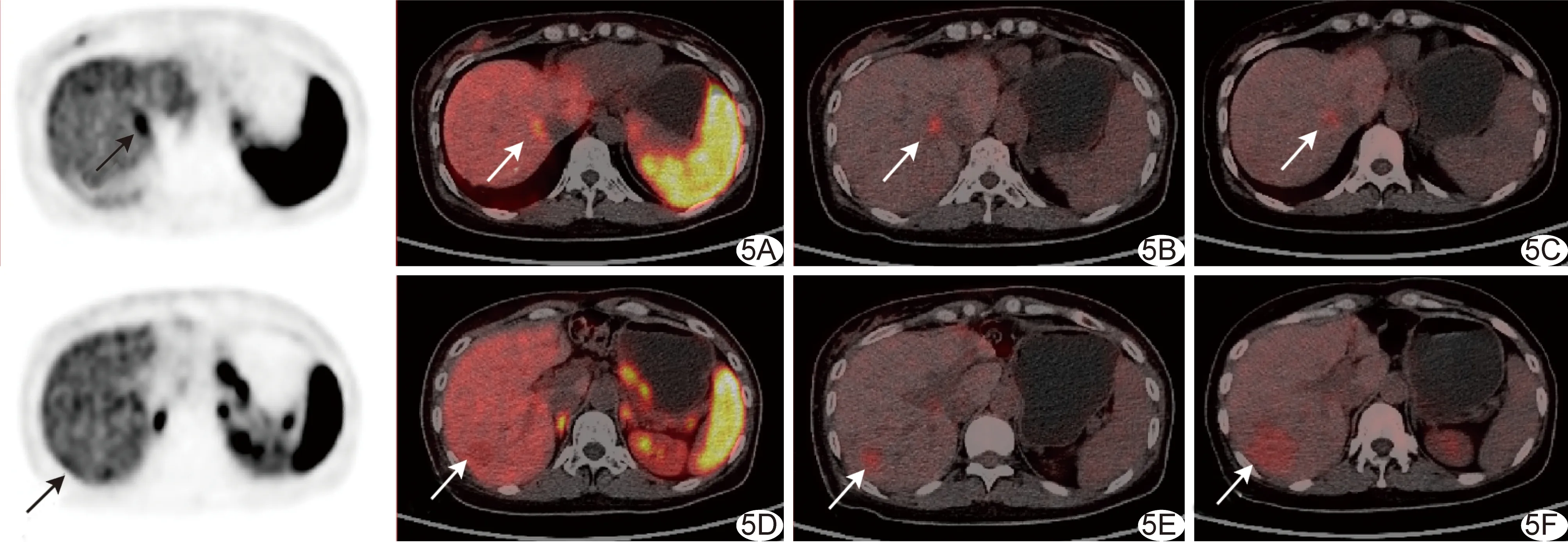
圖5 患者女,50歲,胰腺NET多發轉移,奧曲肽治療前后18F-OCT及18F-FDG顯像 A~C.肝頂部2.0 cm結節,18F-OCT攝取增高(SUVmax為13.1,A,箭)、18F-FDG攝取增高(SUVmax為8.4,B,箭),治療后18F-FDG顯像病灶變小(1.1 cm)、攝取下降(SUVmax為5.3,C箭); D~F.肝右葉1.7 cm結節,18F-OCT攝取未見增高(D,箭),18F-FDG攝取稍增高(SUVmax為7.1,E,箭),治療后18F-FDG顯像病灶變大(3.9 cm,18F-FDG SUVmax為6.3,F,箭)
3 討論
NET是一類具有高度異質性腫瘤,單獨18F-FDG PET/CT顯像常導致漏、誤診。近年有學者利用NET細胞表面高表達SSTR的特性,通過Al18F標記將螯合劑耦聯奧曲肽,制備出的18F-OCT具有產量高、半衰期適中、允許集中生產和分配等優勢,是目前獲得廣泛認可的生長抑素類似物示蹤劑[5]。由于NET發病率較低,目前僅LONG等[6]研究表明18F-OCT和18F-FDG聯合顯像可提高NET原發瘤及轉移灶的診斷準確性;本研究結果與之一致。
本研究12例NET原發灶中,相比18F-FDG ,18F-OCT檢出的G1~G2級病灶較多,且其18F-OCT的SUVmax高于18F-FDG,而18F-FDG則對 G3級病灶較具優勢。約80%的高分化NET細胞表面過表達SSTR2,對18F-OCT具有高親和力,可高特異性結合,而高分化NET生長緩慢、能量消耗低,故葡萄糖代謝率低;低分化NET侵襲性更高,對18F-FDG攝取能力更強,但其細胞表面已經失去原有特征,SSTR表達量下降,對18F-OCT的靶向攝取能力較差[6-7]。此外,本研究發現病灶大小與18F-FDG的SUVmax呈中度相關,但與18F-OCT無明顯相關,原因可能在于腫瘤對18F-FDG的攝取與細胞增殖速度有關,腫瘤增殖越快則能量消耗越多,葡萄糖攝取越多,而18F-OCT作為生長抑素類似物,其攝取與細胞分化程度相關度更高[8]。
本組NET轉移灶分布于肝臟、骨骼、淋巴結、腦、肺、腹膜及皮下等部位,其中肝臟最常受累;18F-OCT和18F-FDG聯合檢測轉移灶的準確率高于二者單一檢查。18F-OCT對于診斷腦和成骨性轉移瘤更有優勢:受血腦屏障保護,18F-OCT顯像腦部正常組織本底攝取水平極低,使腦內轉移瘤靶本底比增高;成骨性轉移瘤侵襲性較低,進展相對緩慢[9],葡萄糖代謝率相對較低,而SSTR表達增高。此外,隨著腫瘤生長,大部分轉移瘤與原發瘤的生物學趨勢相同,少部分則呈現出趨異性分化[10],即腫瘤細胞分化程度、方向不一致或不完全一致,此時更需聯合2種顯像,以全面評估腫瘤全身分布的不均一性。
既往研究[11]表明,18F-FDG和68Ga-生長抑素類似物聯合顯像可改變59%患者的治療決策。奧曲肽具備作用于SSTR2調控細胞增殖及凋亡而產生的直接抗腫瘤作用[12]。作為SSTR在體示蹤技術,18F-OCT顯像早期預測奧曲肽治療NET效果可為實施個體化治療方案提供臨床前依據。本研究追蹤觀察1例胰腺NET多發轉移患者,奧曲肽對其18F-OCT顯像陽性病灶取得了良好治療效果。
本組1例胰腺G1級NET受鉤突部位18F-OCT高生理性攝取本底影響導致錯誤判斷,并發現1例腦膜瘤病灶攝取18F-OCT,這是由于SSTR存在于正常軟腦膜瘤中,SSTR2在腦膜瘤中高表達、在膠質瘤、垂體腺瘤等顱內腫瘤中亦有表達[13-14],炎癥進程和成骨細胞代謝活性增加也亦可使SSTR表達增高[15]而導致18F-OCT誤判,聯合應用多模態檢查有助于判斷。
本研究的主要局限性在于樣本量小,不足以支持對原發灶顯像劑攝取進行分級分析;系回顧性研究,病理學資料不夠完善。綜上所述,18F-OCT與18F-FDG PET/CT聯合顯像能更準確地檢測NET原發瘤及其轉移灶,對臨床選擇治療決策具有重要意義。

