耐鎘菌株L202002的分離鑒定及特性研究
李夢茜,黃惠彬,龍潔云,張振旺
(1.河池學院 化學與生物工程學院,廣西 河池 546300;2.湖北科技學院 臨床醫學院,湖北 咸寧 437000;3.湖北科技學院 醫藥研究院,湖北 咸寧 437000)
重金屬引起的環境污染日益受到關注,從受污染的土壤和水體中去除重金屬對環境保護至關重要。目前,去除廢水中重金屬的方法主要有化學沉淀法、離子交換法、膜技術和生物吸附法等[1-2]。相較其他方法,生物吸附法具有成本低、無二次污染、操作簡便等優點,受到廣泛關注[3-4]。細菌[5-7]、霉菌[8-9]、微藻類[10-11]和酵母[12-13]均能產生吸附活性物質,可用于吸附去除重金屬。目前關于微生物絮凝劑的大部分研究集中在微生物對重金屬離子的吸附特性及耐受吸附機制等方面[14-15]。
抗重金屬微生物的分離對于發揮微生物在環境保護中的作用具有重要意義。試驗從鎘污染河道底泥分離篩選出一株抗鎘菌株,通過形態觀察、生化生理特性和ITS序列分析,對該菌株進行了鑒定,并考察其絮凝活性和對重金屬(鎘、銅、鉻、汞、鉛、鋅)的抗性,以期為用于從廢水中去除重金屬鎘提供參考。
1 試驗部分
1.1 試劑及設備
試驗主要試劑:蛋白胨、瓊脂粉、酵母粉,均為化學純,西隴科學股份有限公司產品;硝酸、PbCl2、CdCl2、CuCl2、ZnCl2、K2Cr2O7、HgCl2、均為分析純,國藥集團產品;高嶺土,化學純,國藥集團產品。
主要設備:火焰原子吸收分光光度計,WFX-110B型,廣州賽福斯實驗設備科技有限公司;恒溫培養振蕩器,ZWY1102C型,上海躍進醫療器械有限公司;酶標儀,xMark型,美國Bio-Rad公司;電子掃描顯微鏡,Phenom Pro X型,荷蘭Phenom-World公司。
1.2 試驗方法
1.2.1 耐鎘菌株的分離篩選
從廣西南丹縣某礦區附近采集鎘污染水體污泥樣品。用去離子水溶解氯化鎘制備濃度0.2 mol/L鎘原液,用0.22 μm微孔濾膜過濾除菌。
LB培養基的組成:酵母提取物5.0 g/L,蛋白胨10.0 g/L,氯化鈉10.0 g/L。
將10 g污泥加入到90 mL滅菌水中,在磁力攪拌器上攪拌30 min,使土壤中的細菌完全分離。培養20 min后進行梯度稀釋,取10-5、10-6梯度各100 μL分別涂布到含2 mmol/L Cd的LB固體培養基中,于溫度30 ℃下培養4 d。挑取平皿中菌落形態不同的單菌落用劃線法接種于分別含1~20 mmol/L Cd的固體LB培養基上,檢測各菌株對Cd的耐受性。選擇耐受最高Cd濃度的菌株進行后續試驗。在固體培養基上挑取單個菌落并劃線,反復上述操作直至得到純化菌株。
1.2.2 菌株鑒定
首先觀察菌株瓊脂平板菌落形態、顯微孢子形態。收集菌絲體,置于無菌研缽中,反復研磨后用基因組DNA提純試劑盒提取基因組DNA,用通用ITS序列引物ITS-1(5’-TCCGTAGGTGAACCTGCGG)和ITS-4(5’-CCTCCGCTTA-TTGATATGC)進行PCR擴增ITS基因片段[16]。擴增出預期大小的ITS序列(0.7 kb)的PCR產物,用凝膠提取試劑盒純化后送上海生工公司測序。測序得到的ITS序列提交Gen Bank數據庫,并與相似序列進行BLAST比對。用CLUSTAL W.軟件構建系統發育樹。
1.2.3 對其他重金屬的抗性
最低抑菌濃度(MIC)是指完全阻止菌株生長的最低金屬濃度。其他重金屬CuCl2、K2Cr2O7、ZnCl2、HgCl2和PbCl2原液按照Cd原液配制方式配制(0.2 mol/L)。在LB瓊脂平板上分別添加不同濃度的5種重金屬溶液,將菌株劃線接種于平板上。于30 ℃培養箱中培養3~5 d后,測定各重金屬的MIC。用實驗室保藏的白色念珠菌進行對照試驗。
1.2.4 抗鎘菌株的絮凝活性評價
用高嶺土懸濁液測定菌株L202002的絮凝活性[17]。將1 mL菌株發酵液上清液、2.5 mL CaC12溶液(1%)、46.5 mL高嶺土懸濁液(4 g/L)在離心管中混合,用磁力攪拌器攪拌并靜置10 min,從離心管上層吸取2 mL上清液于24孔板中,用酶標儀測定550 nm處的吸光度(B)。用同樣方式加入不含菌的LB液體培養基作為空白對照,測定550 nm處的吸光度(A)。同時加入市售聚丙烯酰胺絮凝劑作為陽性對照。絮凝率計算公式如下:
式中:μ—絮凝率,%;D1——對照組吸光度;D2—加入菌株發酵液的吸光度。
用SEM觀察高嶺土被絮凝前、后的形貌特征,闡明菌株的絮凝活性機制。
1.2.5 菌株的除鎘性能評價
菌株對鎘的去除性能用搖瓶進行初步測定。將9個裝有100 mL LB液體培養基的250 mL搖瓶標記為1#~9#,分組如下:A組,1#~3#;B組,4#~6#;C組,7#~9#。A組的3瓶未接種,B組和C組的6瓶接種。9個搖瓶均放于溫度30 ℃、 振蕩速度180 r/min的搖床中振蕩培養。培養48 h后,C組3瓶培養物在121 ℃條件下滅菌10~15 min,直至菌體幾乎全部滅活。然后將CdCl2·6H2O加入到9個培養瓶中,得到Cd最終濃度為2 mmol/L。9個培養瓶繼續放在搖床中培養24 h,每個培養瓶的培養物以5 000 r/min速度離心10 min,然后用火焰原子吸收分光光度計測定上清液中Cd濃度,計算Cd去除率(η)。
式中:c0—未接菌培養液中Cd濃度,mol/L;c1—接菌培養液中Cd濃度,mol/L。
2 試驗結果與討論
2.1 菌株的篩選與鑒定
從污泥中篩選抗鎘菌株,經固體瓊脂平板劃線純化,獲得一批抗鎘菌株,其中一株在含19 mmol/L Cd的瓊脂平板上培養3 d仍有少量小菌落,當Cd濃度增至20 mmol/L培養7 d時,平板上無菌落形成。重復培養3次,菌株抗鎘性能穩定。該菌株命名為菌株L202002。
2.1.1 L202002的培養與理化特征
L202002菌株在LB固體培養基上呈絨毛狀、輻射狀生長,菌落中央為土黃色(圖1(a));LB液體培養條件下形成菌絲球,菌絲絨毛狀(圖1(b));孢子梗頂端分散著球形顆粒狀分生孢子,顯微鏡下孢子呈黃綠色菊花樣顆粒(圖1(c))。碳氮源是構成微生物細胞的最重要的營養成分,利用和分解碳、氮源的能力是微生物重要的生理生化特征,在微生物的鑒別和分類時占有重要地位[18]。菌株L202002利用碳氮源的情況見表1,可以看出,L202002菌株的形態和理化特征與曲霉屬較為一致。

a—平板菌落;b—液體培養菌絲球;c—鏡檢孢子形態(1 000倍)。圖1 菌株L202002的培養特征

表1 菌株L202002的生化特征
2.1.2 菌株的ITS序列測序
對菌株L202002提取總DNA后送上海生工測序,ITS序列提交到Gen Bank數據庫進行BLAST比對分析,結果表明,L202002與曲霉菌(Aspergillus)的ITS序列同源性在98%以上。為進一步確定菌株L202002與其他霉菌的親緣關系,選取30株同源性較高的菌株構建基于ITS的系統發育樹,結果如圖2所示。
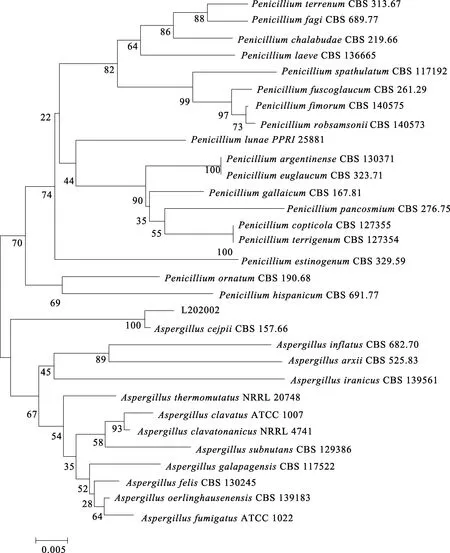
圖2 L202002菌株基于ITS序列的系統進化樹
可以看出:L202002與土曲霉(Aspergilluscejpii)位于同一分支上,具有較近的遺傳距離。綜合形態特征、生理生化特征和ITS序列分析,菌株L202002被鑒定為土曲霉。
2.2 其他重金屬離子對菌株L202002的最低抑菌濃度(MIC)
菌株L202002可以在高濃度Cd、Cu、Cr、Hg、Pb、Zn培養基中生長。Cu、Zn是微生物必需的微量營養元素,其他元素Cd、Cr、Hg和Pb對細胞有致命作用,通常在微摩爾或毫摩爾濃度下具有毒性。菌株L202002對幾種重金屬Cd、Cu、Cr、Hg、Pb和Zn的MIC見表2。可以看出,菌株L202002對這幾種重金屬都有抗性,抗性順序為Cd>Zn>Cu>Cr>Hg>Pb。菌株L202002對重金屬的抗性遠高于白色念珠菌。
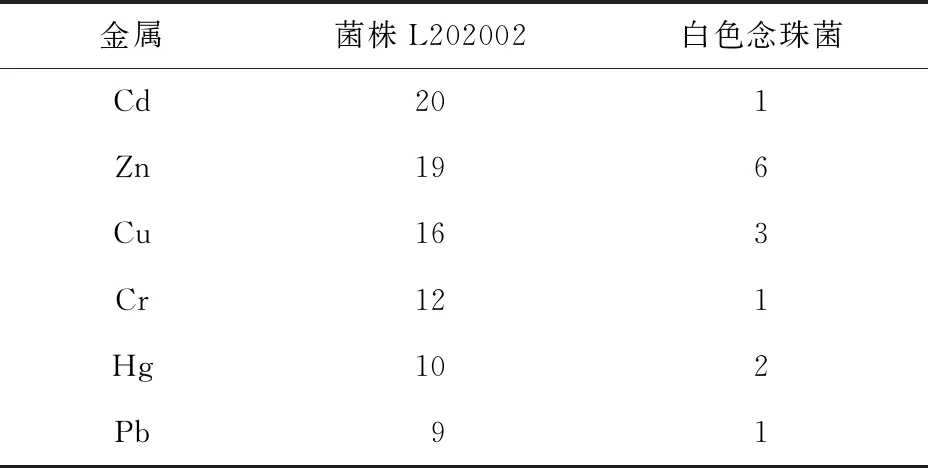
表2 菌株L202002對幾種重金屬的MIC mmol/L
2.3 L202002菌株的絮凝性能
L202002菌株對高嶺土懸濁液的絮凝效果如圖3所示。可以看出,L202002菌株對高嶺土懸濁液表現出很好的絮凝效果,與市售絮凝劑聚丙烯酰胺的絮凝效果相當。L202002菌株的絮凝活性產物在添加量為30 mg/L時對高嶺土懸濁液的絮凝率高達100%。
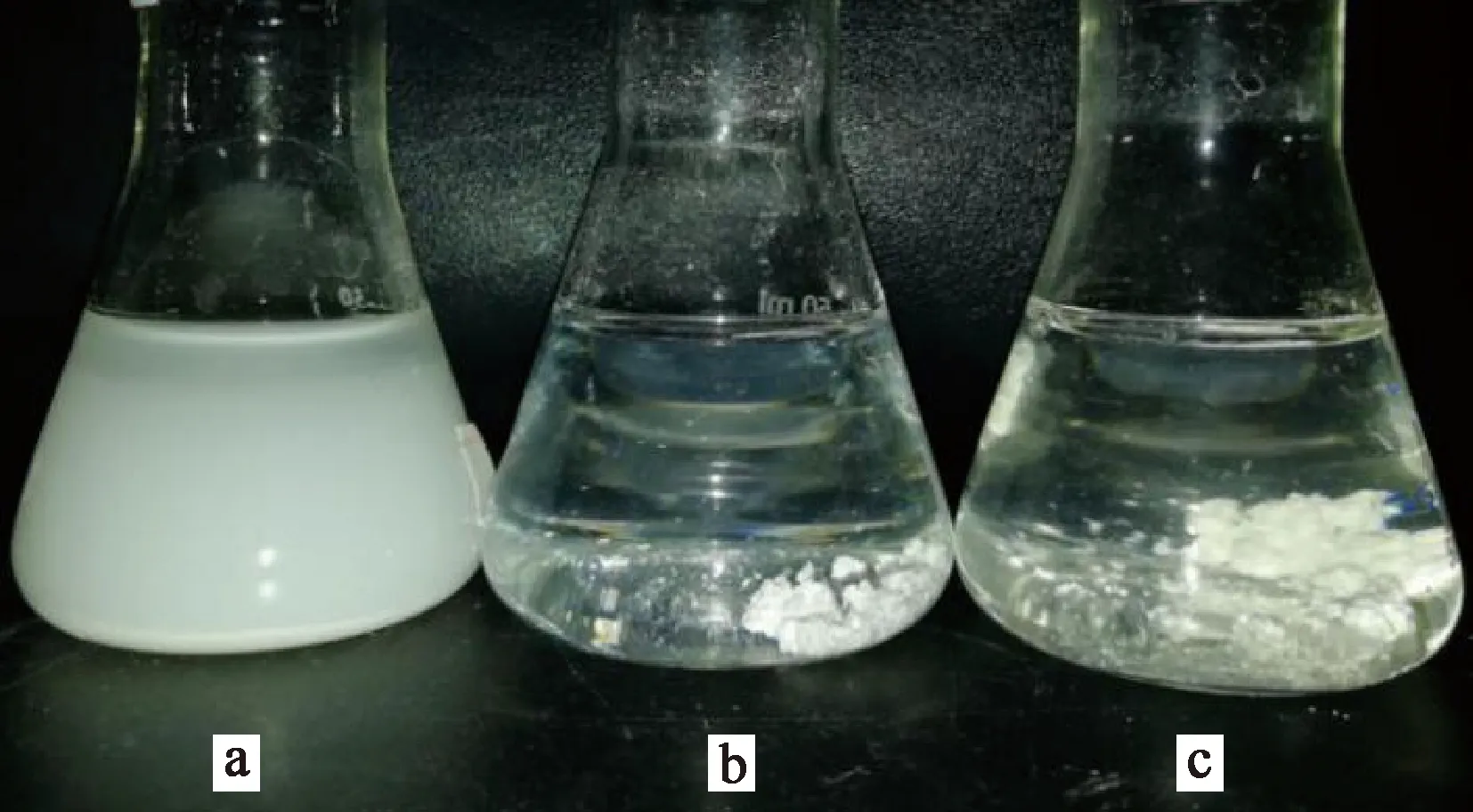
a—高嶺土懸濁液;b—加L202002菌液;c—加聚丙烯酰胺。圖3 L202002菌株對高嶺土懸濁液的絮凝效果
2.4 菌株L202002的絮凝機制
高嶺土溶液絮凝前、后SEM分析結果如圖4所示。可以看出,分散的高嶺土細小顆粒被菌株絮凝活性產物通過架橋吸附作用像編織網一樣緊密地連接在一起,并且易于與溶液分離。高嶺土膠粒可以強烈地吸附在多糖絮凝劑分子鏈功能團上,且吸附在鏈上的膠粒可以同時被其他分子鏈吸附,產生架橋連接,從而形成容易沉降的三維絮體;在沉降過程中絮體相互碰撞和卷掃形成粗大的絮凝團,從而加速高嶺土的沉降[19-20],因此推斷,菌株L202002絮凝活性產物主要是通過架橋吸附和網捕卷掃機制完成對高嶺土顆粒的吸附。

圖4 高嶺土絮凝前(a)、后(b)的SEM圖像
2.5 菌株L202002對溶液中Cd的去除
菌株L202002對Cd的去除效果見表3。可以看出:B組和C組平均Cd質量濃度明顯低于A組,考慮到時間和能耗成本,以處理24 h為宜;與不接種菌株的A組相比,B組的平均Cd質量濃度下降162.2 mg/L,C組的平均Cd質量濃度下降138.4 mg/L,這表明菌株L202002具有良好的金屬去除性能,活菌和死菌均能有效去除溶液中的Cd。

表3 菌株L202002對Cd的去除效果
研究重金屬環境中微生物的生長情況對于治理重金屬污染至關重要[21-22]。一般來說,微生物去除重金屬的過程包括生物吸附和生物積累[23]。生物吸附過程是指微生物通過配合、螯合、離子交換、吸附等生化反應吸附金屬離子,活細胞和非活細胞都有生物吸附作用;生物積累通常只發生在活細胞中,是一個活躍的過程,需要微生物新陳代謝提供能量。死菌在生物修復方面比活菌更好,因為死菌不會受金屬毒性的影響[24];但活細胞對金屬的去除率要高于非活細胞對金屬的去除率[25]。其原因可能是菌株對Cd的抗性較強,而Cd對菌株生命的影響較小。在吸附去除過程中,活細胞通過生物吸附和生物積累去除Cd,而非活細胞只能通過生物吸附來去除Cd。因此,活細胞對Cd的去除能力要好于非活細胞。
3 結論
1)分離得到的菌株L202002為土黃色絨毛狀,孢子呈黃綠色菊花樣顆粒,液體培養條件下形成菌絲球,被鑒定為曲霉菌Aspergilluscejpii。
2) 菌株L202002對Cd有較強的耐受性,對固體平板上的其他金屬,如Zn、Cu、Pb、Hg也有較好的耐受性;并且,對高嶺土懸濁液表現出很好的絮凝活性。
3) 菌株L202002的活細胞和非活細胞都能去除溶液中的Cd,經活細胞、非活細胞處理24 h后的Cd平均質量濃度分別下降162.2、138.4 mg/L,相應的Cd去除率分別為73.5%、62.7%。
4)由于菌株L202002對其他重金屬亦有很好的耐受性,且對高嶺土懸濁液有良好的絮凝活性,所以,進一步研究菌株的抗Cd機制及絮凝活性產物對重金屬污染水的治理有一定意義。

