面向CO2電化學轉化的銅基催化劑研究進展
孟怡辰,況思宇,劉海,范群,馬新賓,張生
天津大學化工學院,綠色合成與轉化教育部重點實驗室,天津 300072
1 引言
化石能源的消耗導致了大氣中CO2濃度的逐年增加,引發了全球氣候變暖、海平面上升等一系列嚴重問題。因此,如何將風能、太陽能和地熱能等可再生能源轉化為方便儲存、運輸和使用的形式,以及如何通過利用可再生能源來降低CO2濃度,實現綠色發展,是迫切需要解決的問題1-3。將CO2轉化為含碳燃料和化工產品是實現可持續發展的重要途徑,是一項可以實現環境友好與工業生產雙贏的方案。利用可再生能源(如風能、太陽能等)將CO2轉化為高附加值的化學物質和燃料(CO、CH4、C2H4、CH3OH、HCOOH等),因其理念的重要性和技術的可行性而受到廣泛關注4-8。在各類方法中,電化學還原CO2由于其環境友好、操作方便,以及可通過改變施加電位來調節反應產物選擇性等優點,成為了降低大氣中碳含量、緩解能源危機、以及改善環境的有效途徑9-13。
Hori等人14根據CO2還原產物將金屬催化劑分為四類:1. 主產物是CO:Au,Ag,Pd,Ga,Zn。2. 主產物是HCOO-:Bi,Pb,Sn,Cd,Hg,In,Tl。3. 可以產生> 2e-還原產物:Cu和Cu合金。4.主產物為H2,對CO2還原反應不活躍:Ni,Ti,Pt,Fe。其中,金屬銅可以將CO2還原為CO、HCOOH、CH4、C2H4、C2H5OH等多種產物,是唯一能產生>2e-還原產物的金屬。此外,由于它對CO中間體的吸附較強,從而有利于實現C-C偶合,促進C2+產物(即還原產物所含碳原子數≥ 2)的生成。與C1產物(CO、CH4、HCOO-、CH3OH)相比,C2+產物(C2H4、C2H5OH、CH3COO-、n-C3H7OH等)具有更高的能量密度和更高的經濟價值,可作為合成長鏈烴類燃料和氧化物的原料,因此有著很大的工業需求量15。其中,C2H4是一種需求量巨大的化學品,它可以用來生產聚乙烯,還可直接用作焊接燃料或天然氣的混合組分,其產量已經作為衡量一個國家石油化工發展水平的重要標志之一16。C2H5OH是一種高能量密度(26.8 MJ·kg-1)的液體燃料,也是化學合成中廣泛使用的中間體,容易儲存和運輸,因此被用作汽油的添加劑。除了作為汽車燃料,C2H5OH也被用于燃料電池中17,18。相對于C1產物,C2+物質的工業合成路線也更為復雜。因此,通過電催化將CO2還原為具有高價值的C2+產物具有更廣泛的應用前景。
Cu基催化劑可以將CO2還原為C2+產物的優異性能,引起了越來越多科研工作者的重視。純金屬Cu作為催化劑存在不少缺點,如對某種高價值的C2+產物選擇性往往不高,整體的CO2轉化效率會受到析氫反應的影響,且電解過程中失活較快以及高過電位的要求限制了其工業應用19-22。作為一種有發展前景的金屬催化劑,為了進一步提高其催化性能,眾多研究人員對Cu催化劑的尺寸23,形貌24,應變水平25,晶面26,化合態27等進行了改性。本文介紹了近年來不同方式改性的銅基催化劑的研究進展以及相關的反應機理,并根據對已有研究的分析,結合發展的狀況,對銅基電催化劑的研究方向進行展望。
2 CO2電化學還原面臨的挑戰
大氣中逐漸增加的CO2濃度是全球變暖的一個重要原因。要解決CO2含量過高的問題,不僅需要減少對化石燃料的依賴,還需要制定有效的策略,從大氣中捕獲CO2并有效利用。為了應對能源需求,可再生能源長期、大規模的儲存仍然是一項巨大的挑戰。而化學鍵儲能有很多好處,包括顯著提高能量密度,增強安全性和轉化程度28。CO2的轉化利用一直在不斷發展,其主要通過不同的機制斷裂C=O鍵,形成C―C、C―H鍵來實現29。經過多年的研究,人們逐漸探索出了熱化學、光化學、電化學等還原或轉化CO2的方法。其中,通過電化學的方法還原CO2是一種有前景的方法,其所需的能量輸入可以來自太陽能、風能等可再生能源產生的電能30,31。
將CO2轉化為更有價值的產物需要將電子轉移到碳上,從而降低碳的價態,這一系列反應通常被稱為CO2還原反應32。根據參與反應的電子數不同,可得到不同的產物,常見的還原產物(CO、CH4、HCOOH、CH3OH、C2H5OH、C2H4、CH3CHO等)與相應的平衡電位見表1。從熱力學角度來說,CO2作為穩定的線性分子,C、O之間的距離很短,僅有0.116 nm。雖然CO2總體上是非極性的,但由于C和O的電負性不同,它含有極性鍵33。動力學上,CO2還原過程非常緩慢。CO2還原的第一步是CO2分子的活化,即降低化學鍵的有序程度。激活CO2的能量反映在還原的負電位上,CO2的單電子還原發生在比較負的電位,大部分原因是由于從線性CO2到彎曲CO2需要能量來完成大規模的結構重排34。
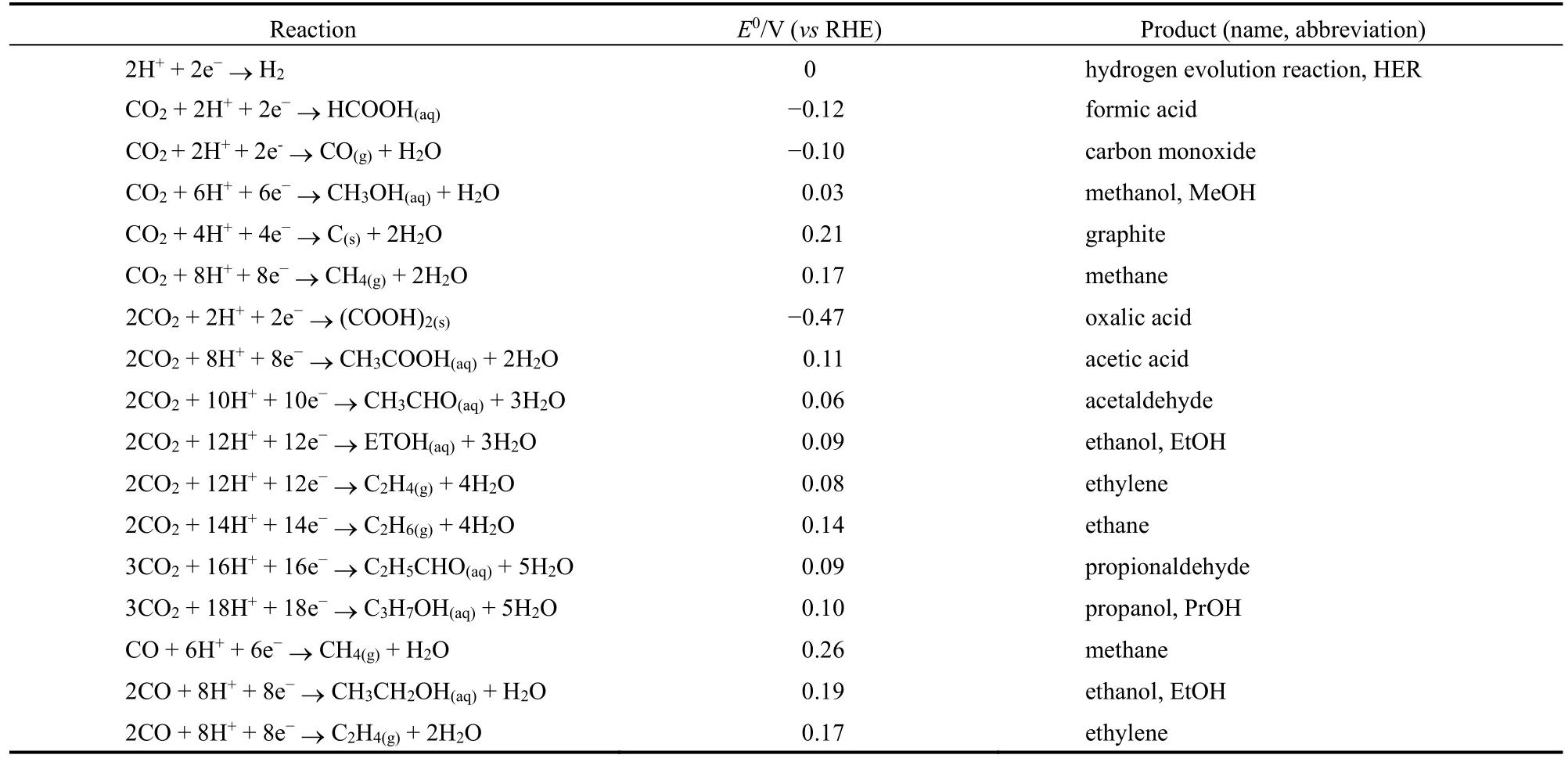
表1 電極反應以及對應的平衡電勢Table 1 Electrode Reactions with Equilibrium Potentials.
由于CO2的電化學還原反應通常在水溶液中進行,因此伴隨著析氫副反應的發生32,從而導致有效產物法拉第效率的損失。了解析氫與CO2還原之間的競爭關系,對于提高電催化CO2還原的法拉第效率具有重要的意義35,36。CO2還原的商業應用需要一種高穩定性的催化劑,而已報道的催化劑常因為結構不穩定而降解,從而導致性能下降37。另外,CO還原被認為是CO2轉化成C2+產物的限速步驟,但大多數關于CO還原的研究都是在電解質溶液中進行的,CO的溶解度很低,所以,更好地理解CO的還原,特別是在高電流密度的情況下,對于提高CO2還原活性非常重要38。因此,促進CO2電化學還原的關鍵技術是開發出可以在較低過電位下產生目標產物,具有高選擇性、高穩定性和高活性的催化劑。
3 Cu表面CO2電催化還原機理
近年來,研究人員一直致力于Cu基催化劑表面CO2還原反應機理的研究。早在1985年,Hori等人39首次在多種金屬電極上進行了CO2電催化還原實驗,通過產物分析發現,只有Cu具有可以產生C2H4、C2H5OH和n-PrOH等C2+產物的獨特性能14,40。這是因為Cu是唯一對*CO具有負吸附能,而對*H具有正吸附能的金屬32,更易穩定吸附*CO,并且CO在Cu上具有適宜的結合能,C-C偶聯機制是Cu催化劑上C2+產物生成的主要原因。
Hori等人41較早就提出了C-C偶聯機制,*CH2直接二聚成C2H4,或者通過CO插入的方式形成*CH2CO,然后進一步生成C2H4。近年來,密度泛函理論(DFT)計算及原位光譜測試已被廣泛用于探究CO2還原的機制。通過預測關鍵反應中間體的吸附能,建立反應自由能圖,或者直接識別反應中間體,可以為提出的反應機理提供可靠的驗證42,43。有研究表明,通過原位紅外光譜儀檢測到質子化二聚體(OCCOH),并且這個中間體只出現在Cu(100)平面上還原CO的時候。DFT計算結果也證明了*COCHO的存在,于是認為C2H4的形成可能是通過兩個被吸附的CO物種之間的C―C偶合進行的,證實了在Cu(100)上C―C偶聯成C2產物是通過二聚化的步驟44。與只通CO2相比,CO2與CO同時存在時,C2+產物的選擇性明顯提高,說明CO是關鍵的反應中間體45。光譜與動力學模型均顯示,*CO在CO2還原條件下存在于Cu上,C―C偶聯的能壘、*H和*CO的覆蓋率都會影響C2產物的生成32,46。Karen Chan研究組47認為Cu(100)和(211)臺階面比Cu(111)更有利于C2+產物的形成。自由能顯示Cu(100)比Cu(111)更容易進行共二聚反應。*OCCO在Cu(100)面通過兩個碳端吸附在四重位點上,比碳原子被限制在三重位點上的Cu(111)具有更強的內在結合能。Cu(211)面有較好的共二聚動力學。雖然Cu(211)比Cu(100)具有更大的二聚勢壘,但其躍遷態的能量基本相同。表面加氫形成*OCCHO也很容易,因為*OCCO的碳端指向質子轉移的溶劑,形成了相應的質子-電子轉移屏障。
Yogesh研究組認為,Cu上高階產物的形成與pH值和電位有關48。Goddard等人49對H2O/Cu(100)體系使用從頭算分子元動力學模擬,根據自由能的計算,確定了C2產物的動力學和生成途徑。該研究認為C2產物的生成機制與施加的電位有關。當施加電位在-0.4 V (相對可逆氫電極RHE)到-0.6 V(vs RHE)的范圍時,C2H4通過ER機制生成在動力學上比LH機制更具優勢。*CO―CO被水合成*CO―COH,然后*CO―COH又很快被還原成*COH―COH。雖然*CCO在Cu(100)上形成從能量角度來看是有利的,但是*CCO形成的ΔG?比*COH―COH的高0.67 eV,因此,*CCO對C2H4的形成起很小的作用。當施加的電位逐漸增加,由于CO表面位點的丟失,被H*所取代,因此C2H4的生成速率降低。當施加電位大于-0.8 V (vs RHE)的時候,通過未吸附的CO與*COH反應,C2H4的生成又重新增多,這與Bell和Head-Gordon等人50認為*COCHO是生成C2產物的關鍵中間體的觀點一致。另外,通過GC-QM (巨正則量子力學)方法確定了Cu(111)上C2產物的生成途徑與pH有關,并且認為Cu表面結合的水在電化學脫水還原中有非常關鍵的作用。引入探針分子發現,酸性pH下生成HOCHCH2在動力學上是有利的,并預測C2H5OH是唯一的產品。但是當pH增加到7,HOCCH2脫水生成H2C=C在動力學上變的更有利。而在堿性pH下,生成C2H4的路線占主導地位。中間體CH2CH3在酸性條件下生成C2H6,在中性和堿性條件下,C2H6的加氫會被抑制51。
Kim等人52研究發現,C2H4和C2H5OH的Tafel斜率相似,說明決速步驟的中間體相同,并且這些C2產物的形成基本上受到C1中間體偶合作用的限制。另一方面,n-PrOH呈現出不同的Tafel斜率,表明與C2H4和C2H5OH的生成路徑不同。n-PrOH的形成可能需要CO與氫化C之間的偶合(例如*CH2),*CH2恰好是形成CH4的中間體,而與C2H4和EtOH相比,n-PrOH在更正的電位下達到最大值,且n-PrOH下降時恰好是CH4法拉第效率上升的區域也證明了這一點。另外有研究認為,被吸附的C2中間體,例如C2H4,也能與鄰近的C1中間體(例如CO)發生分子間C―C偶聯,然后經過質子/電子轉移形成CH3CH2CHO,最后還原成n-PrOH53,這與Bell等人54認為CH3CH2CHO是n-PrOH前體的觀點相一致。研究發現,與陰極接觸的電解質中醛類的濃度遠遠高于相應的醇。而且在更大的陰極電位下,C2H5OH在陰極附近的濃度隨著CH3CH2CHO的消耗而增加。根據這些發現,認為CH3CHO是C2H5OH和CH3CH2CHO的前體,n-PrOH通過CH3CH2CHO生成。然而,Xu研究組55通過同位素標記和原位光譜測試發現,CH3CHO脫氫生成甲羰基中間體,與CO偶聯可以生成PrOH,但主要途徑還是CO之間的偶聯。甲羰基中間體加氫生成―OCH2CH3和―CHOHCH3,可以進一步生成C2H5OH。
Bell和Head-Gordon研究組50對CO2在Cu(100)上進行電化學還原過程中C―C的形成途徑進行了周期性Kohn-Sham密度泛函理論研究。研究發現,在低應用電位下,C―C通過CO二聚體形成。然而,在高應用電位,較大的激活障礙阻斷這一途徑,因此,C―C的形成通過CHO與CO反應生成。而CHOads可以通過CO與Hads結合生成(Volmer機制),或者直接從溶液中還原水生成(Heyrovsky機制)。之后利用DFT計算與恒電極電位(CEP)模型研究,提出了高電位下Cu(100)上CO生成C2產物的可能途徑(圖1)。在*CO + H →*CHO,*CHO + CO →*COCHO或*COCO + H →*COCOH的過程中,*COCOH和*COCHO是互變異構體。通過計算發現在沒有應用電位的情況下,*COCHO比*COCOH穩定0.43 eV,并且認為*COCHO是生成C2產物的關鍵中間體,也對C2H4與C2H5OH之間的選擇性具有重要作用。從*COCHOH開始,進一步還原環氧乙烷,最終生成C2H4,而C2H2O2分別在低電位和高電位下還原為CH3CHO和C2H5OH,并且認為*CH2CH2OH是生成C2H5OH的直接前體。同時,還通過實驗探索出了生成CH3COOH的新路徑:從*COCHO開始,通過還原和環化形成乙酰內酯,經過兩個額外的還原和質子轉移可以產生CH3COOH56。又有研究認為,7種C2、C3產物最有可能通過三種途徑形成。對于第一條路線,*CH2是生成C2產物的關鍵中間體,其中C2H6是通過*CH3的二聚形成的,CH3COO-是通過CO插入機制形成的。第二條路線中,*CHO通過CO插入機制成為C2H2O2和C2H6O2的前體。但是由于*CHO也是CH4的前體,因此這條路線中對CH4的選擇性較強。對于第三條路線,C2H4是最常見也是最重要的C2產品。已提出的生成機制有*CO二聚、*CO―COH偶聯、碳烯和CO插入機制等57。
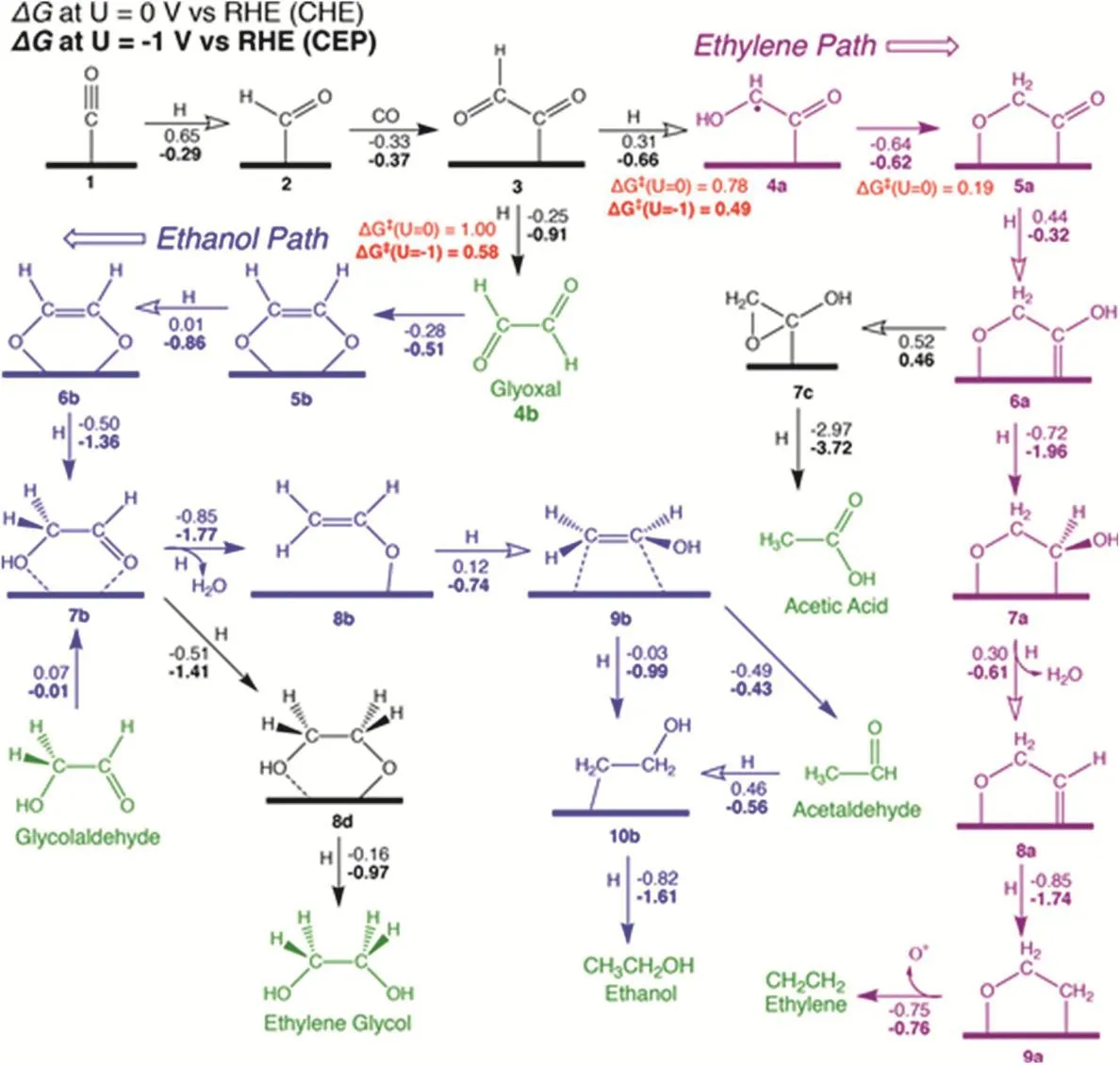
圖1 高電位下Cu(100)上CO還原產生C2產物的機制56Fig. 1 Proposed mechanism for the reduction of CO to C2 products at high potentials on Cu(100) 56.
自從CO被確定為CO2還原成C2+產物的關鍵中間體以來,研究人員對C2+產物生成的途徑和機理進行了大量的研究。但是與C1產物的反應途徑相比,C2+產物的生成途徑比較復雜,并且溶劑對中間體有影響、關于pH效應的起源也存在爭議,因此,對于它們生成的途徑還沒有一個確切的理論。C―C偶合步驟有更高的動力學壁壘,生成C2+產物的效率與C2+的電流密度都比C1產物低很多。這就會限制CO2轉化為C2+產物。因此,要繼續對反應機理進行探索,加深理解,明確速控步驟與關鍵中間體,有助于開發高效的催化劑。
4 銅基催化劑研究進展
雖然金屬Cu對CO2具有獨特的催化特性,但是仍然存在CO2電化學轉化的還原過電位較高、動力學緩慢、能量轉換效率低、選擇性差、穩定性不足、競爭性析氫副反應明顯等問題5,58,同時,一些高價值的還原產物一般只有在很高的過電位下才能以顯著的速率產生21。因此,通過改性Cu催化劑來提高CO2還原的催化活性和選擇性是一項具有重大意義的課題。通過調控一些參數,比如粒徑的尺寸23,晶面59,原子配位數60,表面應變61,62等,可以改變催化劑表面的電子結構和幾何環境,以實現高選擇性地生成不同種類的產物,也可以進一步促進C―C偶聯,從而更有效地將CO2還原為高價值的C2+產物63。部分電極的CO2還原產物與測試條件見表S1 (Supporting Information)。
4.1 金屬Cu
4.1.1 形貌因素
催化劑的形態和電子結構在電催化還原CO2過程中具有重要作用64,而且產物的選擇性在很大程度上依賴于催化劑的形態特征。通過調節反應條件可以實現對形貌的調控65。因此,通過不同的方式制備形貌、尺寸、表面組成各異的金屬Cu,會改變催化性能,同時,也會產生不同的C-C偶聯方式,從而提高C2+產物的選擇性。
Cuellar等人66發現小顆粒的Cu用于進一步還原CO的有效面積更大,因此生成C2產品的效率更高。Li等人24制備了五棱銅納米線,其上存在低配位邊緣位點,增強了中間產物的結合能。Kim和同事52通過電解,使密集排列的Cu納米粒子集合發生結構轉變,成為了立方形顆粒,*CO的覆蓋面積可能會增大,增加了C―C偶聯的機會,能夠在低過電位下有選擇性地生成C2-C3產物。Zhao等人67采用電溶解和再沉積的原位合成方法制備的納米晶須對C2H4具有一定的選擇性,這種形貌穩定了CO*并阻止其脫附,并且通過OCCOH*進一步形成C2H4。Wu等人68通過濕化學反應和原位電化學重構的方法制備了納米枝晶結構的Cu催化劑,其高電化學活性表面積以及豐富的導電網絡促進了電子的運輸和傳質。Cu納米粒子產生C2H4的電位高于Cu納米枝晶(Cu NDs),這會進一步延遲C3產物的生成。而Cu納米枝晶在-0.8 V的時候就可以通過CO二聚體產生C2H4,然后通過CO的插入形成C3產物(圖2)。Mangione等人69制備了(100)面,(110)邊和(111)角包裹的方形Cu催化劑,對C2產物,特別是對C2H4的選擇性增強。并且認為(100)/(110)兩個相鄰界面之間的協同作用有利于COH―CO偶合。而Kibria等人70通過新型氧化工藝和重構,得到了Cu電極。表面重建過程可能會使Cu表面從穩定的(111)的小平面轉變為更具有C2選擇性的(100)平面,使其在含有高堿性介質的流動池裝置中,完全抑制CH4的產生,C2+產物(乙烯,乙醇,丙醇,醋酸)的法拉第效率達到84%,電流密度達到336 mA·cm-2。

圖2 概述了不同的起始電位下CO2電化學還原產生一氧化碳、乙烯、丙醇、丙醛和甲烷的關鍵中間體和反應途徑68Fig. 2 Overview of key intermediates and reaction pathways for CO2ERR for the products CO, C2H4,n-PrOH, propanal, and CH4 at various onset potentials 68.
構建具有復雜功能的原子界面或特定位點,可以更有針對地將催化劑應用到不同的反應當中。Lum等人71將氧化銅箔或薄膜還原成金屬狀態來制備了氧衍生Cu電極。通過還原同位素標記的13CO和12CO2,并進行產物分析得到這種Cu催化劑對于C―C偶聯產物有三種不同的活性位點,一種產生乙醇和乙酸,另一種產生乙烯,還有一種產生正丙醇。單原子與單位點催化劑以其極高的原子利用率和優異的催化性能也在電化學催化中得到了廣泛的應用72,73。Jiao等人74制備了具有高度活躍原子界面的Cu原子對催化劑,并將其穩定在Pd10Te3合金納米線上,生成CO的法拉第效率達到92%。X射線吸收譜(XANES)測試得到分散的Cu原子部分氧化,以Cu4-Ox的形式存在。一個Cu與O結合形成Cu1x+,再進一步與相鄰的Cu形成Cu10-Cu1x+原子對,成為了直接參與催化的活性位點。另外兩個Cu原子調節占據空位的O原子周圍的缺陷,從而穩定了這種原子催化劑。
4.1.2 載體因素
引入合適的載體不僅可以高分散負載納米催化劑,還能夠改變金屬銅的電子結構,從而影響其催化性能。例如還原后的氧化石墨烯(rGO)作為包裹層會阻礙納米銅催化劑形態結構變化(圖3),防止選擇性位點的丟失,使結構穩定性增強、選擇性提高24。Yuan等人75將不規則形狀的Cu納米粒子負載在紙狀維生素B6修飾的氧化石墨烯片層上(GOVB6-Cu),GO-VB6中含有吡啶N活性位點,可以降低CO*中間體形成時的能量,并且電極表面的電子轉移效率顯著增加。電子轉移到CO2上形成CO2·-,之后通過電子-質子轉移生成CO*,再進一步二聚形成OC―CO*,這可能是關鍵的決速步驟。然后OC―CO*進一步質子化并且還原生成乙醇。Cheng等人76制備了MOF衍生的Cu負載氮摻雜碳(Cu-NC)的催化劑,具有負電性的N原子從相鄰C原子處得到電子,使得帶正電的C原子成為了Lewis堿位點,增加了Cu-NC表面對CO2的吸附強度,對C2H4、C2H5OH的生成有一定的選擇性。Dinh等人77在C基底氣體擴散層上沉積了Cu催化劑,形成了清晰的反應界面。在堿性介質KOH中,生成C2H4的法拉第效率可以達到70%,其中共二聚反應是C2產物在高pH和較低電位下的速率決定步驟50,78。DFT計算顯示,銅表面或附近的OH-降低了CO2還原和CO偶合的活化能勢壘,從而有利于C2H4的生成。碳納米顆粒和石墨的存在穩定了銅催化劑表面。通過引入聚四氟乙烯(PTFE)作為氣體擴散層,使得CO在反應界面的局部存在率很高,增加了C―C偶合的機會。將疏水性和導電性載體之間的反應界面明確分層,提高了操作穩定性,連續穩定生成C2H4的時間可以達到150 h。說明引入合適的載體,可以提高電催化活性79。
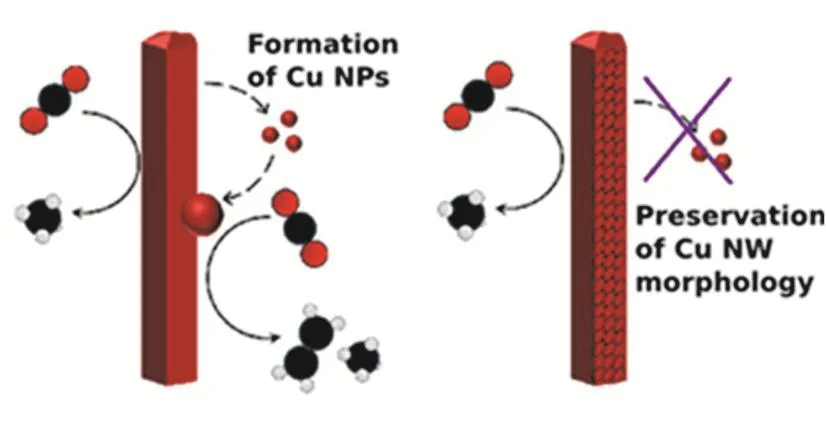
圖3 還原氧化石墨烯穩定Cu納米線結構示意圖24Fig. 3 Schematic of rGO stabilizing the structure of Cu NW 24.
4.1.3 電解液因素
在反應電解液中加入離子液體,可以改變Cu表面對中間體的吸附情況,從而影響產物選擇性。Zarandi等人80在Cu納米泡沫電極中以1-丁基-3-甲基咪唑溴化銨(BMIMB)為協同催化劑,在常溫常壓下對CO2進行了電化學還原。協同催化劑可以有效增強CO2電催化還原的效果81,并且BMIMB是一種具有富電子環的離子液體,能夠降低形成CO2·-活化能,它與泡沫Cu電極的協同作用,可以為CO2轉化為乙醇等燃料的生產提供有利的環境。電解液中的鹵素離子可以穩定中間體,并對反應具有調節作用。Gao和同事82利用電解液驅動Cu納米結構的變化,原位測試發現C―C偶合過程與銅離子的穩定存在以及被吸附的鹵化物有關。在碘離子的存在下,催化劑表面高度粗糙,并且產生了可能有利于C―C偶合的低配位位點,從而使Cu催化劑性能顯著改變,進一步將C2+產物的選擇性提高到80%。另外,電解質中陽離子大小會影響影響某些反應產物的內在生成速率。經過在Cu(111)上測試了陽離子大小對CO2還原反應的影響,發現HCOO-、C2H4和C2H5OH的部分電流隨著陽離子尺寸的增大而增大,而H2、CO和CH4的生成速率受陽離子尺寸的影響較小。在含有較大陽離子Cs+的電解液中進行CO2還原,對C2H4、C2H5OH和HCOO-的生成有更顯著的促進作用83。Kim等人52在CsHCO3中測試了Cu納米粒子催化CO2還原的產物,發現與在KHCO3電解質中相比,C2、C3產物的比例大幅度提高,可以達到90%。
4.2 Cu氧化物
有研究表明,Cu氧化物發生電化學還原反應時產生的低配位表面銅原子,與剩余Cu+之間的協同作用,有利于CO2分子的活化,有利于C―C偶聯,促進C2產物的生成84。但也有研究人員通過DFT計算認為,還原電勢下亞表面氧對Cu的活性的影響可以忽略不計,并且預測氧化物對CO2還原的中間體吸附沒有促進作用85。目前,對于Cu氧化物在CO2電催化還原過程中的活性物質尚無定論,仍需要進一步研究。
4.2.1 形貌與晶面調控
電化學反應可以通過外加電位來誘導表面形貌和組成的變化,這種電化學活化可以避免顆粒團聚,為C―C偶聯提供有利條件。Qin等人86選用CuCl作為前驅體,經過一段時間CO2電催化還原后,由于氯離子的消耗和誘導作用,催化劑逐漸轉變為Cu和Cu2O的混合相,形態變為立方結構,并將C2H4法拉第效率的提高歸因于Cu1+和立方結構的協同作用。Jung和同事87添加半胱胺分子作為固定劑,通過一鍋法在碳載體上直接合成分散的Cu2O納米顆粒。在電催化初始階段,催化劑由20 nm的立方顆粒轉變為緊湊的2-4 nm碎片顆粒,發現C2H4的法拉第效率從27%提高到了57.3%。催化性能的提高是由于排列緊湊、粒徑小的納米顆粒表面與中間體(*CO或其偶聯的OCCO*)之間的相互作用發生了改變,以及沿粒子高密度邊界間的快速氧擴散。
枝狀結構表面粗糙,可以增加反應面積,還可以通過改變pH以及與中間體的結合強度來優化催化劑的性能。Scholten和同事88利用低壓氧等離子體對枝狀Cu催化劑進行了改性,因為CuxO在還原的過程中并不穩定,而且原位XPS測試證實了在電化學反應后沒有氧化物的存在,因此認為是其獨特的形貌結構促進了C―C偶合,從而提高了對C2和C3產物的選擇性,而與殘余的CuxO無關。另外,Feroze等人89通過一步電沉積Cu,再退火的方式,制備了枝狀結構的Cu2O電極。電解一段時間后,Cu2O最終被還原為Cu。因此也認為其對C2H4選擇性較為穩定的原因是其粗糙多孔結構為CO2的電化學反應提供了更大的活性表面積,而且改變了與中間體的結合強度。Gao等人90也采用了低壓氧等離子體對銅箔進行處理,催化劑對烴類和醇類的選擇性有所提升。但是通過DFT計算,認為是次表面O、Cu+以及表面重構是提高催化劑性能的原因,并且次表面O強化了堿金屬離子對CO*形成的促進作用。Gu等人91通過熱退火和電化學還原法制備了表面富含氧空位的部分還原氧化銅(CuOx-Vo)納米枝晶。電還原一段時間后,O原子逐漸去除,CuOx-V開始還原成Cu,并且產物C2H4也相應減少,因此認為表面氧空位是主要活性位點,它不僅有利于形成中間體*CO和*COH,而且有助于*CH2的快速解吸,從而導致了C2H4的有效形成。Kim等人92也合成了枝化的CuO納米粒子,并將其沉積在導電碳材料上,C2H4的選擇性有了進一步提高,法拉第效率可達70%以上,除了H2外,無其它副產物。通過X射線衍射光譜測定,雖然電化學活化后也檢測到少量的表面氧,但是認為Cu+是的主要的氧化物種。枝化的CuO表面積大,區域間存在較多的界面和連接,這導致了電解液中質子的快速消耗,增加了電極表面附近的局部pH值。高的局部pH值會抑制CH4的生成,但可以增強中間產物的C―C偶合,生成C2產物,提高了對C2H4的選擇性93。
納米空腔與核殼結構可以將活性物質限制在一定的區域中,從而增加了C―C偶聯的概率,有利于C2+產物的生成。Yang等人94制備的納米空腔Cu2O催化劑可以使碳中間體在原位形成,增加了中間體在催化劑表面的覆蓋率,穩定了活性物種Cu+,防止其還原成Cu0,提升了C―C偶聯的機會,從而提高了對C2+產物的選擇性(圖4)。Cheng等人95合成了核殼納米立方形的Cu2O@K-PBA,也認為提高CO2還原產物選擇性的活性物種是Cu(I)。K-PBA殼結構不僅保護了Cu2O活性核,而且在Cu2O中形成了偶極場,可以穩定具有顯著偶極矩的中間體(*CO2、*CO和*OCCO),促進了C―C偶合,抑制了CH4的形成,生成的C2H4/CH4是Cu2O催化劑的兩倍以上。
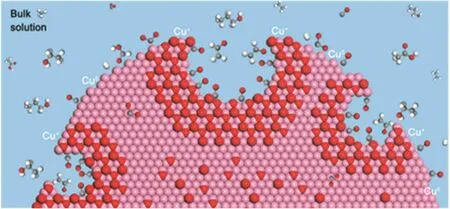
圖4 電催化CO2還原時納米空腔結構中保護Cu氧化態的碳中間體示意圖94Fig. 4 Schematic of carbon intermediates that are confined in the nanocavities, which locally protect copper oxidation state during CO2RR 94.
有研究發現,Cu(111)晶面有利于CH4的生成,而Cu(100)晶面則優先生成C2產品。對Cu2O納米顆粒而言,不同晶面具有不同的性質96,97。Zhang等人98研究發現采用熱退火法比濕化學氧化法形成了更厚的氧化層。這種差異可能導致預還原過程中晶面取向和晶界密度的不同,產生更多協調位點、晶界和臺階面,對*CO中間體產生較強的吸附作用,有利于C―C偶聯生成C2產物,CO2電化學轉化過程中CuxO被還原為Cu0,因此認為活性中心仍然是Cu0。Gao等人26采用濕化學還原法制備了同時具有{100}、{111}兩種晶面的Cu2O納米粒子。通過電催化性能評價,發現它對C2H4的選擇性較高。俄歇光譜證實經過電還原過程,Cu2O中只有一小部分轉化為Cu0,因此認為氧化物是固有的活性物質。DFT計算表明,含有兩種晶面的Cu2O,不僅可以在{100}面和{111}面之間的結合界面上強烈吸附中間體,促進C―C偶合,而且可以很容易地從結合界面解吸生成的C2H4。因此,兩晶面之間協同作用非常重要,這也為設計高性能催化劑提供了一種新的方向。
4.2.2 載體修飾
采用具有化學穩定性、熱穩定性和優異導電性碳材料擔載銅催化劑,可有效提升C2+產物選擇性,也是一種改變催化效果的方式。Wang等人99研究發現離子液體功能化石墨薄片(ILGS)可以固定晶體防止聚集。合成的Cu2O/ILGS復合材料對C2H4具有一定的選擇性。Cu俄歇譜顯示只有很少一部分Cu+轉化成Cu0,因此認為Cu+是主要的活性物質,對提高C2H4的選擇性有重要作用。Anastasiadou和同事100在氣體擴散層上電沉積Cu2O催化膜,使CO2以氣相的形式供給催化劑。在電還原過程中,催化劑還原為Cu0,在電位、局部pH值、活性位點和CO2質量運輸限制的共同作用下,C2H4選擇性在較高的電流密度下顯著增加。研究人員還將同位素標記的12CO2與13CO混合物同時通到CuOx納米粒子上,發現與只通CO2相比,C2H4的選擇性明顯提高。基于這一發現,使用Ni-N功能化的碳(NiNC)作為基底來模擬上述進氣方式,提高了C-C偶聯的效率,合成的CuOx-NiNC串聯催化劑可以將CO2還原成C2H445。在CO2與CO同時存在的情況下,可能的反應途徑是*COOH和*CO的偶聯,且與現有的*OCCO二聚途徑并存。隨著*CO的廣泛覆蓋和CO(g)的濃度增加,*COOH和*CO的偶聯途徑在能量上變得越來越有利,從而促進了C2H4的生成。在電極中涂覆一些材料,可能是提高其穩定性的有效方法101。Zhang等人18將MOF衍生的Cu/Cu2O負載于垂直涂覆直接碳化的二維沸石咪唑類骨架的氧化石墨烯(GO/ZIF-L)上,得到催化劑Cu GNC-VL,其形成過程見圖5。雖然在電還原過程中一部分Cu(I)轉化成了Cu(0),但是整個催化劑還是保持Cu/Cu2O的組成。Cu GNC-VL具有良好的導電性、高活性表面積和電催化穩定性,CO2在Cu(111)上的不對稱化學吸附和Cu2O(111)上C-C動力學與熱力學的協同作用,促進了*CO的二聚,使其對C2H5OH的選擇性提高到了70.52%。
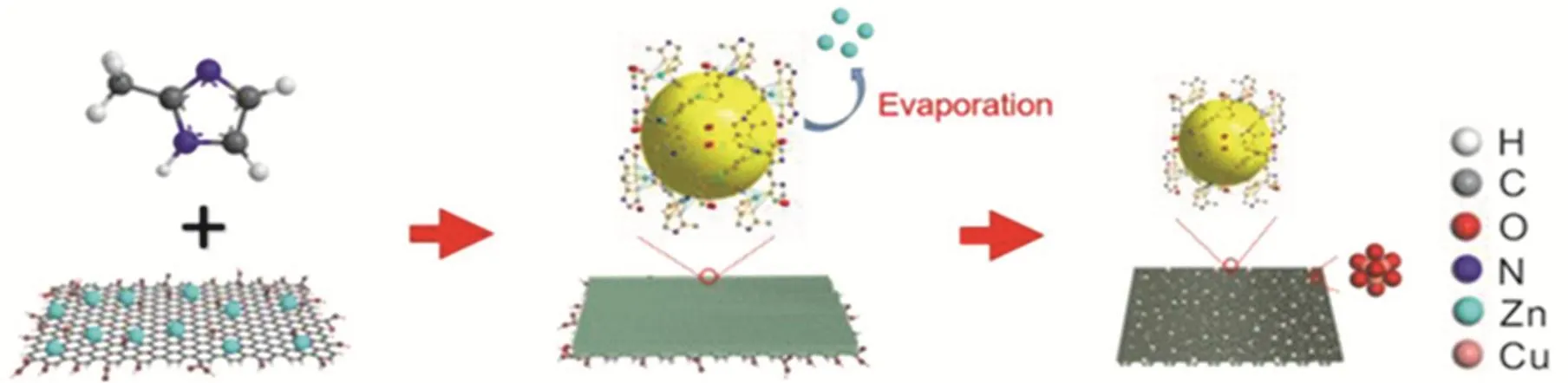
圖5 Cu GNC-VL的形成18Fig. 5 Formation of Cu/Cu2O nanoparticles supported on vertically ZIF-L-coated nitrogen-doped graphene nanosheets (Cu GNC-VL) 18.
4.2.3 表面組成調控
原位合成與表征技術在研究催化劑構效關系方面具有重要的意義102。不同表面組成以及Cu氧化態的比例會有不同的催化表現。Iijima和同事103通過紅外光譜探究了OH層對C2產物生成的作用。結合DFT計算發現,OH層使CO分子相互靠近,吸附能增強,有利于CO的二聚化,同時在電解過程中還原為C2+產物而不發生任何降解。Chou等人104采用原位表面增強紅外吸收光譜(SEIRAS)等表征方法研究了不同氧化態Cu催化劑上的電化學CO2還原機理。研究認為如果表面主要是Cu(I),其CO中間體是頂端吸附態(COatop),剩余的橋聯吸附的CO中間體(CObridge)在表面含有Cu(0)的催化劑上形成。表面同時含有Cu(0)、Cu(I)兩種氧化態的時候,共存的COatop與CObridge作為反應中間體促進了C2產物的生成。說明銅基催化劑表面的氧化狀態影響電催化性能。Chen等人105制備了由Cu(OH)2/CuO納米復合材料衍生的Cu2O/Cu。通過改變煅燒時間,調控Cu+/Cu0的比例,產生了大量的活性位點和較低的界面電荷轉移阻力,有利于CO2的活化和CO二聚反應生成C2產物。另外Aran-Ais等人106研究發現,在脈沖電解條件下,催化劑表面結構以及化學成分發生了變化。并且認為,這種催化性能增強與特定結構基序和表面Cu2O的存在有關。乙醇選擇性的提高可能與Cu(I)和Cu(0)物種的共存有關,而C2H4產量主要受Cu(100)臺階長度的影響,并且認為中間產物OCHCH2,ads更傾向于氫化生成OCHCH3,ads,從而產生醇。Shah等人107認為氧衍生Cu催化劑在電還原CO2的過程中仍然有一部分Cu2O一直存在,提出了Cu2O與中間產物之間軌道相互作用的概念。這種作用提高了中間產物的吸附量,在催化過程中起著獨特的作用,從而有利于C2產物的生成。
然而,Permyakova等人108制備了低粗糙度類平面的Cu2O薄膜,電催化還原后在超真空的條件下測試發現它被完全還原為Cu0,認為銅氧化物獨特的C2產物選擇性是其粗糙度增強的結果。Lei與同事109探究了氧化物/氫氧化物衍生的銅電極對C2+產物表現出優異選擇性的來源。同樣發現,電化學測試后都轉變為Cu0,并且認為對C2+產物的選擇性與產生的晶體碎片有關而與Cu的特定氧化態無關。
4.3 非金屬元素摻雜的Cu催化劑
N、S的摻入會導致電子自旋密度和電荷分布發生改變,從而增加內在活性110。近年來,研究人員利用非金屬元素N、S對Cu催化劑進行改性也取得了一定的效果。Yin等人111合成了鈣鈦礦型一價銅氮化物(Cu3N),這種25 nm的立方體對C2H4具有較高的選擇性,同時抑制了C2H6和CH4的形成(生成的C2H4與CH4的摩爾比大于2000)。通過DFT計算認為,優異的性能可能是由于N3-在鈣鈦礦型Cu3N結構中更有效地穩定了Cu+。Cu3N表面CO―CO偶聯具有高能壘,形成其它C2產物的途徑被抑制,導致主要發生CO―CHO偶聯形成C2H4。Karapinar等人112通過簡單的熱解方法制備了Cu-N-C材料,可以選擇性生成乙醇。結構的顯著特點是單原子Cu處在CuN4的配位環境中。在電解過程中,相互分離的位點瞬間轉化為金屬Cu納米粒子,這可能是具有催化活性的物質。這個過程是可逆的,電解后又變回獨立的CuN4位點。不同電解質的對比實驗發現,Cs+的陽離子水化作用更強,減少了陽離子在陰極的吸附,限制了H2的產生,促進了CO的偶聯113。這進一步證明了適合的電解質也是提高催化性能的一個重要因素。在使用氣體循環裝置后,生成C2H5OH的法拉第效率又進一步提高,證明了CO參與了C2H5OH的生成。
用P區元素對Cu進行改性,可提高催化活性。硫屬VI組元素和硫化物具有優良的電學性質。硫原子有多種成鍵形式,易與金屬元素形成離子化合物。不同硫含量、組成的銅硫化合物具有不同的相態、形貌和晶體結構。又因為S可以有效抑制析氫,并且與氧的化學性質相似,因此是一種很有前景的電催化劑改性劑114,115。Zhao等人116制備了泡沫鎳支撐的硫化銅納米片陣列(CuS@NF),泡沫Ni骨架上CuS密度較高,形成的多孔3D結構,機械附著力強,穩定性好,對CH4具有較高的選擇性。除了CH4,摻S的銅基催化劑最常見的還原產物就是HCOOH或HCOO-。Shinagawa等人114利用濕化學法成功地合成了尺寸可控的碳負載CuS催化劑。并且認為它對HCOO-具有高選擇性原因可能是銅與硫的存在改變了關鍵中間體的結合能。Cu―S與*OCHO的結合能相對于Cu更大,與此同時,這種表面結構可能不利于正電碳原子吸附CO2,因此導致了與CO路徑相關的產物的缺失。Zhu等人117采用利于控制形貌和厚度的電沉積法在Cu泡沫電極上合成了Cu2S納米結構,它對電解質的擴散具有優異的運輸特性,具有比多晶Cu更多的活性位點,還原產物HCOOH的法拉第效率達到85%。有研究表明,S的摻入可以抑制析氫和碳氫化合物產生的原因為:對COOH*的吸附作用較弱,而它恰好是在Cu上形成碳氫化合物的前體,這將使HCOO-或HCOOH的產生成為主要過程118。
4.4 Cu基雙金屬
在銅基催化劑中引入第二種金屬形成雙金屬催化劑,兩種金屬間的協同作用可以調控催化劑表面中間體的結合強度與構型,有利于C―C偶聯,從而生成C2+產物,因此是一種調節選擇性和反應活性的有效方法119。
4.4.1 Cu-Ag
Ag對CO2還原反應中間體CO的結合較弱,并且可以通過串聯催化或壓縮應變抑制表面合金的析氫反應,大幅度地激活Cu以形成多碳產物25,120。基于這一點,Hoang等人121通過電沉積法合成了CuAg合金薄膜,并且添加DAT作為抑制劑,得到了具有高表面積的多孔納米線形催化劑。它可以在較低的電位下生成還原產物C2H4和EtOH,法拉第效率分別可以達到60%和25%。原位拉曼光譜測試進一步說明Ag促進了Cu2O在CuAg中的形成,Ag作為活性啟動子,可以形成較多的CO,使相鄰的Cu上有更多C―C偶合的機會,提高了CO和C2H4的生產效率。另外,乙酸可能通過二聚或者插入的方式在CuAg催化劑上形成。在二聚反應中,與Ag結合的*CO被鄰近的Cu位點捕獲,并與另一個*CO發生偶聯。而在插入機制中,*CH2中間體出現在Cu上,它與Ag上的*CO結合生成乙酸122。Kottakkat等人123研究發現,通過氫泡模板電沉積法制備的AgCu泡沫催化劑可以在較低的電位下將CO2還原為CO。拉曼光譜測試發現Ag的加入顯著地改變了CO的吸附行為,催化劑中的金屬組分在催化CO2還原成CO的過程中具有很強的協同作用。
另外Cu、Ag間界面作用同樣是一個重要影響因素。Li等人17制備了具有多種結合位點的Ag/Cu雙金屬合金催化劑。通過DFT計算發現,Ag的引入對*HCCHOH的影響不大,但這種Ag/Cu催化劑使C2H4反應中間體不穩定,生成路徑被抑制,從而促進了EtOH的產生。Huang等人124通過膠體化學法合成的Ag/Cu納米晶體揭示了Ag/Cu界面在促進CO2還原中的關鍵作用。電催化實驗發現,它生成C2H4的法拉第效率和電流密度與純Cu相比均有提高。Ag-Cu納米晶是類葫蘆狀結構,包括兩個分離的金屬結構域,共享一個可調的界面,并不是合金的概念。但是通過對比實驗發現,Ag域向相鄰的Cu域提供高通量的CO可能不是提高C2H4選擇性的唯一機制。隨后,XPS測試和俄歇譜圖證明了電子從Cu域轉移到Ag域,通過增強催化劑對C2H4的內在活性來改變整個Cu域與Ag域的催化行為。因此,提出了串聯催化和電子效應是Ag/Cu催化劑對多碳產物選擇性增加的主要機制(圖6)。這為設計高效的CO2還原電催化劑又提供了一種新的選擇。
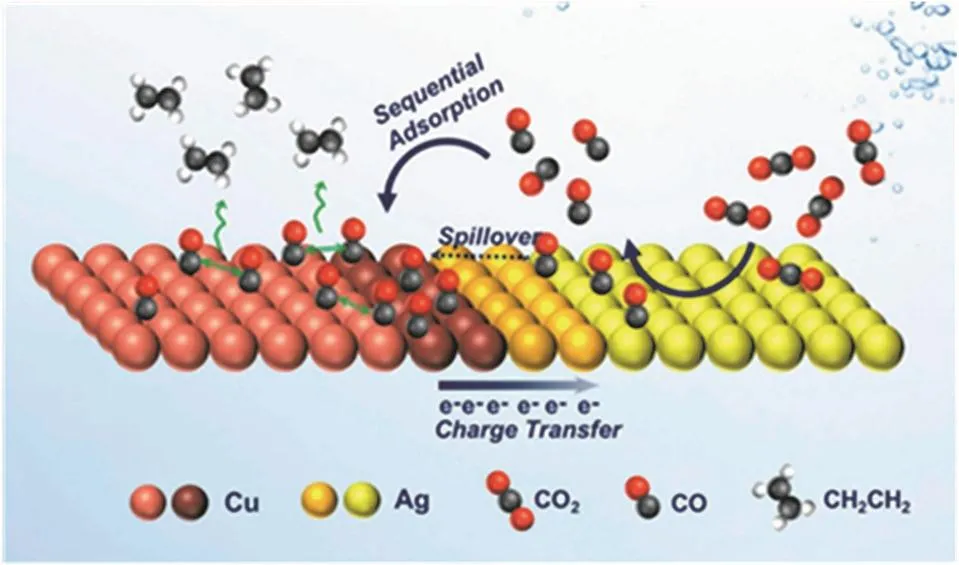
圖6 Ag-Cu NDs促進C2H4產生的機制示意圖124Fig. 6 Schematic representation of the proposed mechanism of C2H4 promotion in the Ag-Cu NDs 124.Tandem catalysis (CO spillover or sequential adsorption) is induced by the presence of Ag and Cu as segregated domains, and the electronic effect caused by the charge transfer at the interface which intimately binds them.
4.4.2 Cu-Sn
DFT計算和Bader分析說明,Cu與Sn的合金化會導致Sn向Cu的電荷轉移,電子從金屬原子轉移到CO2,導致C=O鍵斷裂形成CO2·-,質子遷移形成HCOO*。HCOO*通過獲得一個二次電子而重新排列,之后從催化劑表面解吸并擴散到電解質中,抑制H2和CO的生成。Cu-Sn催化劑對HCOOH/HCOO-具有高選擇性源于幾何和電子的綜合效應125,126。而Morimoto等人127通過理論和實驗進一步說明了,Cu3Sn(002)上的Cu位點對穩定H*,COOH*,和CO*中間體具有更大的貢獻,Sn的濃度對HCOOH的選擇性有顯著影響。Jiang等人126通過電子調節構造了豐富的Cu/Sn界面,得到的Cu-Sn催化劑也對HCOO-有很高的選擇性。為了進一步提高穩定性,Xiong等人128將水熱法制備的CuSn合金納米顆粒負載在N摻雜的石墨烯載體上。石墨烯片中氮的摻雜導致CuSn納米顆粒與載體表面的強結合,防止了合金納米顆粒的團聚,從而提高了材料的長期穩定性。另一方面,它還提高了電子輸運能力,有利于吸附CO2,從而提高CO2的還原性能。由于金屬化合物之間具有界面作用,Wang等人129制備了多孔泡沫銅支撐的異質結構CuSn電催化劑(Cu3Sn/Cu6Sn5)。DFT計算顯示,異質結構Cu3Sn/Cu6Sn5具有適合的氫吸附能,對HCOO*的吸附能大于COOH*,因此不僅抑制析氫,而且有利于HCOOH的生成。
4.4.3 Cu-Zn
Zn具有較低的析氫率和成本,是一種有前景的催化CO2還原的金屬。將Zn元素引入Cu催化劑可以通過改變中間體的吸附強度、Cu表面電子結構等來優化催化性能。Ajmal等人12通過電沉積法制備了表面粗糙的CuZn催化劑,它反應面積大,附著力強,從而提高了對HCOOH的選擇性。DFT計算表明,Cu表面Zn的存在有利于中間體的穩定,并且可以降低能量勢壘。雖然Zn對CO有較高的選擇性,但具有適當形貌的雙金屬CuZn納米材料可能生成碳氫化合物。Feng等人130首次通過液體脈沖激光燒蝕技術制備了CuZnO納米粒子,進而由電還原得到CuZn。電催化CO2還原過程中,CuZn中Zn位點產生的CO*可以很容易地轉移到最近的Cu位點,通過偶聯反應可以轉化為C2H4。Zhang等人131為了降低C―C二聚的能壘,通過摻雜過渡金屬Zn來調整Cu(100)的電子結構。Zn的加入調整了活性位點的原子排列,使催化劑表面具有電負性,有利于CO2分子的活化,促進了OCCO的生成,從而進一步將CO2有效還原為C2H4。Ren等人132提出了CuxZn電催化CO2還原產生EtOH的一種雙位點機制(圖7)。首先,四個質子和四個電子分別在Cu和Zn上將2個CO2分子還原為CO。之后,Cu上的CO變成*CH2,而由Zn產生的CO在*CH2附近解吸和遷移。隨后,CO插入到Cu和*CH2之間形成*COCH2。兩個質子和兩個電子再將*COCH2還原為CH3CHO,然后進一步還原為EtOH。除了轉化成價值高的碳氫產物,也可以充分利用Zn可以產生CO的特點,制得合成氣。Malik等人133通過改變Zn/Cu的元素比例,得到了CO/H2比為0.25-0.74的合成氣。合成氣是合成CH3OH等許多工業產品的基本原料,CO與H2的比例非常重要,這也為CO2還原的研究提供了一種獨特的方向。
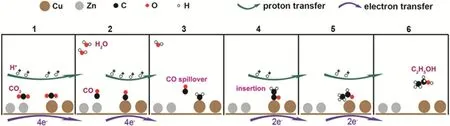
圖7 CuxZn電催化CO2還原生成乙醇的機理132Fig. 7 Proposed mechanism for the electroreduction of CO2 to ethanol on CuxZn catalysts 132.
4.4.4 Cu-Au
將雙金屬系統單元中的原子排列精確地控制在單個納米顆粒的水平,可以獲得具有顯著性能優勢的功能納米材料。Cu、Au之間的相互作用會導致Cu催化劑性能的改變。Kim等人134發現,將AuCu無序納米顆粒通過有序轉變可以將這種主要產生H2的材料變為更有活性的CO2還原催化劑。有序AuCu納米顆粒包含約3個原子厚的金層,直接生長在有序的晶格上。而活性的提高就來自于具有壓縮應變的Au覆蓋層的形成。另外,兩種不同類型的金屬納米粒子之間強烈的相互作用也可以極大地改變它們的電催化性能,比如Cu/Au之間的作用會導致Au本身催化CO2還原的性質消失。Tao等人19報道了由于混合相非合金Cu/Au之間的相互作用,Au作為Cu的促進劑,可以催化CO2電化學還原生成HCOO-,同時還可以將Cu+位點穩定在催化劑表面,從而提高催化性能。而不同于CO、HCOOH/HCOO-等還原產物,Fu和同事135利用聯吡啶(bipy)作為連接劑將Au納米粒子組裝到Cu納米線上,并且還原產物中碳產物的法拉第效率達到90.6%,其中包括25%的CH3CHO,是液體產物的主要成分。Au-bipy-Cu催化作用增強是由于Au(CO2生成CO)、Cu(CO偶聯)和雙吡啶(CO2*穩定和質子化)的協同作用。
4.4.5 Cu-In
CO是多種碳氫化合物和含氧化合物的原料,研究人員在利用Cu、In兩種金屬元素提高CO的選擇性方面,進行了很多探索。Jang等人136通過電沉積In取代邊緣位置的Cu原子形成合金納米線。它的形貌特征是具有許多晶界、表面積大,并且有含氧空位的In(OH)3。缺氧In和In(OH)3的氧分別帶輕微的正電荷和負電荷,在表面形成局部電場,提高了催化生成CO的效率。之后,Xiang等人137通過原位電化學自發沉淀法制備了由In(OH)3覆蓋的CuxO納米核殼結構催化劑,將CO的法拉第效率提高到了90%以上。由于納米多孔結構增加了表面積、提供了更多的活性位點,因此有利于通往中心的質量運輸。Barasa等人138合成了納米多孔的CuIn催化劑。In上的*COOH具有較強的吸附能,而電還原活化后In在表面富集,因此CO2轉化為CO的效率提高。Chu等人139又通過負載在N摻雜碳納米管上的CuO-In2O3/NCNTs首次例證了CuO-In2O3之間的協同作用使催化劑表面具有更活躍的催化位點,生成CO的法拉第效率達到93%。
4.4.6 Cu-Pd
Pd與CO的結合能較強,與Cu形成合金可以提高CO的產量。另外,不同制備方式與混合方式的Cu-Pd也具有產生CH4與C2+產物的性能。Mun等人140采用膠體法制備了單分散Cu-Pd納米粒子,Pd元素的加入增加了CO*質子化步驟的勢壘,從而抑制生烴,對CO具有較高的選擇性。Zhang等人141采用電沉積方法制備了聚合物負載的高度分散的超細CuPd納米合金催化劑,對CH4有很好的選擇性,催化劑TEM圖像與生成CH4的法拉第效率見圖8。這種活性的增強可能是由于Pd-H位點與Cu-CO位點在CO2電還原過程中的協同作用。而Ma等人119對有序、無序、相分離原子結構的Cu-Pd進行電催化實驗,發現有序的CuPd催化劑對C1產物的選擇性最高(> 80%),而相分離CuPd對C2產物的選擇性(> 60%)較高。基于這一現象,認為在相分離結構中,由于Cu原子的鄰近特性,可以提供適合的分子距離和較小的空間位阻,相鄰吸附的CO很容易二聚成COCOH中間體,然后主要轉化為C2產物。而在有序結構中,Cu、Pd交替排列的結構占主導地位,吸附在Cu原子上的CO傾向于形成CHO中間體,氧原子部分吸附在Pd原子上,從而穩定了CHO中間體的吸附,有利于CH4的進一步生成。說明組分的混合模式在決定催化劑的活性和選擇性方面起著重要的作用,這也對CO2還原催化劑的研究具有重要的意義。

圖8 (a) CuPd納米合金與(b)Cu2Pd納米合金在聚合物膜上的TEM圖像,(c,d)不同組成的Cu、Pb納米合金的一系列測試141Fig. 8 Typical TEM images of CuPd nanoalloy (a) and Cu2Pd nanoalloy (b) on the polymeric film;(c, d) a series of tests on different components of Cu and Pb nanoalloys 141.
5 結論和展望
化石燃料的大量使用造成了大氣中CO2含量不斷上升,并引發了一系列環境問題。利用可再生能源產生的電能將CO2轉化為高價值的化學品和燃料,是同時解決環境與能源問題的有效方式,對可持續發展具有重要意義。金屬Cu可以將CO2還原為一氧化碳、甲酸鹽、甲烷、乙烯、醇等多種產物,是CO2還原的催化劑中唯一能產生C2+產物的金屬。但是它存在選擇性較差、穩定性不足等問題。
通過對Cu基催化劑材料進行調控以生成高附加值的C2+產物是近年來的研究熱點,歸結起來主要有以下兩方面:(1) 通過對晶面、缺陷、以及表面應力的控制,調節Cu催化劑表面的電子結構,從而改變對*CO、*CHO等主要中間體的吸附能,打破原有的規度關系(scaling relationship),實現對某一類C2+產物的高選擇性。(2) 以Cu催化劑作為母體,引入第二金屬構成雙金屬串聯催化劑(tandem)。其中,第二組分金屬為易于生成CO的催化劑,如Au、Ag、Zn等。首先CO2原料氣體在第二組分金屬表面被還原為CO,然后溢流到Cu或二者的界面上進行C―C偶聯和進一步的還原。在該策略中,Cu催化劑表面高的CO覆蓋度有利于抑制析氫反應,促進C2+產物的產生。
雖然理論上已經提出了許多可能的反應途徑和某種特定產物的活性位點,但是絕大多數研究只考慮了反應物、中間體和生成物的熱力學自由能,而忽略了電解質和實驗環境的影響。所以為了更好的理解CO2在Cu催化劑表面上的電催化反應過程,需要建立更加完善的理論模型來研究實際化學環境對二氧化碳電催化反應的影響。在研究提高理論計算的精確度的同時,還需要在操作條件下進行原位實驗驗證。由于某些重要中間體在Cu催化劑上的覆蓋率較低,所以當前迫切需要提高一些原位光譜技術的信號強度。目前比較有發展前景的技術,如: X射線吸收光譜(XAS)、X射線光電子能譜分析(XPS)、傅立葉變換紅外光譜(FTIR)、拉曼光譜(Raman)、微分電化學質譜(DEMS)、電化學原子力顯微鏡(EC-AFM)、電化學掃描透射電鏡(EC-STEM)等等,通過這些檢測技術的結合,使得識別某類產物在Cu催化劑上的重要中間體和確定某類產物在Cu催化劑上的反應路徑成為可能。
盡管Cu基催化劑可以在適中的過電位下實現較高C2+產物的選擇性,但在實際應用過程中還面臨一些問題。其一,穩定性問題。Cu基催化劑在使用過程中會發生重構、聚集等問題,從而使催化劑的價態、組成和形貌等性質發生改變,造成催化劑失活。目前,大多數報道的Cu基催化劑的穩定性在100 h以內,與實際應用過程中要求的數千小時的壽命還相去甚遠。因此,Cu基催化劑的穩定性問題將是一個重要的研究方向。其二,反應過程強化。對于C1還原產物(如CO,HCOOH),工業要求的最低電流密度為200 mA·cm-2,而對C2H4等多電子產物來說這一數值還應進一步提高。因此,引入氣體擴散電極GDE和流動性電解池(flow cell)以提高CO2的傳質擴散是提高反應速率一個重要途徑。同時通過氣體流場設計,增加反應物CO2與Cu基催化劑的接觸時間,可有效地提高CO2的轉化率。
Supporting Information: available free of charge via the internet at http://www.whxb.pku.edu.cn.
- 物理化學學報的其它文章
- Understanding the Role of Cu/ZnO lnteraction in CO2 Hydrogenation to Methanol
- Electrocatalytic CO2 Reduction to Ethylene over CeO2-Supported Cu Nanoparticles: Effect of Exposed Facets of CeO2
- Controlling the Global Mean Temperature by Decarbonization
- Cu@UiO-66 Derived Cu+-ZrO2 Interfacial Sites for Efficient CO2 Hydrogenation to Methanol
- 二氧化碳電還原反應的理論研究
- 離子液體介導CO2化學轉化研究進展

