均相催化CO2/H2還原羰基化合成高值化學品研究進展
張雪華,曹彥偉,陳瓊遙,沈超仁,何林,3,*
1鹽城師范學院化學與環境工程學院,江蘇 鹽城 224007
2中國科學院蘭州化學物理研究所,羰基合成與選擇性氧化重點實驗室,蘭州 730000
3中國科學院潔凈能源創新研究院,遼寧 大連 116023
1 引言
CO2是構成溫室氣體的主要成分,實現其高效利用不僅可有效解決環境問題,還可創造經濟價值1。依照巴黎協定在聯合國氣候變化公約框架下所制定的目標,控制CO2在大氣中的濃度,將全球平均氣溫升幅控制在1.5 °C之內2。隨著清潔能源的普及和CO2捕集技術的成熟,通過化學固定的方式將廉價易得、環境友好的CO2作為可再生C1資源轉化成高值化學品,符合綠色與可持續發展的要求3-5。
目前,全世界范圍內CO2資源化的年利用量已達到1億噸,主要是通過非還原性轉化與氨、氯化鈉、苯酚鈉和環氧化物等反應生產尿素、純堿、水楊酸和碳酸酯類產品,以及作為超臨界溶劑使用6-10。拓寬基于CO2還原性轉化的化學品合成新路線是開發其資源化利用的熱點。其中,通過熱化學的催化方法,將惰性CO2還原,進而轉化為甲醇、甲酸、烯烴、烷烴等能源產品相關研究不斷創新,正在向產業化邁進,譬如CO2加氫制甲醇技術已經進入工業化放大階段11-13。如能以清潔、高原子經濟性的H2作為還原劑實現惰性CO2還原性轉化,結合羰基化過程構筑C―O、C―N和C―C鍵,合成醛/醇、羧酸、酯、酰胺等化學品,將極大擴展由CO2高值化利用的范圍與種類,無論在資源利用性和環保性等方面都表現出極具潛力的應用前景14-16。
其中均相催化CO2還原羰基化制備高值化學品是CO2化學轉化利用研究的前沿領域之一,但實際反應中仍面臨著眾多的挑戰。首先,CO2因其碳原子處于最高氧化態+4價,導致在反應的過程中金屬催化劑活性物種對CO2的C=O加成能壘過高,通常需要高溫高壓苛刻的反應條件以及貴金屬催化劑才能實現其活化。同時,均相催化CO2、H2參與的還原羰基化反應多是串級反應,一般都涉及多個競爭反應,導致目標產物的選擇性并不理想。此外,受底物的位阻效應和電子效應的影響,底物的適用性范圍有一定的局限性。隨著新型表征技術和理論計算的發展,在揭示反應機理方面及CO2中碳―氧鍵活化和轉化也取得一些進展。因此,結合現代表征手段發展更加高效的催化體系、非貴金屬體系甚至無金屬催化劑體系,實現以CO2為羰源、H2為還原劑在相對溫和的條件下制備高值化學品。
近年來,均相催化CO2還原方面的研究成果大量涌出,相關的綜述論文也在不斷的更新11,13,15,17-21。本綜述以CO2為羰基化試劑以及相對于氫硅烷或氫硼烷等更加清潔的H2為還原劑,通過金屬催化劑均相催化制備高值化學品。主要從CO2與烯烴羰基化、胺羰基化、醇/醚羰基化以及其它羰基化反應進行闡述。希望通過本文的總結,為系統的認識和發展均相催化CO2還原羰基化反應提供一定的參考和借鑒。
2 H2作為還原劑用于均相催化CO2還原羰基化合成化學品
2.1 烯烴羰基化反應
烯烴羰基化的產物在精細和大宗化學品制造中皆具有重要價值,該過程通過C1資源定向增碳轉化烯烴22,23。工業上主要采用有毒、易燃CO作為羰源24-27,如能利用無毒、易得CO2代替CO作為羰源,對開發綠色、高效的烯烴羰基化催化合成方法具有重要意義。以H2作為還原劑、CO2為羰源的烯烴羰基化過程可看作是CO2還原和烯烴羰基化的耦合,具體而言,首先通過逆水煤氣變換(RWGS,CO2+ H2→ CO + H2O)將CO2還原成活潑的CO,隨后CO與烯烴羰基化反應生成目標產物。
CO2和烯烴羰基化過程首先是吸熱的逆水煤氣變換。在工業過程中RWGS主要用于調節費托合成使用的合成氣的碳/氫比。常用Cu-Ni、Cu-Zn/Al2O3等多相催化劑28,且反應溫度大多超過250 °C,與后續的CO和烯烴的羰基化過程反應需要低溫不匹配。均相催化RWGS過程的溫度則低得多,常用均相催化劑主要是Rh和Ru絡合物。均相催化RWGS要求M-H加成到CO2的C=O上得到形成M-COOH絡合物中間體,或者金屬的富電子中心進攻CO2中具有弱親電性的碳原子形成MCOO-中間體,然后脫去羥基形成羰基配體進而釋放一分子CO。Ford等最早發現Ru3(CO)12具有一定的逆水煤氣變換的能力29。在1993年,Tominaga等發現Ru3(CO)12催化劑在碘化物為助劑條件下,催化CO2和H2還原成甲烷,反應過程中檢測到CO和甲醇30。碘化物的加入有效的抑制金屬釕的沉積,提高反應的活性。單核過渡金屬絡合物也具有催化RWGS的活性31,Koinuma首先報道了RhCl(PPh3)3在一定壓力的CO2/H2下催化RWGS過程32。在1977年Eisenberg等發展了[RhI2(CO)2]-/H+/I-體系在低于95 °C的條件下實現RWGS33。在1995年,Tominaga等發現在環氧乙烷存在情況下RuCl2(PPh3)2絡合物可以間接催化RWGS過程34。后續研究者又報道了單核釕絡合物[PPN][RuCl3(CO)3]催化RWGS35,在反應溫度180 °C時的TON高達96。把該催化劑固載在離子液上,催化體系具有優異的RWGS活性,并能重復使用36。
在2000年,Tominaga等第一次報道了用Ru絡合物催化CO2、H2和烯烴的氫甲酰化反應,主要產物為醇37。該反應過程首先是CO2通過RWGS生成CO,進而CO與烯烴羰基化生成醛,最后醛被H2還原得到醇(圖1)。研究者使用H4Ru4(CO)12為催化劑及LiCl為助劑轉化環己烯得到收率為88%環己基甲醇。后續又對CO2和烯烴的氫甲酰化過程進行更加細致的研究38,發現不同的鹵原子對活性有很大的影響(I-< Br-< Cl-),正好和質子親核能力相對應。同時借助ESI-MS分析發現四種活性物種:[HRu3(CO)11]-、[H3Ru4(CO)12]-、[RuCl3(CO)3]-和[RuCl2(CO)3(C6H10)]-,結合對照實驗提出可能的機理。研究者通過多核釕簇和離子液體構建可重復使用的催化體系,對CO2和末端烯烴氫甲酰化有很好活性和直鏈醇的選擇性39。

圖1 Ru催化CO2、H2和環己烯氫甲酰化到醇Fig. 1 Ruthenium-catalyzed hydroformylation of cyclohexene with CO2 and H2.
Hakka等在2003年和2009年相繼報道了Ru絡合物催化CO2、H2和1-己烯的還原氫甲酰化生成醇的反應40,41。H4Ru4(CO)12、Ru3(CO)12、[Ru(CO)3Cl2]2以及[Ru(CO)4]n都具有一定的CO2和烯烴的氫甲酰化活性;通過對照實驗論證了鹵素是產生活性中心必不可少的要素;ESI-MS表明[Ru(CO)4]n在鹵素陰離子存在下原位轉化為具有RWGS能力和烯烴氫甲酰化能力的活性物種,譬如[Ru4(CO)12]4-、[HRu3(CO)11]-和[Ru(CO)3Cl3]-。在2014年,Beller等首次把亞膦酸酯配體配位修飾Ru3(CO)12應用到CO2、H2與烯烴氫甲酰化生成醇的反應42。膦配體的加入或修飾有效的抑制烯烴的加氫反應,提高的烯烴羰基化生成醇的收率。通過一系列的控制實驗發現配體的加入,主要是促進了氫甲酰化過程,沒有加速RWGS過程(圖2)。Dupont等發現咪唑鎓鹽1-丁基-3-甲基咪唑氯化物([Bmim]Cl)或3-丁基-1,2-二甲基咪唑氯化鎓鹽([Bmmim]Cl)和Ru3(CO)12形成氮雜環卡賓-釕絡合物,實現逆水煤氣變換-氫甲酰化-羰基還原的耦合,將烯烴轉化為增加一個亞甲基的醇,同時發現體系適量的磷酸有利于反應進行43。
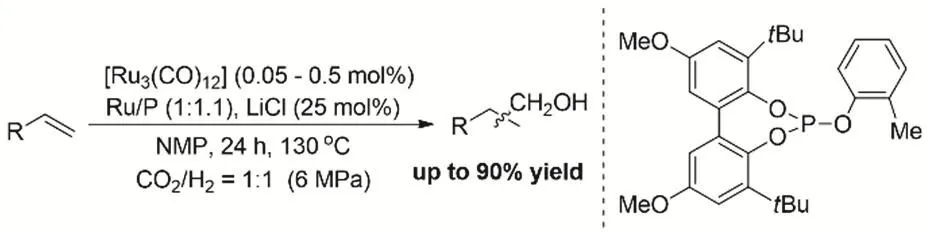
圖2 膦配體應用于Ru催化CO2、H2和烯烴的氫甲酰化過程Fig. 2 Increased selectivity and substrate scope for the ruthenium-catalyzed hydroformylation of olefins with a bulky phosphite ligand.
丁奎嶺等報道了Rh(acac)(CO)2和螺環骨架的亞膦酸酯配體構成的催化體系催化CO2、H2、聚甲基氫硅氧烷(PMHS)和烯烴的氫甲酰化到醛的反應(圖3)。反應的TON在12 h后高達1000000,同時能得到很好的直鏈醛的選擇性。反應的過程中沒有檢測到CO的生成44。
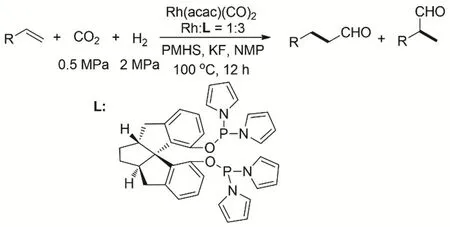
圖3 Rh催化烯烴與CO2/H2的氫甲酰化反應Fig. 3 Rhodium-catalyzed CO2/H2 and olefins hydroformylation.
我們課題組利用由兼具逆水煤氣變換和羰基還原催化能力的[Ru(CO)3]Cl3]-以及氫甲酰化催化劑Co2(CO)8構成的雙催化劑體系實現以CO2為羰源的烯烴氫甲酰化合成醇45。在研究中,發現了向體系中加入適當酸性的有機酸,能在不影響氫氣活化的前提下顯著加速逆水煤氣變換中CO的生成速率,進而推動后續氫甲酰化和羰基還原反應的發生,并有效抑制烯烴直接氫化。該催化體系能夠將檸檬烯生物質平臺分子轉化為增加一個碳的相應醇類分子,還能將碳四餾分中的廉價副產物二異丁烯轉化為高附價值的異壬醇,展示了該催化方法在生物質利用和廉價原料高值化轉化方面的潛力。理論計算結果揭示酸參與和無酸的逆水煤氣變換過程,酸參與時Ru-COOH的質子化脫羥基生成CO過程無顯著能壘(圖4)。
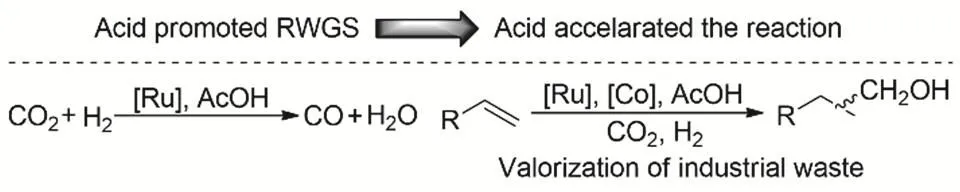
圖4 酸促進RWGS進而加速CO2和烯烴氫甲酰化反應Fig. 4 Acid promoted RWGS thereby accelerating hydroformylative with CO2.
烯烴氫甲胺化是逆水煤氣變換-氫甲酰化-醛與胺的耦合-烯胺或亞胺的還原過程。反應中需要抑制烯烴直接加氫同時避免胺和CO2/H2的N-甲酰化或N-甲基化,甚至是胺和CO2直接形成脲或碳酸銨鹽,反應過程復雜且具有挑戰性,對反應的化學選擇性要求很高。在2009年,Eilbracht等報道了Ru3(CO)12、LiCl、芐基三甲基氯化銨(BTAC)構建的催化體系催化CO2、H2、嗎啉和烯烴通過氫甲胺化生成嗎啉氮原子上烷基取代的叔胺46。能夠得到烯烴氫甲胺化產物的收率為35%-98% (圖5)。Dupont等在2016年使用Ru3(CO)12/咪唑鎓鹽氯化物催化體系催化CO2、H2、烯烴和伯胺或叔胺的氫甲胺化47。該催化體系使反應能在更低的溫度下實現。整個反應過程首先是逆水煤氣變換,進而CO與烯烴氫甲酰化生成醛,醛與胺耦合,最后亞胺或烯胺被H2還原。
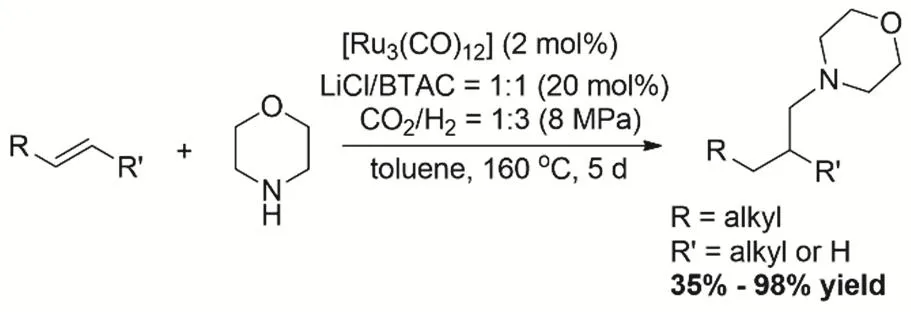
圖5 Ru催化CO2、H2和烯烴氫胺甲基化Fig. 5 Ruthenium-catalyzed hydroaminomethylation of alkenes with CO2 and H2.
羧酸合成的經典方法是醇或烯烴的氧化或羰基化。利用CO2作為C1原料在還原劑作用下與烯烴還原羧化,通過構建C―C鍵制備羧酸是具有挑戰的新路線48。在2013年,Leitner等發現由[RhCl(CO)2]2/PPh3構成的催化劑體系將CO2、H2和烯烴氫羧基化合成增一個碳的羧酸49。通過控制實驗和同位素實驗推測游離態的甲酸中間體在該條件下不太可能會形成50,反應首先是逆水煤氣過程生成CO,接著CO和Rh的絡合物配位并發生烷基的遷移插入,最后Rh-酰基物種發生水解生成羧酸(圖6)。
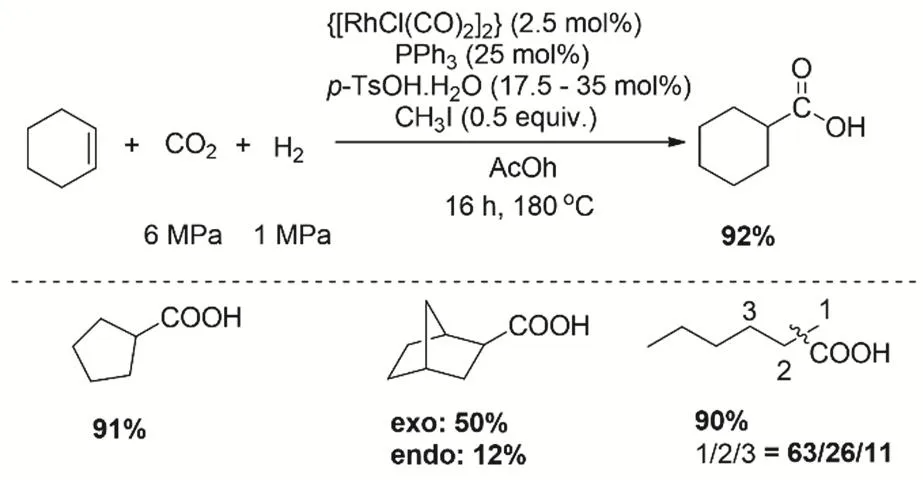
圖6 催化CO2、H2和烯烴氫羧化合成羧酸Fig. 6 Catalytic synthesis of carboxylic acids from olefins and CO2/H2.
醇是廉價、易得的非氣態氫給體型還原劑。空氣中穩定且對水、氧不敏感的液態還原劑甲醇用作氫轉移還原CO2具有操作上的優勢。2014年,Beller等報道了Ru3(CO)12/[Bmim]Cl催化體系催化CO2、甲醇和烯烴的氫酯化反應(圖7)。第一次提出了CO2作為羰源的一個新過程,利用醇的還原性,原位還原CO2生成CO用于接下來的羰基化反應,最后再與醇生成酯。醇在反應中是還原劑、原料以及溶劑。通過控制實驗和同位素實驗證實了產物中的羰基來自于CO2,并提出可能的反應路徑。各種烯烴和醇均可順利反應得到相應的羧酸酯51。
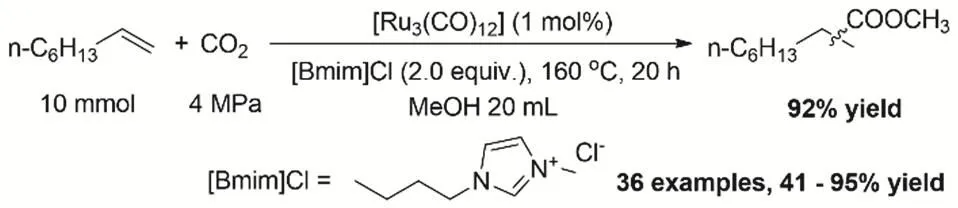
圖7 CO2、醇和烯烴氫酯化Fig. 7 Alkoxycarbonylation of olefins with CO2 and alcohols.
我們課題組2018年報道了[Ru(CO)3Cl2]2-Co2(CO)8雙金屬體系應用于CO2與烯烴的氫酯化反應中52。在同等活性的條件下,他們使用了更少的Ru催化劑和離子液,整個體系重復使用五次活性沒有明顯下降(圖8)。通過一系列的控制實驗和同位素實驗論證,發現Ru催化劑主要負責催化CO2的逆水煤氣變換的過程,而CO和烯烴的羰基化過程主要依靠Co催化劑。
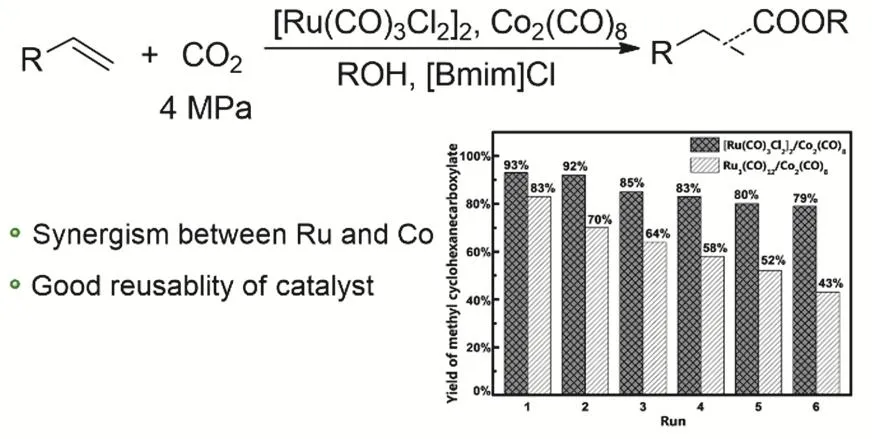
圖8 Ru-Co雙金屬催化體系用于CO2和烯烴氫酯化Fig. 8 Alkoxycarbonylation of olefins with CO2 and alcohols by Ru-Co bimetallic catalytic system.
2.2 胺羰基化/胺甲基化反應
酰胺化合物是具有廣泛用途的重要化學品,大量存在于精細化學品,天然產物和聚合物中。在工業上主要通過有機胺與CO羰基化反應路線制備。隨著可持續發展與綠色化學合成的要求,利用易得、無毒的CO2代替CO合成酰胺化合物越來越受研究者的關注。與CO合成酰胺化合物不同的是CO2作為羰源時需要在還原劑的作用下,通過三組分才能實現胺的羰基化。
胺的羰基化反應主要是N-甲酰化反應。早在1970年代,Haynes等首次報道通過均相催化CO2、H2和二甲胺羰基化合成N,N-二甲基甲酰胺(DMF)(圖9)。很多金屬催化劑對該反應都有很高效的催化活性,譬如CoH(dppe)2、(PPh3)2(CO)IrCl和CuCl(PPh3)3,其中(PPh3)2(CO)IrCl活性最高53,反應的TON可以達到1200。隨后貴金屬Pd54、Pt55,56、Ru57,58的絡合物也被用于該反應的研究,可大大降低反應的條件,并顯示良好的催化性能。例如,在超臨界反應條件下(130 °C,CO2為13 MPa,H2為8 MPa),RuCl2[P(CH3)3]4催化合成DMF的TON可以達到370000,TOF也有10000 h-1。主要由于反應處于超臨界條件,整個反應在均相狀態,提高反應速度57。Baiker等報道的帶有雙齒磷配體的Ru絡合物RuCl2(dppe)2是迄今為止最高效的合成DMF的催化劑59。在反應條件100 °C、CO2壓力為13 MPa和H2壓力為8.5 MPa時,反應的TON高達740000。2010年,Beller等第一次報道鐵絡合物催化二甲基胺與CO2合成DMF。Fe(BF4)2·6H2O作為催化劑前體和P(CH2CH2PPh2)3作為配體60得到DMF的收率為75%以及反應的TON為727。隨后他們又發展更加高效的鐵催化劑以三(2-(二苯基膦基)苯基)膦為配體61,反應的TON達到5104。同時他們還發現Co(BF4)2·6H2O和P(CH2CH2PPh2)3也能有效的催化二甲基胺與CO2、H2合成DMF62,反應的TON為1308。
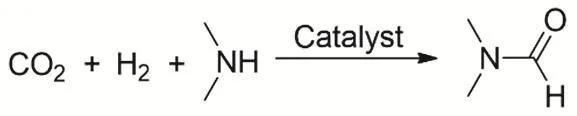
圖9 CO2、H2與二甲胺合成DMFFig. 9 Catalytic synthesis of DMF from dimethylamine with CO2 and H2.
為了拓展CO2、H2參與的有機胺N-甲酰化的適用性范圍,研究者發展一系列高效的催化體系。2015年,丁奎嶺課題組報道Ru pincer絡合物能夠高效催化有機伯胺或仲胺的N-甲酰化反應(圖10),反應的TON最高可達1940000。在最優的條件下(Ru催化劑0.01% (摩爾分數),CO2與H2的壓力均為3.5 MPa,四氫呋喃為溶劑,反應溫度120 °C),可以得到52%-99%相應的甲酰化產物的收率。使用該類催化劑制備DMF,催化劑可回收利用,重復使用12次之后催化活性基本保持不變63。
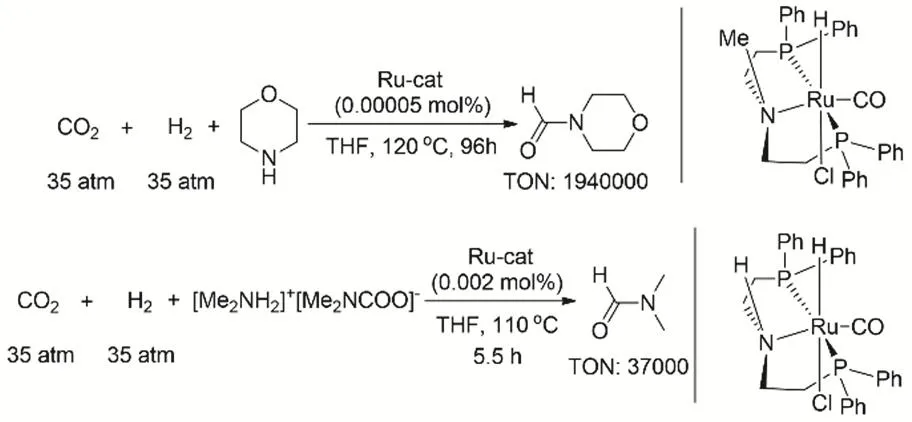
圖10 Ru pincer催化CO2、H2與胺的甲酰化反應Fig 10 Ru pincer catalyze formylation of amine with CO2 and H2.
芳香胺由于堿性較弱,一般CO2、H2參與的芳香胺N-甲酰化反應的活性通常較低。Jessop等發現堿的加入可以大大提高反應的效率(圖11),在采用RuCl2[P(Me3)3]4催化劑時,額外加入2當量的有機堿DBU,在反應溫度100 °C條件下,可以轉化苯胺到甲酰基苯胺的收率達到85%64。
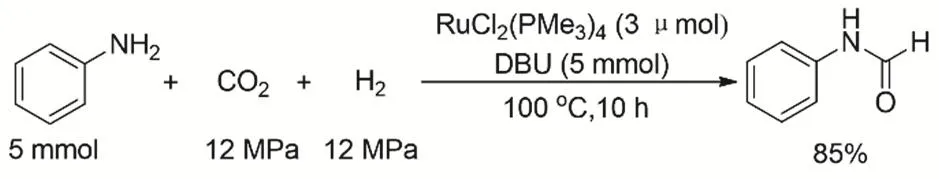
圖11 CO2、H2與芳香胺的甲酰化反應Fig. 11 Formylation of aromatic amines with CO2 and H2.
非貴金屬絡合物也可用于CO2、H2與有機胺的N-甲酰化反應65。Co pincer絡合物結合tBuOK,在反應條件下(Co 5%,NaHBEt35%,tBuOK 5%,(均為摩爾分數),CO2和H2的壓力均為3 MPa,甲苯為溶劑,反應溫度150 °C),能夠催化一系列脂肪胺和仲胺的N-甲酰化反應,收率為60%-90%。反應機理推測(圖12),Co pincer首先與tBuOK反應生成不飽和的中間體;在H2存在時產生一價的Co氫負;接著CO2插入Co-H鍵;由于過量胺存在,通過與pincer配體去質子化,形成甲酸鹽;甲酸鹽脫水,形成甲酰胺。
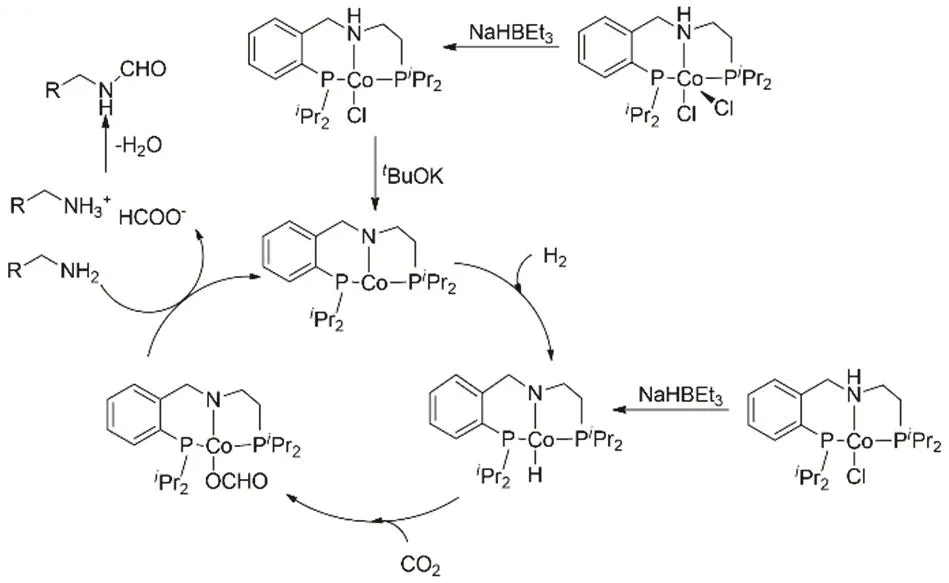
圖12 Co pincer催化CO2、H2與胺的甲酰化反應Fig. 12 Co pincer catalyze formylation of amine with CO2 and H2.
當胺類化合物含有不飽和基團與CO2、H2發生N-甲酰化反應時,一般都面臨不飽和基團的加氫反應,結果導致反應的選擇性差。Cu(OAc)2/4-二甲基氨基吡啶(DMAP)催化體系可以實現含不飽和基團的胺類化合物的N-甲酰化反應(圖13)。在最優的反應條件下(Cu催化劑為10% (摩爾分數),DMAP為2 mmol,四氫呋喃為溶劑,CO2和H2壓力均為4 MPa,反應溫度90 °C),得到甲酰化產物的收率31%-95%,同時底物中的碳碳雙鍵、碳氮雙鍵、羰基和酯基能夠很好的兼容66。
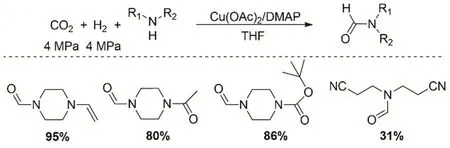
圖13 CO2、H2與不飽和胺的甲酰化反應Fig. 13 Formylation of unsaturated amine with CO2 and H2.
劉志敏等報道一條新穎的合成不對稱N,N-二取代甲酰胺路徑。通過CoF2、P(CH2CH2PPh2)3和K2CO3催化體系催化還原耦合伯胺、醛以及CO2/H2制備(圖14)。反應機理考察表明伯胺與醛耦合形成亞胺,亞胺還原生成仲胺,仲胺與CO2加氫的產物HCOOH反應最終形成不對成N,N-二取代甲酰胺67。
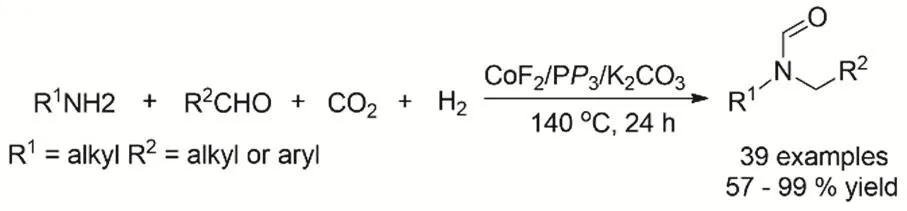
圖14 CO2、H2參與合成不對稱N,N-二取代甲酰胺Fig. 14 Catalytic synthesis of asymmetric N,N-disubstituted formamide by using CO2 and H2.
常見的非貴金屬Mn和Fe也具有催化CO2/H2和胺的N-甲酰化反應(圖15),Khusnutdinova等第一次報道了具有生物活性和強配體的Mn絡合物可以有效的催化CO2加氫與仲胺發生甲酰化反應68。Bernskoetter等報道帶有PNP配體的二價Fe羰基螯合物能夠高效的轉化多種仲胺底物和CO2/H2生成甲酰化產物69,產物的收率高達92%,反應的TON也有8900。
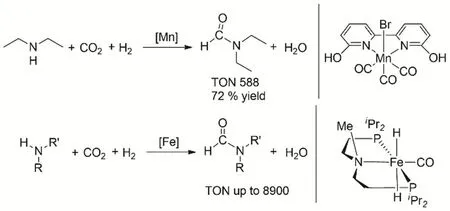
圖15 Mn和Fe絡合物催化CO2、H2與胺甲酰化反應Fig. 15 Mn and Fe complexes catalyze the formylation of amines.
有機胺N-甲酰化產物上的羰基進一步還原可以轉化成-CH3,甲基胺是許多具有生物活性化合物中的關鍵結構基序,因此是眾多藥物和農藥化學品的重要組成部分70。在N官能團上引入甲基一般要涉及有危險的甲基化試劑,像碘甲烷、硫酸二甲酯等。另外碳酸二甲酯、甲醛和甲酸也可以作為C1源用于胺甲基化試劑(Eschweiler-Clark 甲基化)71。盡管如此,CO2才是被認為是胺甲基化的最清潔的C1源。最早CO2和H2用于N-甲基化反應的是多相催化劑(圖16),Baiker等報道以Cu/Al2O3為催化劑,CO2、H2和NH3為原料氣,在固定床微反應器上合成甲胺以及二甲胺、三甲胺72。在此基礎上,研究者又發展了Ni-、Pt-、Co-、Fe-、Pd-、Au-基等催化劑用于CO2和H2參與的N-甲基化反應,可以高選擇性地得到單甲基化的胺73。但反應體系還是存在反應速率較低,且當反應溫度過高時副產物CO、CH4明顯增多。
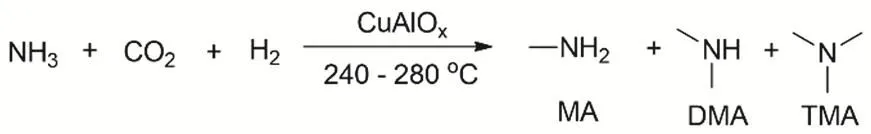
圖16 多相催化劑CuAlOx用于CO2、H2和NH3的N-甲基化反應Fig. 16 N-methylation of NH3 with CO2 and H2 by heterogeneous catalyst CuAlOx.
均相催化CO2和胺的N-甲基化反應最初使用的是硅烷/硼烷作為還原劑。直到2013年,Klankermayer/Leitner等在CO2和H2的氛圍下,第一次實現了伯胺和仲胺的甲基化74。三乙烷基Ru基催化劑是該體系成功構建N-甲基化的關鍵,Ru基催化劑的選擇主要受CO2還原合成甲醇的催化劑啟發75。另外,易合成的絡合物[Ru(triphos)(tmm)](tmm = 三甲叉基甲烷)在CO2和H2的氛圍下可以高效的實現芳胺的甲基化(圖17)。通過5% (摩爾分數)的酸和非配位的陰離子預活化催化劑使催化劑具有最好的活性。在CO2/H2(2/6 MPa)、反應溫度140-150 °C的四氫呋喃(THF)溶液中,可以轉化大部分的芳基伯胺和芳基仲胺為二甲胺和甲胺,甲基化的收率> 90%。但是對脂肪類的胺的活性卻很低。
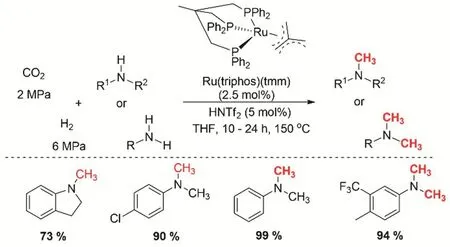
圖17 Ru催化CO2、H2與胺的甲基化反應Fig. 17 Ruthenium-catalyzed methylation of amines with CO2 and H2.
隨后,Beller等報道了類似的路線用于芳香胺和脂肪胺的N-甲基化。在CO2/H2存在的條件下,通過[Ru(acac)3]/triphos/H+原位形成絡合物作為催化活性組分,同時在體系添加LiCl可以提高脂肪胺N-甲基化的活性和選擇性(圖18)。LiCl的加入可能是與THF的氫原子作用提高了酸的質子化能力76。通過一系列的控制實驗表明甲基化的胺首先形成了甲酰胺中間體,接著被還原成甲基胺。反應的過程中雖然檢測到了甲醇的產物,但是甲醇作為甲基化的試劑的產物基本是忽略不計的。
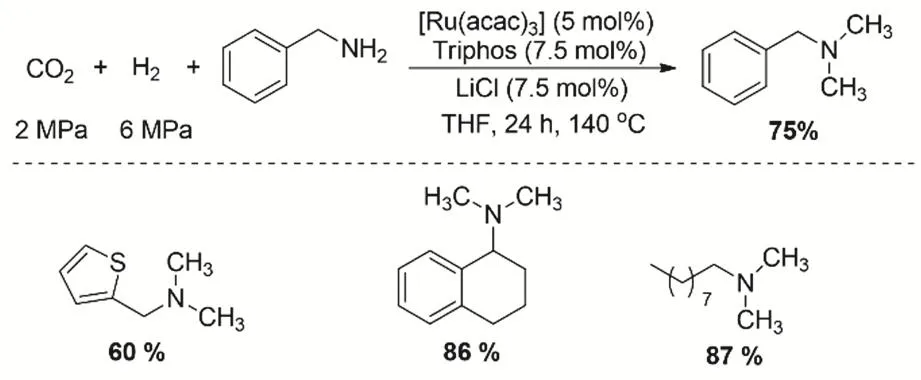
圖18 在存在LiCl助劑的條件下Ru催化CO2、H2與脂肪胺/芳香胺的甲基化反應Fig. 18 Ruthenium-catalyzed methylation of amines with CO2 and H2 in the presence of LiCl as additive.
Leitner等報道[Ru(triphos)(tmm)]/三氟甲基磺酸鹽在CO2/H2的氣氛下實現氨氣和氯化銨的三甲基化(圖19)。在有機溶劑中合成三乙胺的過程Lewis/Br?nsted酸是必需的。在氯化銨三乙基化的過程中水和有機溶劑的定量比是至關重要的,同時水/有機兩相有利于產物的分離77。

圖19 CO2、H2與NH3/NH4Cl合成三乙胺或其鹽酸鹽Fig. 19 Synthesis of trimethylamine TMA and its hydrochloride starting from NH3 or NH4Cl with CO2 and H2.
盡管早在上世紀90年代就有報道CO2/H2參與的胺甲基化反應,直到近年才實現貴金屬和非貴金屬催化劑的在溫和條件下催化甲基化產物的高效合成,但仍然存在催化劑活性和選擇性較低的問題。引入堿性基團或缺電子催化中心有效活化CO2分子,以及增強N-親核試劑的親核性,都有利于C―H鍵的形成。胺甲基化過程經常形成甲酰胺中間體,因此在催化劑和配體設計的時候可借鑒酰胺還原催化劑的思路有望獲得更高活性的催化劑。
氮雜環化合物及其衍生物是一類重要有機化學品,廣泛用于有機物和藥物中間體。其中苯并雜環化合物可通過鄰苯二胺與羧酸或其衍生物、酯、酰胺、內酯、腈和醛等在高溫下環化而合成。由CO2、H2和胺羰基化構建C―N鍵,是符合綠色化學發展的。劉志敏等報道采用RuCl2(dppe)2為催化劑,通過CO2、H2和鄰苯二胺反應合成苯并咪唑化合物78。反應在超臨界條件下CO2和H2的總壓為15 MPa、溫度120 °C時,含有吸電子基團和給電子基團的鄰苯二胺底物生成苯并咪唑的收率均能達到> 90%。且反應在無溶劑條件下進行,反應過程中只有副產物水生成,符合綠色反應的路線。后續工作中研究者進一步發展非貴金屬催化體系CoF2/PP3/CsF (圖20),通過胺鄰位取代與CO2和H2還原環化制備氮雜環化合物79。
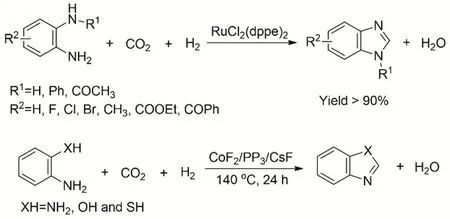
圖20 Ru和Co絡合物催化CO2、H2與胺的還原環化Fig. 20 Ru and Co complexes catalyze the reductive cyclization of amines with CO2 and H2.
2.3 醇/醚羰基化反應
乙醇是重要的化工原料且用途廣泛,工業上主要通過發酵法、乙烯水合法、煤化工法等制備,由CO2和醇/醚羰基化合成乙醇意義非凡(圖21)。2018年,韓布興等使用了Ru-Co雙金屬體系,在CO2和H2的條件下,用二甲醚合成乙醇。整個反應的轉化率達到71.1%,乙醇的選擇性可以高達94.1%,催化劑連續套用5次活性沒有明顯下降,同時乙醇的收率高于以前報道過的CO2/CO合成乙醇的路線的收率80。他們通過同位素實驗驗證了產物乙醇的烷基來自于二甲醚(DME),羰基來自于CO2,但是產物中的H隨H2壓力的增大才會有更多的氫來自于氫氣。該反應的機理大致是,首先是Li+促進DME的CH3―O鍵的弱化,在Lewis酸的作用下Co的插入形成CH3Co*,然后Ru催化的逆水煤氣變換原位生成的CO與CH3Co*結合形成CH3COCo*,最后金屬鍵斷裂H2還原乙醛生成目標產物乙醇,一部分的CH3O―形成甲醇。接著研究者又在更加溫和的條件下,發展[RuCl2(CO)3]2/Co4(CO)12雙金屬催化體系用于CO2、H2和甲醇羰基化制備乙醇81。反應體系中LiI是促進劑,N-乙基-2-吡咯烷酮(NEP)作為溶劑,反應溫度為160 °C時,生成乙醇的Ru的TOF高達7.5 h-1,同時乙醇的選擇性為65%。反應首先發生RWGS,接著CO、H2與甲醇羰基化生成乙醇。接著研究者又發展更加溫和的單金屬催化劑Ru3(CO)12/[Bmim]Cl體系,在120 °C的反應條件下CO2、H2和甲醇羰基化合成乙醇82。同時研究者還報道CO2、H2與多聚甲醛羰基化制備乙醇83。
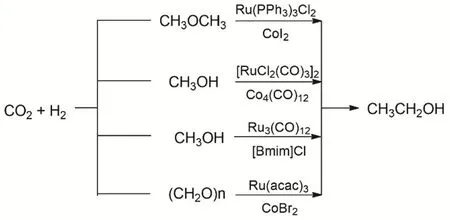
圖21 CO2、H2與二甲醚/甲醇/多聚甲醛羰基化制備乙醇Fig. 21 Catalytic synthesis of ethanol from dimethyl ether/methanol/paraformaldehyde with CO2 and H2.
羧酸是重要的大眾化學品,目前通過CO2和醇/醚羰基化制備是十分具有挑戰的課題。主要受熱力學的限制,需要強還原劑和苛刻的反應條件。2016年,韓布興等報道了以CO2作為羰基化試劑、H2作為溫和還原劑,通過甲醇還原羰基化制備乙酸的新路線84。Ru3(CO)12/Rh2(OAc)4催化體系是實現乙酸高收率的關鍵。在CO2和H2存在的條件下,以咪唑為配體、LiI為促進劑,DMI作為溶劑,反應溫度200 °C,使甲醇羧酸化合成醋酸,TOF達到30.8 h-1,催化劑連續套用5次活性保持不變(圖22)。通過CO2羰基化合成的醋酸,這是醋酸合成的一個全新路線,對整個合成化學有很重要的影響。通過控制實驗和同位素實驗認為反應的步驟是:1) 甲醇在Li+的促進作用下原位轉化為CH3I,主要由于在高溫下Lewis酸陽離子Li+的促進形成比較活潑的活性中間體CH3I85。2) 通過NMR對13CH3OH同位素實驗的表征可以觀察到中間體CH3Rh*I形成。3) CO2插入到CH3Rh*I中形成CH3COORh*I,整個過程中Rh催化劑起主要的作用。由于咪唑可以增強Rh原子的電子云密度,有利于CO2的插入86。4) 下面的步驟主要是CH3COORh*I的還原和醋酸形成的過程,同位素實驗和控制實驗表明該步驟的主要活性中心是Ru。氣體的主要產物為CH4,未檢出到CO。在此工作基礎上,研究者又發展了更加簡單和溫和的Rh2(CO)4Cl2/4-甲基咪唑/LiI催化體系應用于CO2/H2和甲醇反應,在反應溫度為150 °C時,反應中就檢測到了乙酸87;反應到180 °C是乙酸的產率達到81.8%,反應的TOF達到26.2 h-1。
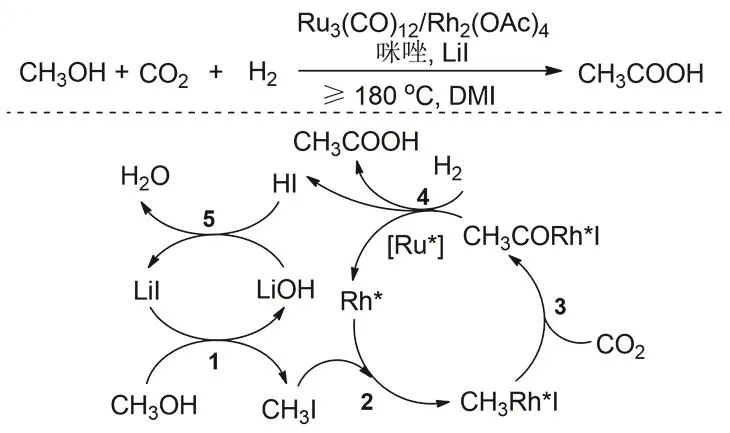
圖22 CO2、H2與甲醇羰基化制備乙酸Fig. 22 Synthesis of acetic acid by methanol carbonylation with CO2 and H2.
研究者進一步以醚類化合物、CO2和H2為原料,通過構建IrI4/LiI高效催化體系,成功制備了長鏈羧酸。在170 °C溫度條件下,在乙酸溶劑中該反應可高效進行,各種醚均可轉化為對應的高級羧酸(圖23)。機理研究表明,底物醚首先在催化劑作用下轉化為烯烴,烯烴進一步轉化為烷基碘化物;該類碘化物再與經逆水煤氣反應原位生成的CO反應,生成高級羧酸。該研究成果為CO2轉化和高級羧酸的合成提供了一個新策略88,89。
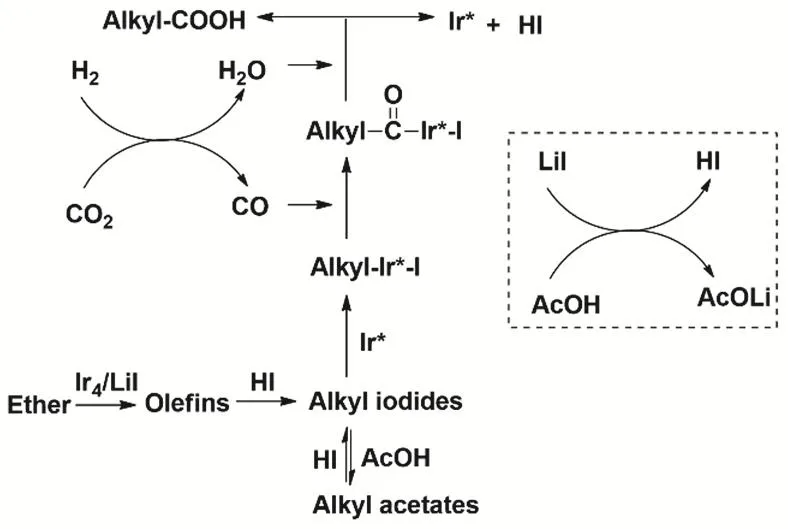
圖23 CO2、H2與醚羰基化制備高級羧酸Fig. 23 Synthesis of higher carboxylic acids from ethers, CO2 and H2.
CO2、H2合成C2+的產物往往都涉及C―C偶聯和C―OH的形成,同時生成產物具有重要的意義。譬如由CO2加氫合成乙醇和長鏈醇(C2+醇),一般都要經歷低碳醇羰基化到高碳醇的過程。但是,受制于選擇性問題,CO2/H2合成C2+醇一般都需要特別的催化體系和更為苛刻的反應條件。迄今報道主要集中在多相催化劑上,相對于負載型單金屬催化劑,具有協同效應的雜金屬催化劑(CuFe、CuZnFe、CoMo等)90能夠更加高效的轉化CO2和H2到C2+OH。CoMoS在340 °C可以催化CO2氫化合成醇,C2+OH的產率最高為35.6%91。以CuZnFe/K為催化劑在反應溫度300 °C得到C2+OH的選擇性達到87.1%92。相對而言,均相催化體系能在相對溫和的條件下,實現催化C2氫化到C2+OH。但是目標醇的高選擇性仍然是挑戰性的課題。
在1994年,Tominaga等就發現Ru3(CO)12和Co2(CO)8雙金屬催化體系在KI存在的情況下均相催化CO2還原到乙醇31。一定比例的Co/(Co + Ru)催化劑在整個的反應過程中沒有金屬析出,當該比例大于0.5時催化劑反應后有金屬析出,所以當該比例小于0.5時他們認為在整個的反應過程中Co取代一部分的Ru形成了一個比較穩定的簇。而Fe或Mo就沒這種雙金屬協同催化的作用。當一定量Co取代一定量的Ru時反應活性沒有下降,乙醇的收率還有輕微的提高,由此得到Ru主要的催化作用是把CO2還原成CO,而CO到乙醇主要是Co的催化劑起作用。但是產物中C2+的產物醇的選擇性相比于C1的產物CH3OH和CH4還是相對比較低。關于如何在溫和條件下高選擇性催化該反應依然是很具有挑戰的課題。直到20年后,韓布興等采用[Ru3(CO)12]/[Rh2(CO)4Cl2]雙金屬催化體系以KI為促進劑93,在反應條件(CO2和H2均為4 MPa,DMI為溶劑,200 °C,12 h)可以得到C2+產物的收率高達96.4%(圖24)。LiI在反應中起到了重要的作用,Li+有較強的Lewis酸性,起到穩定催化劑的作用;而且I-的親核性能夠促進反應鏈的增長。Ru-Rh雙金屬的協同催化能力通過控制實驗被證明。
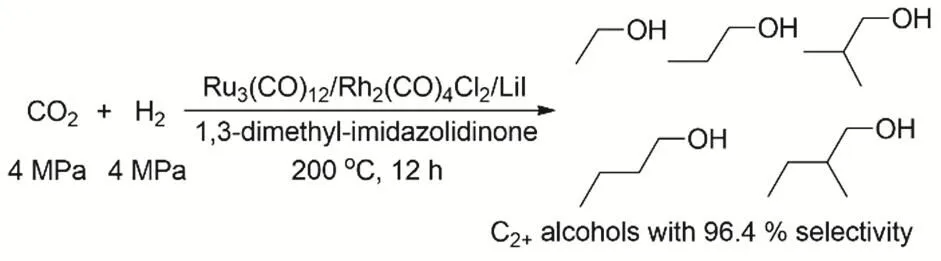
圖24 RuRh雙金屬體系催化CO2和H2合成C2+OHFig. 24 Synthesis of C2+ alcohols by CO2 hydrogenation with a homogeneous bimetallic Ru-Rh system.
接著研究者又發展了Ru3(CO)12/Co4(CO)12雙金屬催化體系94,在共催化劑[PPN]Cl和促進劑LiBr共同作用下,可以高效的催化CO2/H2到C2+OH(圖25)。同時該雙金屬催化體系能夠重復使用5次依然保持很好的活性。Ru-Co雙金屬之間存在明顯的協同作用,[PPN]Cl和LiBr的加入提高了催化活性和選擇性。反應機理推測Ru催化CO2還原生成CH3OH和CO。CH3OH原位與CO還原羰基化轉化成乙醇。丙醇的形成與形成乙醇的類似。少量的異丁醇是甲醇和丙醇發生Guerbet反應形成的95。在反應過程中,Ru催化劑催化CO2加氫生成CH3OH和CO,并在Br-促進下催化甲醇羰基化到乙醛,同時是乙醛氫化到乙醇;Co催化劑的主要作用加速甲醇的還原羰基化到乙醇和乙醛以及C2+醇的生成96。
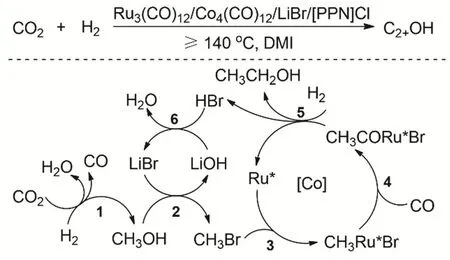
圖25 Ru-Co雙金屬催化體系催化CO2和H2合成C2+OHFig. 25 Synthesis of C2+ alcohols by CO2 hydrogenation with a homogeneous bimetallic Ru-Co system.
2.4 其它羰基化反應(鹵化物羰基化、甲基化等)
烷基鹵化物中與鹵素相連的碳原子具有親電性,可以發生偶聯反應。以CO2作為羰源、H2作還原劑與鹵化物反應合成羧酸產品是一條有效的途徑。在1995年,Fukuoka等使用Ru/Co或Ni/Co雙金屬催化劑在CO2、H2的氣氛下均相催化有機碘化物羧基化97。該反應的顯著特征是使用雙金屬催化劑協同催化生產羧酸化合物(圖26)。反應物選擇是CH3I,在單獨使用Ru3(CO)12或Co2(CO)8時反應體系中沒有檢測到醋酸生成,當使用Ru3(CO)12/Co2(CO)8雙金屬催化劑時生產醋酸的TON為17(以Ru原子)。在反應的過程中也檢測到副產物CH4和CO,反應TON分別為50和58。盡管推測是CO2直接插入M-CH3的機理,但是也沒排除通過RWGS反應原位生成的CO進行羰基化的可能性。

圖26 CO2、H2與CH3I羰基化制備乙酸Fig. 26 Synthesis of acetic acid from methyl iodide with carbonylation CO2 and H2.
藥物研究中神奇甲基效應與C―H鍵的甲基化有很大的關系。通過CO2直接構建C―C鍵,主要受限C―H的羰基化的難度,所以相關報道不多98。Beller課題組第一次報道Ru絡合物催化CO2/H2參與的C―H的甲基化反應99。在這項工作中,研究者證明了CO2和H2的組合可以用作甲基化試劑,用于(雜)芳烴的直接甲基化,如吲哚,吡咯和富電子芳烴,具有中等至良好的反應性(圖27)。在反應的過程中,催化劑前體Ru(acac)2和配體triphos原位形成的催化活性物種是反應的關鍵,在此過程中酸共催化劑(譬如MSA)也是必需的。通過機理和控制實驗發現原位生成的甲醛是構筑C―C鍵的關鍵步驟。在酸存在情況下形成陽離子[Ru-H]+催化活性物種,接著CO2被Ru―H還原形成Ru甲酸鹽,隨后將被碳親核試劑進攻形成相應的縮醛中間體,最后縮醛氫解生成甲基化產物。
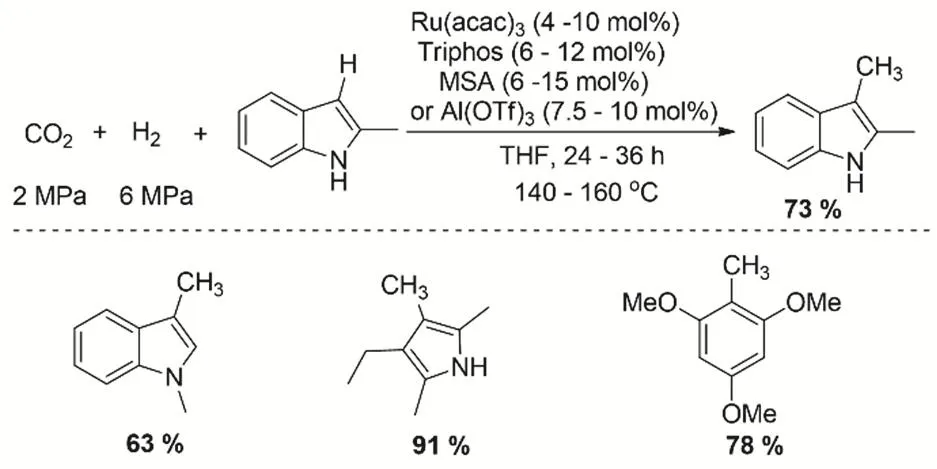
圖27 Ru催化劑用于CO2、H2與雜芳烴的甲基化反應Fig. 27 Ruthenium-catalyzed methylation of heteroarenes with CO2 and H2.
木質素和CO2都是廉價易得的可再生的資源,使用木質素與CO2合成高值化學品是十分具有挑戰的課題,并且對資源和環境的意義也很重大100。韓布興等報道通過CO2、H2和木質素/芳基甲基醚在Ru-Co雙金屬催化體系作用下發生羰基化反應制備乙醇101。反應生成乙醇的TON能夠達到145。一系列的控制實驗揭示反應過程首先發生的RWGS,接著是C―C鍵的形成,最終得到目標產物乙醇(圖28)。
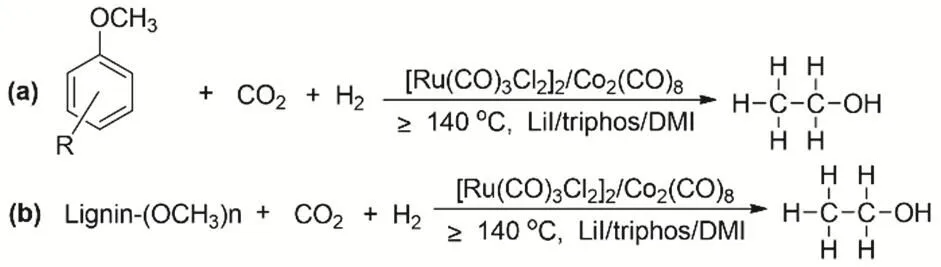
圖28 CO2、H2與芳基甲基醚(a)/木質素(b)制備乙醇Fig. 28 Synthesis of ethanol from aryl methyl ethers(a)/lignins (b) with CO2 and H2.
研究者又通過低溫逆水煤氣變換過程耦合CO羰基化的向高值化學品轉化。反應的首先是在離子液HMimBF4存在的情況下,反應溫度80 °C時,Ru3(CO)12就可以催化CO2逆水煤氣變換生成CO,之后通過共催化劑催化CO羰基化反應。通過控制實驗和同位素實驗證實陰離子在RWGS的過程起到重要作用(圖29)。研究者報道三種CO2羰基轉化途徑:1) CO2與二芳基醚反應生成具有藥物活性氧雜蒽酮(Xanthone);2) CO2與苯甲醚反應生成重要的大宗化學品苯酚和醋酸;3) CO2與木質素反應生成醋酸102。
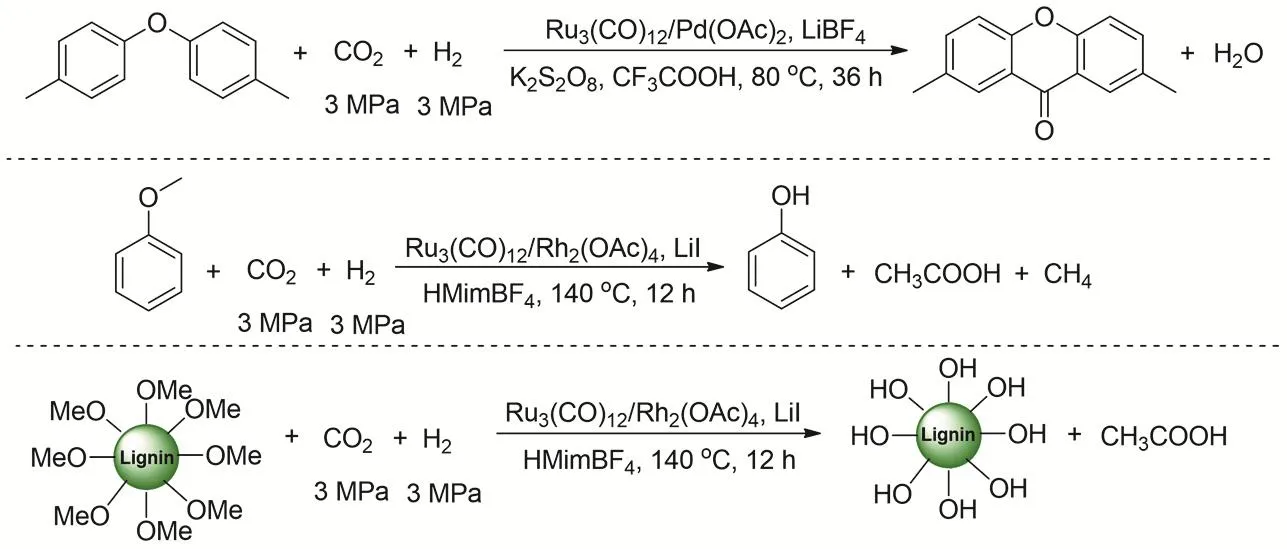
圖29 可再生碳源向高值化學品轉化Fig. 29 Transformation of renewable carbon resources to value-added chemicals.
3 總結與展望
CO2、H2參與的還原羰基化反應在熱催化CO2還原領域的研究已經取得了一定進展。由于CO2和H2都是相對清潔、低成本的原料,可作環境友好的試劑生產更高附加值的化學品,而且緩解溫室氣體排放和碳資源的有效利用問題,因此是CO2化學轉化利用研究最為活躍的前沿領域之一。然而,CO2上碳氧鍵的惰性,使金屬活性物種加成到上面非常的困難,并且該反應過程常涉及多個競爭反應導致目標產物的化學選擇性差,大量的研究仍處于實驗室研發階段。因此,積極開發新型穩定高效催化體系和經濟可行的工藝路線,對實現CO2還原羰基化技術的工業化應用依然是本領域的重要研究方向。我們認為將來的研究主要可以從以下兩個方面開展。
1) 發展更加高效的催化體系、非貴金屬體系甚至無金屬催化體系。均相催化CO2還原羰基化的過程,首先是CO2分子活化的過程,常用貴金屬催化體系效率偏低的根源是不能對惰性的CO2分子有效的活化。通過在催化劑上設置能夠活化C=O的配體官能團,結合金屬催化中心以協同催化的方式完成對CO2分子的還原,提高金屬催化劑的原子利用率,減少催化劑用量。針對該類反應是多個反應的串級過程,可以發展兩元/多元金屬催化體系,利用它們各司其職或協同催化完成整個過程。另一方面,通過催化體系合適配體/添加劑促進金屬催化劑對CO2分子的精準活化。此外,非貴金屬絡合物,如Fe、Co、Mn等,催化的CO2化學轉化也是該領域值得關注的發展方向。
2) 利用現代表征手段和理論計算探究反應的機制。均相催化CO2還原羰基化反應是一個反應路徑較為復雜的化學過程,涉及多個串級的反應以及一系列的競爭反應。每個反應對應的不同的催化活性物種,也是造成催化劑用量高的主要原因。因此,有效結合現代表征手段(如原位紅外光譜、電噴霧電離質譜和原位同步輻射等),追蹤和捕捉反應過程活性物種的形成和中間體,探索催化劑原子利用率不高的內在原因,有助于對均相催化CO2還原羰基化反應機理的深入認識。同時,利用理論計算對反應的中間路徑進行模擬,有針對性的找出反應的瓶頸問題所在,為催化體系的設計提供可靠的參考。總之,隨著研究的不斷深入,不但可以高效催化CO2轉化制備高值化學品,而且實現碳的化學循環,成為自然界碳循環的有力補充。
- 物理化學學報的其它文章
- Understanding the Role of Cu/ZnO lnteraction in CO2 Hydrogenation to Methanol
- Electrocatalytic CO2 Reduction to Ethylene over CeO2-Supported Cu Nanoparticles: Effect of Exposed Facets of CeO2
- Controlling the Global Mean Temperature by Decarbonization
- Cu@UiO-66 Derived Cu+-ZrO2 Interfacial Sites for Efficient CO2 Hydrogenation to Methanol
- 二氧化碳電還原反應的理論研究
- 離子液體介導CO2化學轉化研究進展

