射頻消融對心室預激患者左心房壓力負荷及左心室舒張功能的影響
徐光澤 陳治奎 林海燕 沈文均 葛世俊
人群心室預激的心電圖檢出率為0.1%~0.3%[1-3],其中11%的患者以房室折返性心動過速為首發(fā)表現(xiàn);65%的患者表現(xiàn)為無癥狀心室預激[4],部分以心房顫動為首發(fā)表現(xiàn)。相關數(shù)據(jù)顯示,約1/5的預激綜合征患者并發(fā)心房顫動[5],但其發(fā)病機制尚不清楚。除心房顫動可能增加心室預激患者發(fā)生栓塞的風險外,當心房顫動極快的激動經(jīng)過旁路順行傳導時,心室反應可能退化為心室顫動,危及患者生命。目前關于心室預激引發(fā)心房顫動的機制研究較少,個別研究從心房肌易損性、電傳導不均一性等心肌電生理特質進行相關性分析,但這些電生理特質無法說明與旁路前傳的直接關聯(lián)性[6-7]。可見,心室預激改變了心室肌的電激動順序,筆者推測這種激動的改變可能通過影響左心房壓力(left atrial pressure,LAP)負荷及左心室舒張功能來增加心房肌的易損性,最終引發(fā)心房顫動或心功能不全等。本文就射頻消融對心室預激患者LAP負荷及左心室舒張功能的影響作一探討,現(xiàn)將結果報道如下。
1 對象和方法
1.1 對象選取2015年1月至2020年1月在寧波市醫(yī)療中心李惠利醫(yī)院經(jīng)房間隔途徑成功完成左側顯性旁路射頻消融的左側心室預激患者71例,所有患者術中維持竇性心律;男40例,女31例;入院時年齡12~80[43(27,56)]歲;體重指數(shù)(24.4±2.7)kg/m2;合并冠心病1例,2型糖尿病1例,輕度腎功能不全3例,高血壓4例;有心房顫動發(fā)作史9例;有心動過速病史63例;左心室舒張功能障礙(left ventricular diastolic dysfunction,LVDD)2例;射血分數(shù)(ejection fraction,EF)為(62.3±5.8)%;左心室舒張末直徑(left ventricular end-diastolic dimension,LVEDd)為(45.2±4.0)mm;左心房直徑(left atrial dimension,LAD)為(31.7±3.3)mm;室間隔厚度(interventricular septal thickness,IVST)為(8.8±1.3)mm;前傳有效不應期(prequel effective refractory period,PERP)為(234±27)ms;手術時間(46.1±12.9)min。排除嚴重的心臟結構異常(如瓣膜病、先天性心臟病、軟圓孔未閉、心肌病、甲狀腺功能異常、心力衰竭、血壓控制不佳(收縮壓>180 mmHg)的患者等。有、無心房顫動史以及有、無心動過速病史患者的基線資料比較,差異均無統(tǒng)計學意義(均P>0.05),見表1~2。本研究經(jīng)醫(yī)院醫(yī)學倫理委員會審查通過(批準文號:KY2020PJ116),所有患者簽署知情同意書。
1.2 方法術前停用抗心律失常藥物及影響肌力的藥物5個半衰期以上,選擇二尖瓣舒張早期血流速度反映左心室舒張功能。所有患者于手術前、后即刻完成經(jīng)胸超聲檢查(IE33,Phillip,荷蘭),以測定二尖瓣舒張早期及舒張晚期血流速度。在心尖四腔心切面,將取樣容積置于二尖瓣瓣尖水平,適當調整探頭方向和取樣部位以獲取最佳二尖瓣血流頻譜(探頭頻譜1.5~3.5 Hz),測量舒張早期二尖瓣口血流速度峰值(peak of early mitral inflow velocity,EMIVpeak);所有患者局部麻醉后行Seldlinger法穿刺股靜脈放置鞘管,在數(shù)字減影血管造影機(UNIQ,Phillip,荷蘭)透視下根據(jù)需要放置標測電極(Abbott或Synaptic,美國)于冠狀靜脈竇、右心室等部位;結合程序刺激,CARTO系統(tǒng)(Biosense Webster,美國)輔助定位,明確前傳及逆?zhèn)鞴δ堋6嗯月氛撸g中行逐條消融,多次標測。術中經(jīng)右側股靜脈放置8F SL1長鞘管(St.Jude,美國)至右心房中部,確定頭端游離(回抽通暢,輕推對比劑呈柱狀顯影噴出),壓力波形穩(wěn)定后測量右心房壓力,以對比消融前后容量負荷差異。使用SL1輔助房間隔穿刺針(Abbot,美國)成功穿刺房間隔,確認頭端游離(回抽SL1通暢,注射對比劑確認),波形穩(wěn)定后記錄LAP的峰值(LAPpeak)、谷值(LAPnadir)、平均值(LAPmean),并記錄測量時的心率;消融完成后撤除消融導管,回抽SL1鞘管通暢無血栓,頭端游離,再次記錄LAP。每次記錄前壓力模塊作歸零處理,術中SL1鞘管內肝素化(使用肝素鈉注射液,規(guī)格:12 500 U/支,萬邦醫(yī)藥),完成房間隔穿刺后立即按80 U/kg靜脈推注肝素鈉注射液,此后補充推注1 000 U/h。術中隨機選用不同廠家的4 mm/7 Fr普通非灌注標測消融導管(Biosense Webster,美國;Abbott,美國;Triguy,中國;Synaptic,美國);心電圖采用雙極記錄濾波50~300 Hz,單極記錄慮波0.5~500 Hz。使用Mac/Cardio-lab多導電生理記錄儀(GE Health,美國)、Stockert Ep-shuttle RF消融儀(Biosense Webster,美國)和EP-4心臟電生理刺激儀(St.Jude Medical,美國)。射頻消融采用溫控模式,目標溫度55~60℃,功率20~50 W;試消融放電5 s內預激消失者繼續(xù)鞏固消融至90 s,再于靶點旁左右各補充消融60 s以鞏固(間隔旁路或導管到位困難者除外);試放電5 s預激未消失者需重新標測靶點。消融靶點確認參考文獻[8]。術中使用M1006A模塊(Phillip,荷蘭)測量壓力。消融終點:體表預激消失,冠狀竇電極局部AV、VA電位分離,程序刺激經(jīng)房室結傳導,以及無旁路參與的心動過速誘發(fā)。

表1 有、無心房顫動史患者基線資料比較

表2 有、無心動過速病史患者基線資料比較
1.3 統(tǒng)計學處理采用SPSS 23.0統(tǒng)計軟件。正態(tài)分布的計量資料以表示,組間比較采用兩獨立樣本t檢驗,組內消融前后比較采用配對樣本t檢驗;非正態(tài)分布的計量資料用M(P25,P75)表示,組間比較采用Mann-Whitney U檢驗。計數(shù)資料組間比較采用χ2檢驗或Fisher確切概率法。射頻消融后LAPmean下降的預測因素分析采用線性回歸模型。P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 射頻消融前后各觀察指標變化射頻消融前后心率、右心房壓力、收縮壓比較,差異均無統(tǒng)計學意義(均P>0.05);與消融前比較,射頻消融后LAPpeak、LAPnadir、LAPmean均明顯降低,二尖瓣舒張早期血流速度與舒張晚期血流速度的比值(E/A)、EMIVpeak均明顯升高,差異均有統(tǒng)計學意義(均P<0.05),見表3。其中LAPpeak、LAPnadir、LAPmean、EMIVpeak消融前后差值分別為-2.72(-3.12,-2.31)mmHg、-0.97(-1.25,-0.70)mmHg、-3.34(-3.84,-2.83)mmHg、5.21(4.16,6.26)cm/s。
2.2 射頻消融后LAPmean下降的預測因素分析經(jīng)單、多因素線性回歸模型分析,結果顯示有心房顫動史、消融前EF是射頻消融后LAPmean下降的獨立預測因子(均P<0.05),見表4。
2.3 有、無心房顫動史患者消融前后LAPmean、LAPpeak、EMIVpeak差值比較有、無心房顫動史患者消融前后LAPmean、LAPpeak、EMIVpeak差值比較,差異均有統(tǒng)計學意義(均P<0.05),其中有心房顫動史患者變化幅度明顯大于無心房顫動史患者,見表5。
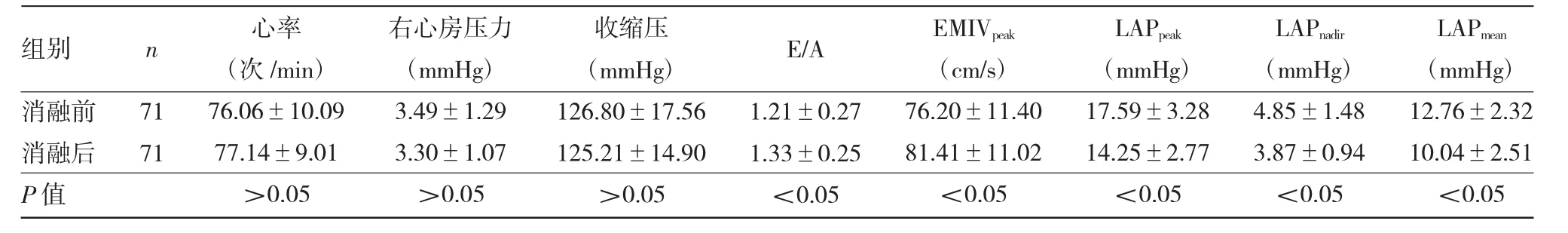
表3 射頻消融前后各觀察指標變化
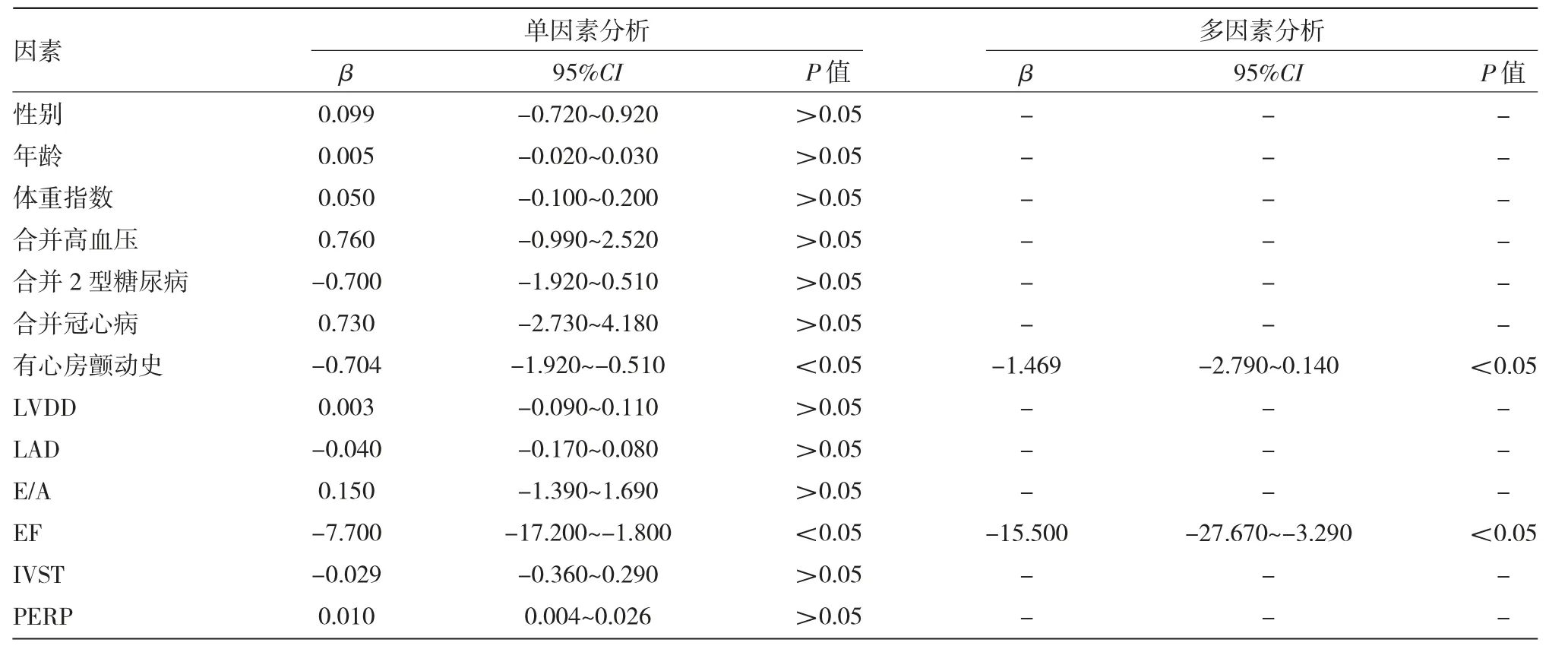
表4 射頻消融后LAPmean下降的預測因素分析
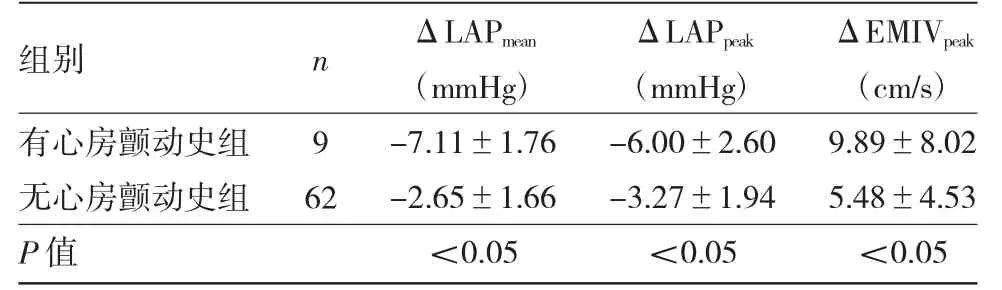
表5 有、無心房顫動史患者消融前后LAPmean、LAPpeak、EMIVpeak差值比較
2.4 有、無心動過速病史患者消融前后LAPmean、LAPpeak、EMIVpeak差值比較有、無心動過速病史患者消融前后LAPmean、LAPpeak、EMIVpeak差值比較,差異均無統(tǒng)計學意義(均P>0.05),見表6。

表6 有、無心動過速病史患者消融前后LAPmean、LAPpeak、EMIVpeak差值比較
3 討論
有研究報道心室預激引發(fā)猝死的終生風險為4%[8],心室預激引發(fā)猝死風險已引起臨床的重視。目前指南關于無癥狀心室預激的處理評估主要基于心室預激引發(fā)惡性心律失常的風險,如旁路的不應期、最短RR間期以及多旁路等引發(fā)的極快心率等電生理特質,但它們并不是完美的預測因子,一些無心動過速病史、多旁路等高危因素的無癥狀心室預激患者仍存在危及生命的心律失常風險。一項由6個國家22個中心參與的研究結果顯示,威脅生命的心律失常多數(shù)發(fā)生在既往無心動過速史的心室預激患者身上[9]。Pappone等[10]對2 169例心室預激患者進行隨訪觀察,結果發(fā)現(xiàn)除了有無癥狀或心動過速病史外,其他電生理特質基本無差異;一些無電生理危險特質的患者發(fā)生了危及生命的心律失常。顯然,電生理檢查的陽性預測值并不高,無癥狀的消融指征單純依賴于電生理特質是不足的。此外,有流行病學調查顯示心室預激人群心房顫動發(fā)病率遠高于普通人群。丹麥一項有32萬人注冊的全國性數(shù)據(jù)顯示,心室預激患者心房顫動發(fā)病率是普通人群的3.12倍,心力衰竭發(fā)生風險是普通人群的2.11倍[3]。但是目前尚無指南和共識將預防心房顫動及心力衰竭作為無癥狀心室預激患者射頻消融的指征。
Boycott等[11]研究證實心肌剪切力改變心肌離子通道功能,在高LAP的環(huán)境下,血流與心房肌細胞的相互作用使得后者受到的牽拉力增加,激活心肌細胞上牽拉激活性離子通道,這些離子通道能將機械刺激轉變?yōu)殡娀瘜W信號,通過離子交換影響動作電位的發(fā)生和維持。在左心房高壓力負荷與心房肌電重塑過程中,各種離子通道電流密度及通道動力學發(fā)生改變,LAP持續(xù)性升高,導致心房肌電重塑,電重塑時心肌細胞離子通道的數(shù)目及通道功能發(fā)生改變,最終導致心房肌不應期改變和電傳導不均一性[12-13]。理論上,由心室預激引發(fā)的房室或者室房偶聯(lián)順序改變必然促成左心室內血流動力學改變,最終表現(xiàn)為LAP改變。研究證實左心室舒張及收縮功能異常與LAP負荷增加有關;反之,當左心室收縮功能無明顯異常時,左心房增大(左心房本身病變除外),可較大程度反映左心室舒張功能損害及左心室充盈壓升高程度[14-17]。另外,旁路前向傳導所致的長期心肌除極改變帶來的心肌記憶效應可能影響左心室舒張及收縮功能,最終增加LAP負荷。
左心房容積擴大、左心房肌纖維化、左心房局部低電壓以及心肌易損性等均與心房顫動的發(fā)生有關,而LAP反映的信息綜合了各種上述因素的影響,是多種心血管疾病引發(fā)心房顫動的共同通路,也是反映左心房功能狀態(tài)的良好量化指標。有研究表明,心房顫動患者LAP升高的發(fā)生率為34%[18]。此外,在右心室起搏人群中也觀察到血流動力學與心房顫動的關聯(lián)性[19-20],右心室起搏可增加心房顫動的發(fā)生風險,其機制可能與心室預激引發(fā)心房顫動類似。有文獻報道心室預激可引發(fā)左心室功能不全、心房顫動等[21-22],并以右側間隔顯性旁路者多見[23-24],這種作用可通過射頻消融逆轉心功能不全來證實[25]。另有研究發(fā)現(xiàn)射頻消融能降低心室預激對心房的影響[26-27],并降低心室預激引發(fā)的心律失常風險。但心室預激對心房的影響在一段時間內并非隨著消融后不復存在,而消融后心房顫動發(fā)生率仍高于普通人群,提示心室預激對心肌的影響可能存在時間累積效應,心室預激治療的時機可能與消融后心房顫動的發(fā)生、發(fā)展有關。這一現(xiàn)象提示盡早解除心室預激對左心房的影響,可能最大程度減少左心房易損性的發(fā)生。研究表明,旁路本身的電生理特質與心房顫動發(fā)作無關,不同旁路特質的心室預激患者心房顫動發(fā)病率類似[6]。有學者提出,無癥狀心室預激患者術中證實旁路有逆?zhèn)鞴δ埽煽紤]射頻消融治療,而旁路是否有逆?zhèn)鞴δ芘c是否并發(fā)猝死、心房顫動或心力衰竭等均無關[10]。心室預激患者的預后更取決于心房肌內在的電生理特質。研究發(fā)現(xiàn),心室預激并發(fā)心房顫動的概率高于隱匿旁路,顯性旁路消融后左心房易損性的解除較隱匿旁路引發(fā)的心房易損性更加明確,提示心室預激引發(fā)的左心房易損性較隱匿旁路更為突出[28-29]。
此外,本文對比了射頻消融前后LAP及EMIVpeak變化來分析心室預激對LAP負荷及左心室功能可能存在的影響,結果顯示消融后EMIVpeak升高而LAP下降;其機制可能是射頻消融后房室聯(lián)動及室房聯(lián)動順序以及室內激動傳導恢復,進而左心室收縮、舒張功能及左心房排空功能得到改善。本研究在一定程度上闡明了心室預激引發(fā)心房顫動、心力衰竭的可能機制,為無癥狀心室預激患者的射頻消融指征提供新的依據(jù)。考慮到預激可能帶來的風險、當前射頻消融治療的風險以及電生理特質并不是完美的預測因子,一旦進行有創(chuàng)電生理檢查,術中轉向導管消融應當是可以接受的,無需完全參考旁路不應期及是否能誘發(fā)心動過速。另外,可以將無癥狀心室預激看作是心動過速、心力衰竭的發(fā)生前狀態(tài),放寬射頻消融的指征,將疾病治療置于發(fā)生前狀態(tài)是合理的選擇。
綜上所述,射頻消融治療有助于降低心室預激患者LAP負荷,改善左心室舒張功能。在當今射頻消融技術高度安全且有效的前提下,對無癥狀心室預激患者常規(guī)行射頻消融治療是可以接受的。