肝特異性造影劑與細胞外造影劑增強磁共振定量檢測不均勻肝損傷的實驗研究
于占江,王國慶,王志強,陳智成,劉屹
(1.中國醫科大學附屬第一醫院放射科,沈陽 110001;2.北票市中心醫院放射科,遼寧 朝陽 122100)
各種原因造成的肝損傷直接導致肝臟功能受損,且往往表現為肝臟不均勻損傷[1]。目前臨床常用的肝功能檢測方法包括Child-Pugh分級、吲哚氰綠排泄試驗等[2-3],但這些檢測方法對肝功能的評價相對粗糙,更不能反映肝臟各葉、段的肝功能不均勻受損情況。肝穿刺活檢是診斷肝臟病變的金標準[4],但存在操作復雜、價值局限及患者依從性差等問題。近年來,采用肝臟特異性造影劑釓塞酸二鈉(gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)增強磁共振(magnetic resonance,MR)檢查評價肝臟病變及功能成為研究熱點,造影劑特殊的藥代學特性使其對肝臟病變及功能的評價提供“一站式”服務,可通過肝膽期的信號增強程度反映肝功能,即肝臟損傷程度[5]。因此,本研究擬利用肝臟不均勻損傷模型,分別進行肝臟特異性造影劑Gd-EOB-DTPA和細胞外造影劑釓噴替酸葡甲胺(gadolinium diethylenetetramine pentaacetic acid,Gd-DTPA)增強MR檢查,結合肝臟損傷病理評分,評價2種造影劑對肝損傷的診斷效能。
1 材料與方法
1.1 動物模型建立
24只雄性SD大鼠(購自遼寧省本溪市長生實驗室,月齡3個月),體質量(210±20)g。腹腔注射1%戊巴比妥鈉(40 mg/kg)麻醉后,開腹,脾靜脈注射0.25%秋水仙堿(0.4 mL/kg),縫合切口。術后常規飼養。
1.2 MR檢查
術后第3天,將大鼠隨機分為2組,每組12只。麻醉后,行常規MR軸位平掃(GE Signa HDx3.0T 磁共振掃描儀和腕關節線圈),一組先給予Gd-EOBDTPA(德 國Bayer Schering Pharma AG公 司,稀 釋10倍,0.1 mL/100 g)尾靜脈注射,20 min后行增強MR檢查;間隔24 h后,再給予Gd-DTPA(德國Bayer Schering Pharma AG公司,稀釋10倍,0.1 mL/100g)尾靜脈注射,5 min后行增強MR檢查。另一組大鼠采用相反順序間隔24 h分別注入2種造影劑行增強MR檢查。掃描序列及參數如下:層厚3 mm;視野(field of view,FOV)12 cm;翻轉90°。T1WI 平掃(TR 360 ms;TE 10 ms;NEX 2;矩陣224×192;用時4 min 44 s)。T1WI 增強(TR 320 ms;TE 10 ms;NEX 2;矩陣224×192;用時4 min 44 s)。
1.3 MR圖像數據采集與分析
每只大鼠所有序列均截取連續3個層面,包括肝臟左、右葉和脊柱旁肌肉組織,在每個層面的肝臟左、右葉和脊柱旁肌肉組織內設定感興趣區(region of interest,ROI)3次。ROI選取要避開大血管(圖1),計算3個層面內所得各數據的平均值。于各掃描時相和組織器官獲得信號強度平均值后,計算以下參數:(1)肝臟與肌肉信號比(liver-to-muscle ratio,LMR)=肝實質信號/肌肉信號;(2)肝臟強化值(values of hepatobiliary phases contrast-enhancement,ELMR)=(增強后LMR-平掃LMR)/ 平掃LMR;(3)增強后肝臟左、右葉ELMR 差值的絕對值(ΔELMR)[6]。
圖1 MR肝臟平掃及2種造影劑肝膽期的信號強度變化Fig.1 Changes of signal intensity in MR liver plain scan and two kinds of contrast agents in the hepatobiliary phase
1.4 病理評分
MR檢查后留取肝臟標本進行常規包埋、切片、HE染色,對肝臟受損情況進行病理評分,包括肝細胞壞死、肝細胞水腫、炎癥細胞浸潤,評分標準為:0,無;1,輕度;2,中度;3,嚴重。最終評分為上述3項的評分之和。
1.5 統計學分析
采用SPSS 22.0軟件進行統計學分析,符合正態分布的計量資料用表示。采用 Student’st檢驗或Mann-WhitneyU檢驗比較肝臟左、右葉各參數的差異,采用Spearman秩相關檢驗分析ELMR與病理學評分的相關性。P< 0.05為差異有統計學意義。
2 結果
2.1 肝臟病理評分改變
所有大鼠造模后存活,并順利完成MR檢查。光鏡下可見不同程度的肝細胞壞死、水腫和核溶解,炎癥細胞浸潤(圖2)。肝臟左、右葉病理評分有統計學差異(P=0.008)。

圖2 肝臟損傷病理評分 HE ×100Fig.2 Score for liver injury HE ×100
2.2 MR數據分析結果
所有大鼠平掃肝臟左、右葉T1WI的LMR及2種造影劑增強后的ELMR均方差齊,符合正態分布,左、右葉的參數比較均有統計學差異(表1)。Gd-EOB-DTPA和Gd-DTPA增強檢查所得ELMR和病理評分均呈負相關,Gd-EOB-DTPA的相關性(r=-0.865,P< 0.001)(圖3A)高于Gd-DTPA(r=-0.532,P< 0.001)(圖3B)。Gd-EOB-DTPA增強后肝臟左、右葉的ΔELMR大于Gd-DTPA(P< 0.05)(圖4)。

表1 肝臟左、右葉MR各參數比較Tab.1 Comparison of MR parameters of all left and right lobes of liver
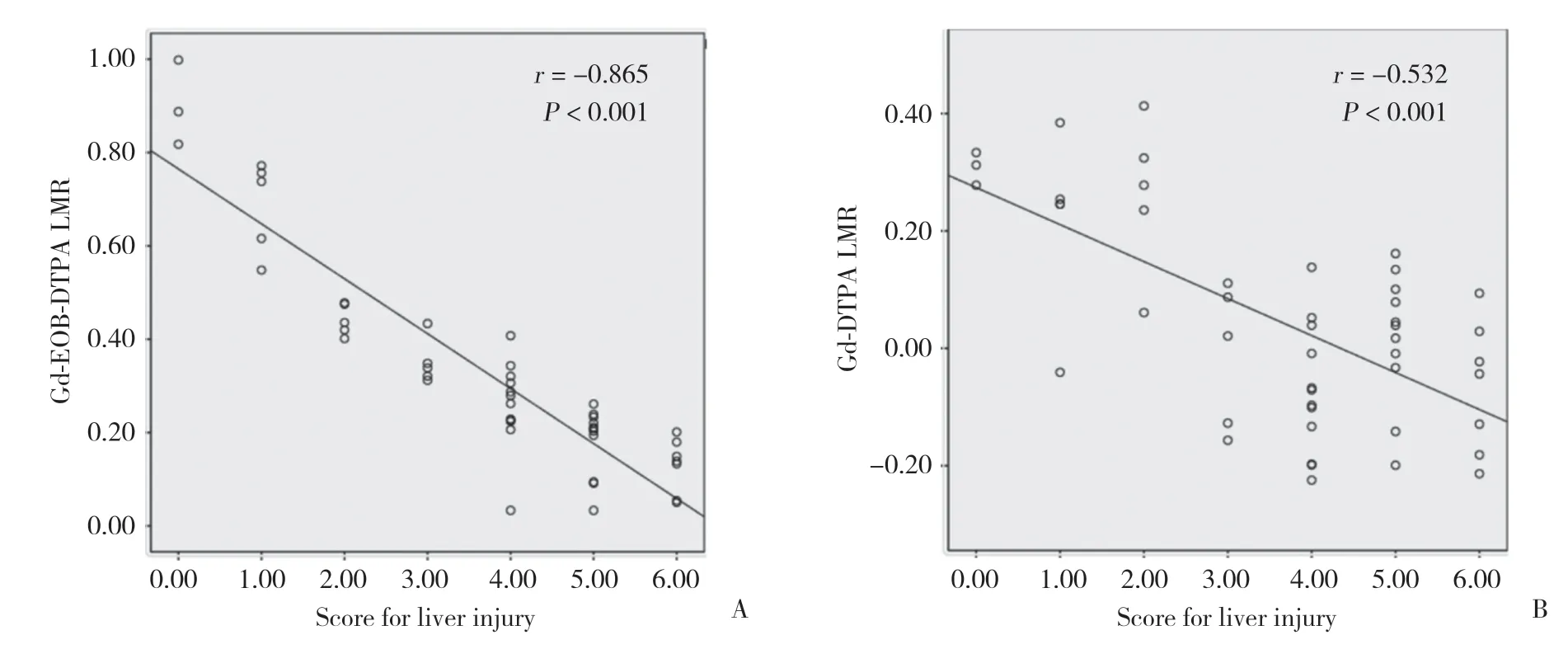
圖3 Gd-EOB-DTPA、Gd-DTPA增強MR的ELMR與肝損傷病理評分的相關性Fig.3 Correlations between the signal intensity of ELMR on Gd-EOB-DTPA-enhanced or Gd-DTPA-enhanced MR and hepatic injury scores
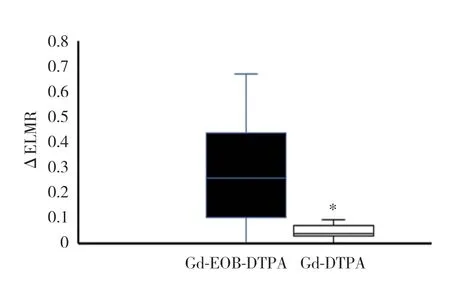
圖4 Gd-EOB-DTPA及Gd-DTPA增強MR的ΔELMR比較Fig.4 Comparison of ΔELMR for quantitative detection hepatic injury with Gd-EOB-DTPA-enhanced MR and Gd-DTPAenhanced MR
3 討論
肝功能變化通常與肝纖維化有關。肝纖維化的特征是小葉和血管結構破壞及肝組織結節性再生。病毒性肝炎、肝切除手術、肝臟血管栓塞術或放射治療等都會引起不均勻的肝損傷,導致肝功能異常[7]。近年來,肝臟特異性造影劑MR檢查精確檢測肝功能日漸成為研究熱點,但其相關研究缺乏標準化。
細胞外造影劑Gd-DTPA是一種順磁性小分子親水性化合物,靜脈注射后迅速分布于血管內、外間隙,而極少與血漿蛋白結合,幾乎不會被肝細胞攝取,亦不參與肝細胞代謝,增強過程中不同時相強化原因也不同。增強早期強化主要為富血供部位和病變,即動脈供血多,如動門脈瘺部位和原發性肝細胞癌、炎癥肉芽組織等;肝實質期(延遲期)血管內、外間隙的造影劑濃度趨于平衡,因此肝臟的強化程度趨于均勻一致。本研究中,于Gd-DTPA注射5 min后進行肝臟增強掃描,此時造影劑均勻分布于血管內、外的細胞外間隙,大鼠的急性不均勻肝損傷造成肝組織內不均勻的肝細胞腫脹、壞死和炎癥反應,肝組織內不均勻血供減少,具有血流和物質交換功能的血管內、外間隙不均勻減小,因此,增強后肝組織呈現不均勻強化減低現象,且病理損傷較重的局部信號減低更明顯。肝臟左、右葉因損傷程度不同出現不同增強效果,且其ELMR與局部病理損傷評分呈負相關。
Gd-EOB-DTPA是一種肝臟特異性順磁性對比劑。肝細胞基底側細胞膜的有機陰離子轉運多肽OATP1B1/B3是一類攝取型轉運體,其底物眾多,如吲哚青綠和Gd-EOB-DTPA。相對于細胞外造影劑,Gd-EOB-DTPA不僅可以檢測肝臟的微循環狀況,等同于細胞外造影劑功能,還可以被肝細胞特異性攝取,延長造影劑在肝內聚集時間,待細胞外間隙的造影劑被排泄后,檢測殘留于肝細胞內的造影劑,用于反映組織內肝細胞數量及肝細胞攝取功能,因此,能間接反映肝臟組織受損程度。本研究中,大鼠的急性不均勻肝損傷造成肝組織內不均勻的肝細胞腫脹、壞死和炎癥反應,也導致肝細胞膜轉運多肽減少。注射Gd-EOB-DTPA 20 min后進行MR掃描時,血管內及周圍間隙的Gd-EOB-DTP基本已經過腎臟和膽道系統排泄到膀胱及腸管內,故肝組織MR信號強度主要取決于肝細胞數量和肝攝取Gd-EOBDTPA量,肝組織呈現不均勻強化減低現象,并且病理損傷較重的局部信號減低更明顯。因此,肝臟左、右葉因損傷程度不同而出現不同的增強效果,且其ELMR與局部病理損傷評分呈負相關。
本研究結果顯示,Gd-EOB-DTPA增強后肝臟左、右葉的ΔELMR大于Gd-DTPA。2種造影劑的增強到達肝膽期的延遲時間的設定與臨床中一致。究其原因,可能是Gd-DTPA增強后延遲期(5 min后)反映的是單位體積肝組織內具有血流和物質交換功能的微血管內、外間隙的分布狀況,即功能性微血管內、外間隙的密度,這種微觀的密度差異體現為宏觀的強化程度差異。而Gd-EOB-DTPA增強后延遲期(20 min后)則反映的是單位體積肝組織內肝細胞的數量和肝細胞攝取造影劑的能力,即肝細胞內殘留造影劑的量,這種微觀的濃度差異體現為宏觀的強化程度差異。由此可見,肝組織內造影劑濃度差異比功能性微間隙差異更能準確反映肝臟組織受損程度的差異。
本研究采用的大鼠肝損傷模型是不均勻損傷模型,造模過程中每只大鼠肝臟的損傷部位和損傷程度具有不可控性(P=0.008),該模型是由本課題組前期研究的自創新模型,病理已證實其肝臟左、右葉不均勻損傷的可靠性[8]。這主要由于每只大鼠脾靜脈回流血在肝臟組織內分布不同,具有明顯的隨機性,造成秋水仙堿在肝組織內的分布濃度不可控,因此,每只大鼠的肝組織受損部位和程度不可控。本研究中,2組大鼠采用不同順序間隔24 h先后注射2種造影劑,進行了自身對照研究,就是為了有效減少每只大鼠肝臟不均勻損傷的個體差異造成的實驗誤差。另有研究[9-11]顯示,注射造影劑12 h后,2種造影劑均可達到90%以上排出體外。故本研究采用間隔24 h先后注射2種造影劑進行增強MR檢查。
本研究尚存在以下不足之處:肝臟病理評分存在人為主觀因素,如結合生化檢查佐證,結果將更為準確;MR圖像分析中ROI的選擇與病理標本切片部位難以做到精確一致,需要標準化測量和多學科協作;MR信噪比的不穩定性會影響實驗結果的準確性;注射秋水仙堿后分別在第3天和第4天采集2種不同造影劑的增強MR數據,可能對實驗結果產生一定影響,但前期研究結果顯示,術后3 d肝急性損傷病理變化明顯,且3~7 d時病理損傷評分相對穩定。
綜上所述,肝臟特異性造影劑Gd-EOB-DTPA和細胞外造影劑Gd-DTPA增強MR對肝損傷均具有鑒別能力,但肝臟特異性造影劑Gd-EOB-DTPA的效果優于細胞外造影劑,本研究結果仍有待進一步深入研究。

