基于RNA-seq技術的釀酒酵母響應甲酸脅迫的分子機制研究
曾令杰,黃錦翔,豐丕雪,安佳星,佀再勇,龍秀鋒,易弋*
1(廣西科技大學 生物與化學工程學院,廣西 柳州,545006)2(廣西糖資源綠色加工重點實驗室,廣西 柳州,545006)
木質纖維素是自然界中含量最豐富的一種清潔、可再生資源,其水解液可通過釀酒酵母(Saccharomycescerevisiae)發酵生產纖維素乙醇,能有效緩解緊迫的能源危機和環境污染問題[1-2]。然而在木質纖維素水解液中存在多種抑制劑,會對酵母細胞生長和乙醇產量產生負面影響[3]。可以根據水解過程中產生的抑制物的化學性質不同分為以下幾類:弱酸類(乙酰丙酸、甲酸、乙酸等)、呋喃類(糠醛、5-羥甲基糠醛等)和酚類物質(苯酚、香草醛、兒茶酚等)[4-5]。其中甲酸是呋喃類化合物進一步降解形成的,而乙酸則主要是在半纖維素脫乙酰的過程中產生的[6]。甲酸的濃度通常比乙酸低,但對釀酒酵母的毒性比乙酸高[7-8]。劉容等[9]研究了甲酸對季也蒙假絲酵母發酵木糖醇的影響,結果表明添加1 g/L甲酸對發酵具有較為明顯的抑制作用,而添加5 g/L甲酸幾乎完全抑制了發酵。李小娟等[10]也研究了甲酸對釀酒酵母生長、發酵過程的影響,結果表明釀酒酵母可耐受甲酸質量濃度為1.8 g/L,且隨著甲酸濃度的增高,對釀酒酵母生長的抑制逐漸加強,且能抑制60%的乙醇生產。宋曉川等[11]研究了碳水化合物的降解產物對釀酒酵母NLH13乙醇發酵毒性的影響,在甲酸質量濃度達2 g/L時,糖利用率大幅度下降。盡管不容易闡明弱酸的抑制機制,但有人提出弱酸的抑制作用歸因于解偶聯理論和細胞內陰離子積累[12-13]。也有研究認為甲酸對微生物細胞的毒性與溶液的pH值有關[14-15]。WANG等[16]研究發現在釀酒酵母分批培養過程中,強酸脅迫(pH值為1.5)能明顯抑制細胞的生長代謝。NIGAM[17]研究發現通過適當調節pH值可以減少甲酸的抑制作用,提高燃料乙醇生產效率。此外,甲酸對細胞的毒性作用可能跟胞內活性氧積累有關,LEE等[18]通過蛋白質組學研究發現甲酸會引起釀酒酵母細胞發生氧化應激,從而導致抑制的細胞分裂和死亡。杜林等[19]研究表明低濃度的甲酸可導致細胞內線粒體活性氧快速產生,對數期釀酒酵母細胞對甲酸更為敏感,死亡率更高。因此如何消減木質纖維素水解液中的酸類細胞抑制劑對水解和發酵的不利影響是提高乙醇轉化效率的一個重要挑戰。
本研究采用RNA-seq技術,對釀酒酵母在1.8 g/L甲酸培養條件下進行了測序分析,并結合生物信息學對差異表達基因進行GO(Gene Ontology)和KEGG(Kyoto Encyclopedia of Genes and Genomes)注釋和富集分析,初步揭示了甲酸脅迫下釀酒酵母的分子響應機制,為進一步如何提高釀酒酵母木質纖維素水解產物抑制劑的耐受性提供了理論依據。
1 材料與方法
1.1 材料
1.1.1 菌種
釀酒酵母(S.cerevisiaeGGSF16)由廣西科技大學微生物研究室保藏。
1.1.2 培養基
YPD培養基(g/L):酵母粉10,蛋白胨20,葡萄糖20,pH值自然,115 ℃滅菌30 min。
發酵培養基(g/L):酵母粉10,蛋白胨20,葡萄糖160,pH值自然,115 ℃滅菌30 min。
1.2 儀器與試劑
1.2.1 主要儀器
456-GC氣相色譜儀,天美創科儀器(北京)有限公司;HITACHI高效液相色譜儀、HIMAC大容量冷凍離心機,日本株式會社日立制作所;DY-6D DNA電泳儀,北京市六一儀器廠;UV-1100紫外可見分光光度計,上海美譜達儀儀器有限公司;ZWYD-2402搖床、ZHJH-C112C超凈臺,上海智誠分析儀器制造有限公司;B-500微量分光光度計,上海元析儀器有限公司;H2100R離心機,湖南湘儀實驗室儀器開發有限公司。
1.2.2 主要試劑
葡萄糖(BR),天津市科密歐化學試劑有限公司;蛋白胨(BR),廣東環凱微生物科技有限公司;酵母粉(BR),合肥博美生物科技有限責任公司;甲酸(AR),西隴科學股份有限公司;RNA提取試劑盒,大連寶生物;DNA Marker,北京索萊寶科技有限公司;Tris,BioFroxx公司。
1.3 試驗方法
1.3.1 甲酸對釀酒酵母細胞生長的影響
從斜面試管中挑取保藏的酵母菌株于YPD培養基中,在30 ℃,150 r/min搖床中培養14 h后,按照10%接種量接種于新鮮的YPD培養基中,在搖床中培養6 h至指數中期,初始酵母細胞數為4.2×107CFU/mL。取30 mL菌液于12 000 r/min離心3 min,棄上清液,并加入無菌水制成10倍濃縮種子菌懸液。將種子濃縮菌懸液接種到含有終質量濃度為1.2、1.5、1.8、2.1 g/L甲酸溶液的發酵培養基中,以未添加甲酸的菌液作為對照組, 30 ℃培養24 h,每隔2 h取樣在600 nm下測定光度吸收值,并繪制生長曲線。
1.3.2 甲酸對釀酒酵母發酵性能的影響
根據釀酒酵母的生長情況,選擇1.8 g/L的甲酸進行發酵性能的測定。按照1.3.1的方法,以添加甲酸的菌液為實驗組,未添加甲酸的菌液為對照組,在30 ℃,150 r/min搖床中培養24 h,每隔2 h取樣,測殘糖及乙醇含量。本次實驗采用高效液相色譜儀檢測糖類物質,用Alltima 5 μm Amino(250 mm×4.6 mm)柱子檢測發酵液中葡萄糖的含量。液相色譜檢測糖的方法為:V(色譜純乙腈)∶V(超純水)=80∶20的混合溶液,超聲過濾后方可作為流動相使用,流速為1 mL/min,進樣量為20 μL,示差折光檢測器溫度35 ℃。采用高效氣相色譜儀檢測發酵液中的乙醇含量,色譜柱為TM-930(25 m×0.53 mm×1 μm);氣相色譜檢測乙醇方法為:進樣前溶劑清洗3次,樣品清洗5次,進樣后溶劑清洗3次;進樣模式:進樣口溫度180 ℃,分流比20∶1,檢測器溫度 230 ℃;柱流量恒流2 mL/min;檢測方法:初始溫度40 ℃,以5 ℃/min的速率升至80 ℃,保持2 min,再以10 ℃/min的速率升至150 ℃;進樣體積0.5 μL。
1.3.3 RNA提取、文庫構建及測序
將活化的酵母菌種按照2%接種量接種于新鮮的YPD培養基中,在30 ℃,150 r/min搖床中培養 6 h 至對數中期,以添加1.8 g/L甲酸的菌液為實驗組,未添加甲酸的菌液作為對照組,繼續培養2 h,收集細胞用于后續RNA提取。本實驗設置3個平行,對照組(ck1、ck2、ck3)和甲酸組(for1、for2、for3)。取新鮮培養的菌液200 μL,使用酵母RNA提取試劑盒說明書提取總RNA。采用1%(質量分數)瓊脂糖凝膠電泳檢測RNA完整性和純度,微量分光光度計檢測RNA濃度以及DNA和蛋白質污染情況,保證RNA濃度≥250 ng/μL,總量≥40 μg,且OD260/OD280和OD260/OD230均>1.8。釀酒酵母總RNA檢測合格后,需要對樣品中的mRNA進行富集,并去除rRNA、tRNA以及其他雜質。首先用帶有Oligo(dT)的磁珠富集mRNA,隨后加入適量的打斷試劑使其片段化,再以片段化的mRNA為模板合成雙鏈cDNA,經磁珠純化、末端修復、加A并連接測序接頭,最后進行PCR富集得到cDNA文庫,構建好的文庫經過質量檢測合格后使用BGISEQ測序平臺進行測序。cDNA文庫構建以及測序工作均在深圳華大基因科技服務有限公司完成。
1.3.4 測序數據分析
對測序所得到的原始數據(raw reads)首先去除含有接頭的reads、未知堿基N含量過高、低質量的reads得到clead reads,作為本研究的基本數據。使用HISAT將clead reads與指定的參考基因組進行序列比對,并用RSEM(RNA-Seq by expectation maximization)工具計算基因的表達水平,并使用R軟件分析樣品間基因表達水平相關性。使用DESeq2算法對2組樣品進行差異表達分析,將差異顯著性q值(qvalue<0.05)和差異倍數(fold change≥2)作為篩選標準進行差異表達基因的篩選。本試驗研究采用DAVID和KOBAS軟件對差異基因進行GO功能富集分析和KEGG通路富集分析等。
2 結果與分析
2.1 不同質量濃度甲酸對酵母細胞生長的影響
如圖1所示,甲酸對釀酒酵母的生長抑制隨著甲酸質量濃度的升高而增強。對照組在2 h進入對數期,6 h到達對數生長中期,8 h進入穩定期,其中添加1.2 g/L的甲酸對酵母細胞的生長影響不大。而在添加1.5 g/L甲酸的脅迫下,酵母細胞的生長立即受到抑制,但隨著時間的推移,抑制作用逐漸減弱,最終生長速度略低于無甲酸處理組。甲酸質量濃度由1.5 g/L增至1.8 g/L時,酵母細胞生長明顯受到抑制,在10 h才達到對數生長中期,且與無甲酸處理組相比,穩定時間得到延長。當甲酸質量濃度增至2.1 g/L時,釀酒酵母細胞幾乎沒有生長。而為了獲得有價值的轉錄組學數據,本研究選擇了添加1.8 g/L甲酸脅迫下的酵母細胞作為實驗組。
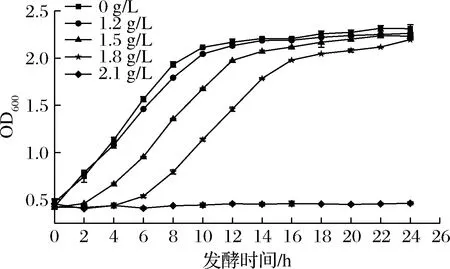
圖1 甲酸對酵母細胞生長的影響Fig.1 The effect of formic acid on the growth of yeast cells
2.2 甲酸對酵母細胞發酵性能的影響
甲酸是木質纖維素水解液中一種酸類細胞抑制物,添加甲酸會抑制酵母細胞的生長,從而抑制葡萄糖的消耗和乙醇的生成,本次實驗研究了在添加1.8 g/L甲酸脅迫條件下對酵母細胞發酵性能的影響。由圖2可知,對照組在6~14 h葡萄糖消耗較快,在16 h時葡萄糖基本消耗完全,而添加甲酸后葡萄糖消耗延遲為10~18 h,在20 h時葡萄糖才基本消耗完全。此外,乙醇快速生成延遲為10~18 h,在相同時間點下對照組產乙醇量均比甲酸組要高。說明甲酸的添加明顯延長了酵母細胞發酵的周期,降低了乙醇產量。
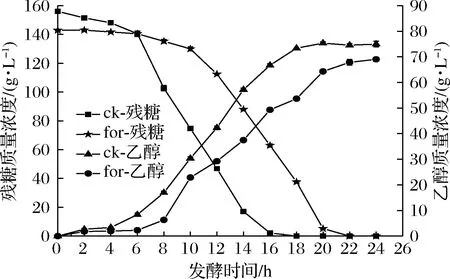
圖2 甲酸對酵母細胞乙醇發酵性能的影響Fig.2 Effect of formic acid on ethanol fermentation of yeast cells
2.3 RNA質量分析
轉錄組測序的RNA樣品質量要求OD260/OD280為1.8~2.2、OD260/OD230>2時核酸的純度較高,RNA完整性(RNA integrity number,RIN)為1~10,數值越接近10完整性越好。本次實驗中,6個樣品RNA質量濃度均>510 ng/μL,RIN均為10,28S/18S均在1.8~2.2,OD260/OD280和OD260/OD230均在要求范圍內,說明提取的RNA純度、濃度和完整度等質量指標均可滿足實驗要求,可用于后續建庫測序。
2.4 測序數據質控
我們將原始數據經過一系列數據處理來過濾雜質得到過濾數據(clean reads)。由表1可知各樣品clean read均達到6.41 Gb以上,對照組和甲酸組的Q20平均值分別為97.27%和97.26%,Q30平均值分別為89.73%和89.53%,表明原始測序質量合格,可用于后續數據分析。
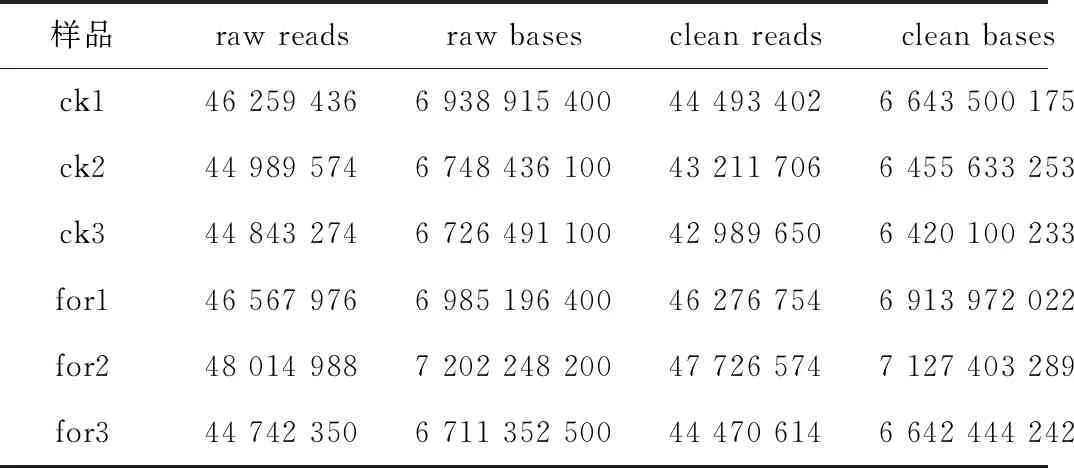
表1 測序數據統計表Table 1 Statistical table of sequencing data
2.5 與參考基因組比對統計
將獲得clean reads使用HISAT軟件比對到參考基因組序列,結果如表2所示。在Illumina產生的clean reads中,對照組和甲酸組分別有超過95.91% reads和96.31%覆蓋到參考基因組上,多個比對位置的reads占比分別為1.27%和1.48%以上,唯一比對上的reads也分別超過了94.64%和94.83%。說明clean reads與參考基因組序列比對情況較好,測序數據原始數據結果可靠,可滿足后續實驗分析的需求。
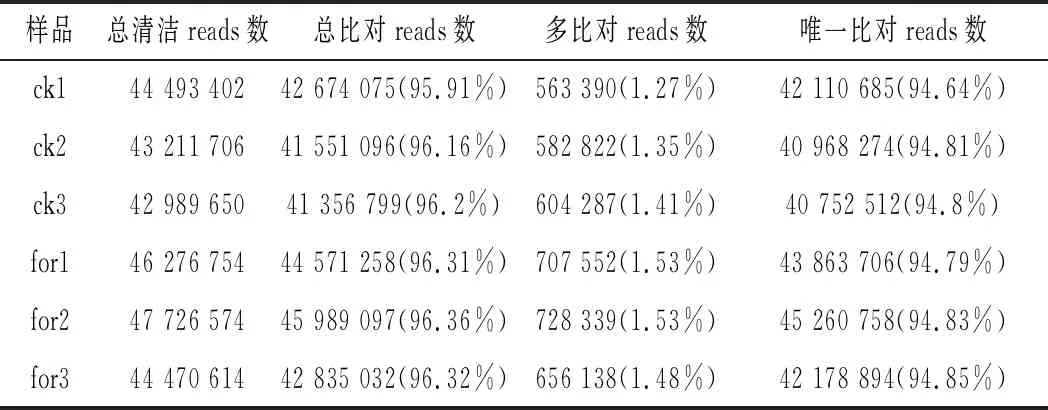
表2 參考基因組比對結果統計Table 2 Statistical results of reference genome comparison
2.6 測序樣品相關性分析
本實驗中對照組和甲酸組均有3個生物學重復,共有6組轉錄組測序數據。由圖3可知,對照組與甲酸組組間相關性系數約為0.85,平行樣品間相關系數為0.992,說明本研究中樣品間重復性較好,2組差異相對較大,實驗結果可靠,可用于后續分析。
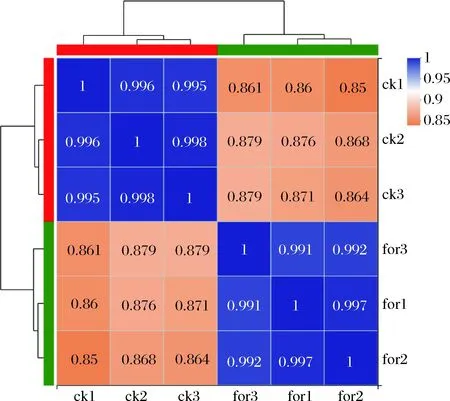
圖3 對照組和甲酸組相關性熱圖Fig.3 Ck-for correlation heat map
2.7 差異表達基因分析
為了研究添加甲酸處理前后的差異表達基因,對2組測序后得到的所有基因進行差異表達篩選,以fold change≥2且qvalue<0.05作為篩選條件,共篩選出差異表達基因(different expression genes,DEGs)1 504個,其中上調基因797個,下調基因707個,分別占總DEGs的52.99%和47.01%,采用火山圖和散點圖來描述差異基因整體分布情況,如圖4所示。
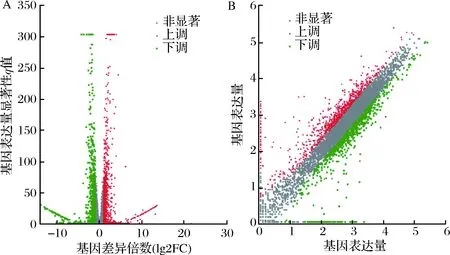
A-火山圖;B-散點圖圖4 對照組和甲酸組的火山圖與散點圖Fig.4 Ck-for volcano map and scatter plot注:圖中1個點代表1個特定的基因,紅色點表示顯著上調的基因,綠色點表示顯著下調的基因,灰色點為非顯著差異基因。
2.8 差異表達基因功能注釋和富集分析
2.8.1 差異表達基因GO功能注釋和富集分析
對篩選出來的差異表達基因進行GO功能分類,可以查看差異表達基因與哪些生物學功能顯著相關。GO注釋系統是一個有向無環圖,包含3個主要分支,即生物學過程(biological process),細胞組成(cellular component)和分子功能(molecular function)[20]。本次研究GO共注釋到45個GO term,挑選富集最顯著的前20 GO term繪制差異表達基因GO功能柱狀圖,如圖5所示。由圖5可知,生物學過程有19個GO term,多數差異表達基因參與了細胞過程(cellular process)、代謝過程(metabolic process)、生物調節(biological regulation)以及對刺激的反應(response to stimulus)等;細胞組成中有13個GO term,主要有細胞器(organelle)、含蛋白質復合物(protein-containing complex)、膜部分(membrane part)、細胞外區域(extracellular region)等;分子功能中有13個GO term,多數基因參與了捆綁(binding)、催化活性(catalytic activity)、運輸活動(transporter activity)、轉錄調節活性(transcription regulator activity)、抗氧化活性(antioxidant activity)以及蛋白質折疊伴侶(protein folding chaperone)等。我們對差異基因進一步進行了GO富集分析,圖中橫坐標為富集比例,縱坐標為富集的GO term,氣泡的大小表示注釋到某個GO term上的差異基因數目,顏色代表富集P值,顏色越深代表P值越小。由圖6可知,差異表達基因主要富集在核糖核蛋白復合體(ribonucleoprotein complex)、細胞質翻譯(cytoplasmic translation)、翻譯(translation)、核糖體(ribosome)、rRNA加工(rRNA processing)、核糖體生物發生(ribosome biogenesis)、質膜部分(plasma membrane part)、跨膜轉運蛋白活性(transmembrane transporter activity)、果糖跨膜轉運蛋白活性(fructose transmembrane transporter activity)、運輸活性(transporter activity)等GO term中。以上結果表明,在甲酸的脅迫下,釀酒酵母中大多數與核糖體有關的基因表達受到影響,進而影響了mRNA 翻譯。IWAKI等[21]研究表明添加香蘭素能夠抑制酵母細胞中的翻譯,朱寧等[22]探究微芯片脈沖電場技術對畢赤酵母的致死效果和致死機理,微芯片脈沖電場處理造成畢赤酵母基因損傷、蛋白質轉錄翻譯受阻,蛋白功能被部分抑制,與本次試驗結果基本一致。
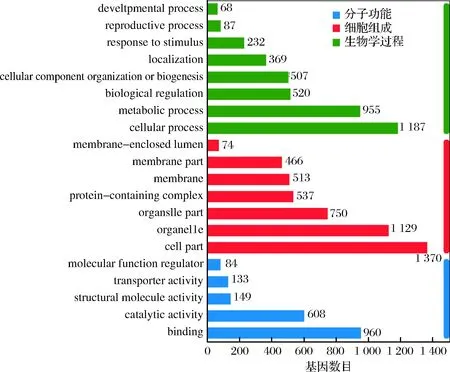
圖5 差異表達基因GO功能分類圖Fig.5 Differentially expressed gene GO function classification map注:圖中縱坐標表示GO term,橫坐標表示比對上該GO term的基因數量,顏色表示不同基因集
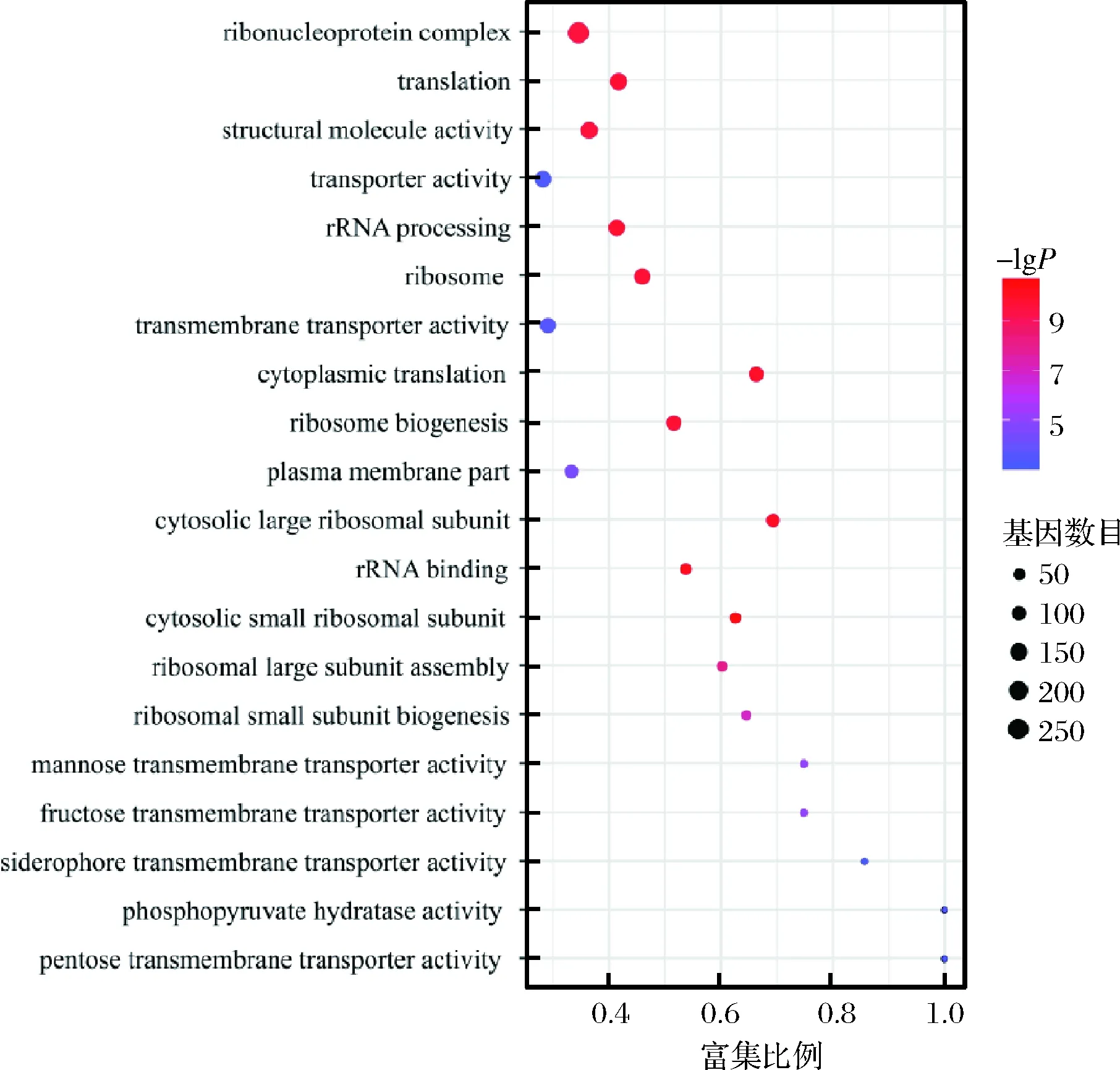
圖6 差異表達基因GO富集圖Fig.6 Differentially expressed gene GO enrichment map
2.8.2 差異表達基因KEGG富集分析
KEGG 是有關基因通路的主要公共數據庫[23],在生物體內,不同的基因產物相互協調來行使生物學功能,對差異表達基因的通路注釋分析有助于進一步解讀基因的功能,將基因根據參與的KEGG代謝通路分為5個分支:細胞過程(cellular processes)、環境信息處理(environmental information processing)、遺傳信息處理(genetic information processing)、代謝(metabolism)及有機系統(organismal systems)。其結果如圖7所示。由圖7可知,在分類中代謝占據主導地位,主要以碳水化合物代謝、能量代謝、氨基酸代謝以及核苷酸代謝為主;其次在細胞過程中,以細胞生長與死亡、運輸和分解代謝為主;在遺傳信息處理中,折疊、分類、降解、翻譯占比居多,其次是復制、修復、轉錄。在環境信息處理過程中,主要以信號轉導為主。為了確定差異表達基因參與的最主要生化代謝途徑和信號轉導途徑,本研究使用KOBAS軟件進行KEGG通路富集分析,結果表明總共富集在101個通路中,我們將其中富集最顯著的20條通路繪制差異基因KEGG通路富集散點圖,如圖8所示。由圖8可知,添加甲酸組和對照組培養條件下的差異表達基因有116個DEGs富集在核糖體通路、38個DEGs富集在減數分裂-酵母、40個DEGs富集在絲裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信號通路、27個DEGs富集在真核生物的核糖體生物發生、26個DEGs富集在糖酵解/糖異生、24個DEGs富集在嘌呤代謝、20個DEGs富集在半胱氨酸和蛋氨酸的代謝、20個DEGs富集在淀粉和蔗糖代謝、14個DEGs富集在過氧化物酶體、13個DEGs富集在三羧酸循環、12個DEGs富集在半乳糖代謝、10個DEGs富集在果糖和甘露糖代謝、8個DEGs富集在自噬、8個DEGs富集在纈氨酸,亮氨酸和異亮氨酸的生物合成、8個DEGs富集在脂肪酸降解、8個DEGs富集在硫代謝、7個DEGs富集在β-丙氨酸代謝、7個DEGs富集在泛酸和CoA生物合成、6個DEGs富集在ABC轉運、5個DEGs富集在不飽和脂肪酸的生物合成。由此可見,核糖體在甲酸脅迫中起著重要的作用,且發現與細胞質核糖體生物合成相關的基因大部分下調,與線粒體核糖體上調。LI等[24]研究乙醇脅迫下釀酒酵母的響應機制,發現與核糖體、核糖體生物合成相關的基因大部分下調,與線粒體核糖體相關的基因表達沒有出現明顯的變化,與我們試驗結果一致。減數分裂、糖酵解/糖異生和三羧酸循環等相關通路也發生了顯著的變化,推測釀酒酵母可能進入有性生殖形成孢子,并在甲酸脅迫下產生子囊和子囊孢子,還可能通過糖代謝途徑合成大量的ATP,為抵抗甲酸的脅迫提供了充足的能量,從而提高了甲酸的耐受性。此外,釀酒酵母也可以通過信號轉導途徑相關基因的表達來響應甲酸的脅迫。
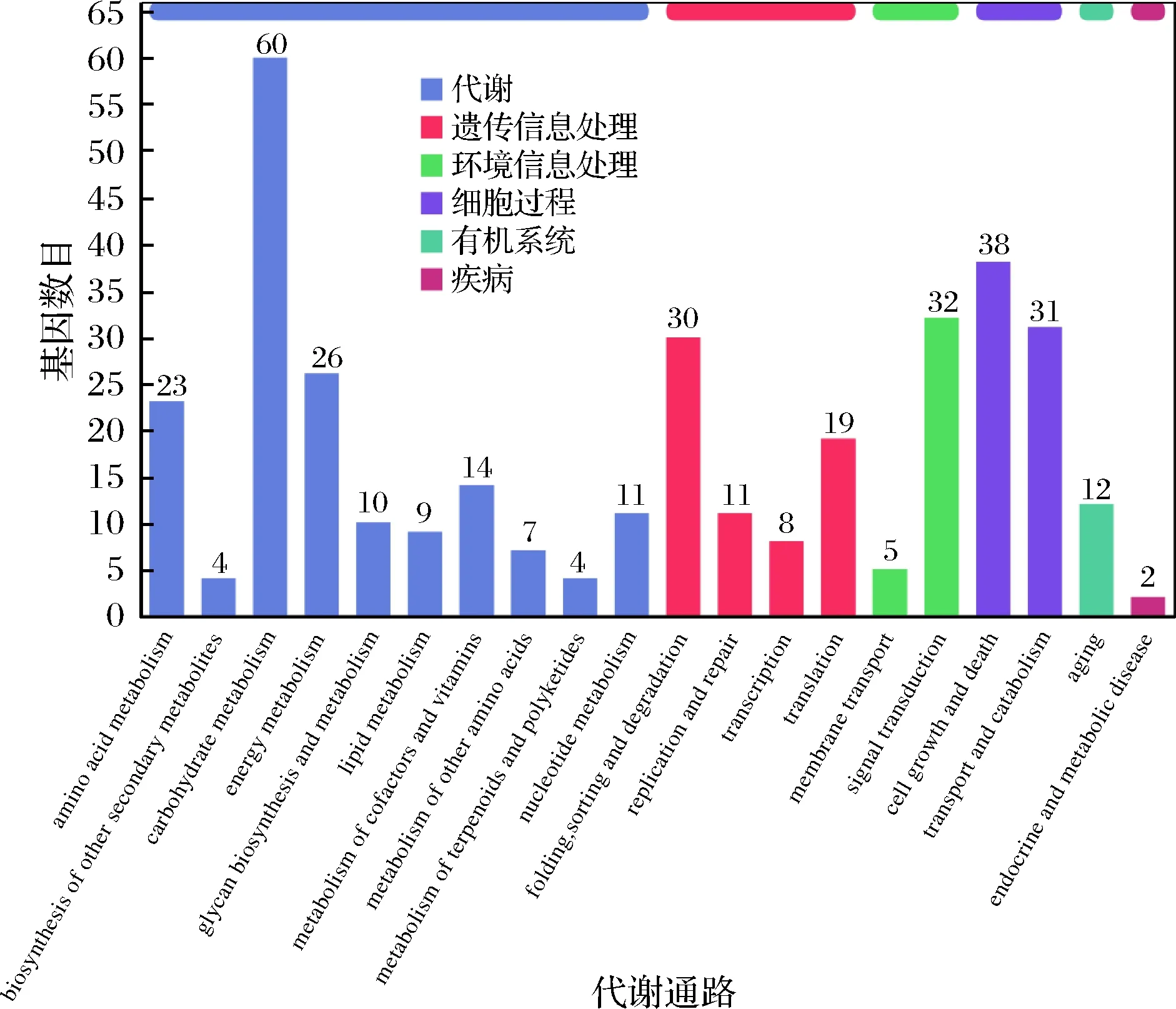
圖7 差異表達基因KEGG通路分類圖Fig.7 Differentially expressed genes KEGG pathway classification map注:橫坐標為KEGG代謝通路的名稱,縱坐標為注釋到該通路下的基因的數量
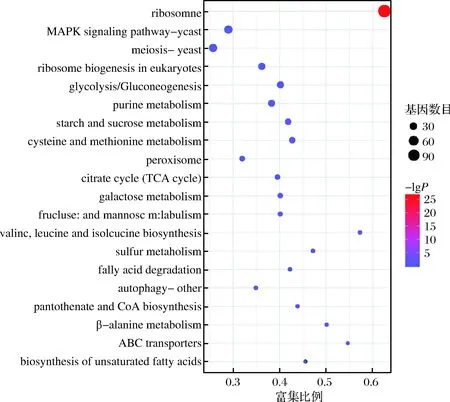
圖8 差異表達基因KEGG通路富集圖Fig.8 Differentially expressed genes KEGG pathway enrichment map注:圖中橫坐標表示富集比例,富集比例越大,則富集的程度越大,縱坐標為通路,點的大小表示此通路中基因個數多少,顏色代表富集的顯著性大小
3 討論與結論
本研究針對釀酒酵母在不同濃度甲酸的脅迫條件下進行發酵性能的測定,發現添加甲酸能明顯地抑制酵母細胞的生長,延遲發酵周期并降低乙醇量。而我們根據釀酒酵母的生長情況,選擇1.8 g/L的甲酸進行轉錄組測序分析,共獲得38.46 Gb clean reads測序數據,我們以qvalue<0.05且fold change≥2為篩選條件,對照組和甲酸組共篩選出1 504個顯著差異表達基因,其中上調基因797個,下調基因707個。通過GO富集以及KEGG通路富集分析表明,2組樣品上調基因主要參與減數分裂-酵母、MAPK信號通路、淀粉和蔗糖代謝、糖酵解/糖異生、細胞周期、半乳糖代謝、果糖和甘露糖代謝等通路,而下調基因主要參與了核糖體通路、真核生物的核糖體生物發生、半胱氨酸和蛋氨酸的代謝、嘌呤代謝、纈氨酸、亮氨酸和異亮氨酸的生物合成、不飽和脂肪酸的生物合成、脂肪酸降解等通路。通過RNA-seq分析表明,在甲酸的脅迫下釀酒酵母響應分子機制可能有以下幾點:首先,釀酒酵母為了響應甲酸的脅迫通過上調糖代謝以及氧化磷酸化相關基因的表達,為抵抗甲酸的脅迫提供充足的能量;其次,可以利用線粒體核糖體合成有關蛋白質來抵御甲酸的侵擾,并在甲酸脅迫下能夠對自身產生的能量進行合理分配,合成應對脅迫所需物質對細胞進行保護;再次,半胱氨酸和蛋氨酸代謝、蛋白折疊和蛋白降解某些基因表達下調,猜測是甲酸的添加使細胞產生氧化脅迫,因此造成蛋白變性,而釀酒酵母則可以通過上調蛋白折疊和降解相關的基因表達,幫助酵母細胞蛋白質正確折疊、防止變性蛋白聚集,從而有助于細胞恢復正常的生理代謝功能;最后,通過上調減數分裂、細胞周期以及MAPK信號通路相關基因的表達,促進對營養物質的吸收,提高釀酒酵母對甲酸的耐受性。本研究初步揭示了釀酒酵母對甲酸的脅迫響應機制,但具體基因的作用效果和分子機制還有待進一步研究,后期我們將驗證與脅迫響應相關的關鍵基因。本文為進一步提高釀酒酵母細胞酸類抑制劑的耐受性方法提供了科學依據。

