TiC粉體合成的研究現(xiàn)狀與展望
王 珍,凌永一,尹藝程,王子昊,張 婧,賈全利,劉新紅
(鄭州大學,河南省高溫功能材料重點實驗室,鄭州 450052)
0 引 言
TiC的晶體結構屬于氯化鈉型結構,鈦原子作面心立方排列,碳原子存在于八面體間隙中,TiC常表現(xiàn)出非化學計量特性(TiCx,x=0.60~0.98)[1]。TiC作為一種很有前途的陶瓷材料,具有優(yōu)異的物理、化學和力學性能,如:高熔點(3 150 ℃)、高硬度(3 000 kg/m2)、優(yōu)異的熱穩(wěn)定性和化學穩(wěn)定性、良好的耐蝕性和耐磨性等[2-3]。TiC粉體用途廣泛,可用于制造刀具、砂輪[4],或與其他陶瓷材料(氧化鋁、氮化硅、碳化硅)復合而制造耐高溫或耐腐蝕性的結構部件[5-6]。TiC粉體在生物醫(yī)學、環(huán)境凈化、新型復合材料等領域也具有較好應用前景[7-9]。如:TiC粉體可用作多孔管的過濾材料,或作為水凈化和固相萃取吸附劑[10];還可作為氨硼烷水解催化劑的載體材料[11]以及用作核醫(yī)學同位素追蹤[12]。另外,TiC顆粒還可彌散在金屬基體中,高溫下阻礙金屬的位錯運動和再結晶過程,有助于細化基體組織,從而提高基體的顯微硬度和熱穩(wěn)定性[13]。而不同應用領域對TiC粉體的純度、粒度和顯微結構等要求有所不同。本文綜述了合成TiC粉體的各種方法,并分析每種方法合成粉體的純度、粒度、形貌等,以及各種方法的優(yōu)勢及局限性,期望為TiC粉體合成和應用提供技術參考。
1 碳/金屬熱還原法
1.1 碳熱還原法
碳熱還原法是合成TiC粉體最常用的方法,此方法常采用二氧化鈦粉、鈦凝膠以及富鈦礦渣等為鈦源,以石墨、炭黑、活性炭、乙炔炭黑、石油等為碳源,在高溫(>1 300 ℃)真空或保護性氣氛(如:Ar)下合成TiC,主要反應如式(1)所示[14]。碳熱還原法合成的TiC粉體大多在微納米尺度,易于團聚。
TiO2+3C=2CO+TiC
(1)
合成TiC時,碳源的種類及粒度對產(chǎn)物TiC的晶粒尺寸影響顯著。Koc等[15]以平均粒徑16 nm的炭黑粉體和平均粒徑為21 nm的TiO2粉體為原料,采用球磨混合5 h后,在流動Ar氣氛中1 550 ℃下保溫4 h合成了粒徑為0.3~0.6 μm的TiC粉體。所合成的TiC粉體是含氧質量分數(shù)為0.7%的細小顆粒,顆粒間團聚明顯。若以木炭粉為碳源,在真空條件下TiO2粉在1 450~1 500 ℃下被還原成TiC,且TiO2粉與木炭粉摩爾比為1 ∶4時,可合成純TiC粉體[16]。將TiO2與木炭球磨6~10 h后,在真空中條件下1 450 ℃保溫8 h后合成的TiC粉體的平均粒徑為50 μm[17]。TiO2粉可被吸附在木炭的氣孔處,可使反應更徹底,且原料價格低廉、工藝簡單、粒徑均勻,但顆粒之間的團聚現(xiàn)象較為明顯,粉體中還含有Na、Ca、Mg等微量雜質。
若采用樹脂粉、蔗糖等作為碳源時,因其碳含量通常較低,故在合成過程中添加量的控制十分重要,因為添加量直接影響TiC的產(chǎn)量及純度。以樹脂粉(殘?zhí)柯蕿?5.9%)為碳源時,TiO2粉在Ar氣氛下于1 500 ℃下被碳還原0~45 min可合成粒徑為20~80 nm且粒度均勻的TiC顆粒[18]。Xie等[19]以鈦酸四丁酯(Cl6H36O4Ti)、乙醇(CH3CH2OH)、乙酸(CH3COOH)為原料,首先制備出TiO2溶膠,然后采用真空煅燒法在1 450 ℃保溫2 h合成了納米結構的球狀TiC粉體。Chen等[20]用鈦碳摩爾比為1 ∶3.5的原料(丁酸鈦(TBOT)為鈦源,蔗糖為碳源),首先制備出TiO2溶膠,然后在1 300 ℃還原2 h制備出了平均顆粒尺寸37.4 nm的TiC粉體。在碳不足的情況下(如C/Ti摩爾比為2.5時),TiO2未被完全還原,出現(xiàn)TiO、Ti2O3等中間產(chǎn)物;隨著碳含量的增加,TiC晶粒尺寸減小,當C/Ti摩爾比為3.5時得到晶粒尺寸為37.4 nm的TiC,Ti、C元素組成接近化學計量(TiCx,x=0.995 6)。Zlīte等[21]以Ti(IV)氯化物、乙二醇和檸檬酸(A系列)和Ti(IV)正丙氧化物、蔗糖和乙酸(B系列)等為原料制備出TiO2溶膠,干TiO2凝膠在Ar氣氛下,在800~1 400 ℃、0.5~10 h下煅燒得到了TiC粉體。在1 360 ℃時可以合成大量的TiC相,該溫度為最佳合成溫度,A系列合成的TiC平均粒徑為42 nm、比表面積為30 m2·g-1,但含有一定量的TiO2;而B系列在同樣條件下得到的產(chǎn)物只有TiC相,相同粒徑的TiC比表面積更大,為45 m2·g-1。Chandra等[22]用鈦凝膠前驅體和燃燒澄清黃油制備的碳顆粒(40 nm)在Ar氣氛中1 580 ℃保溫120 min合成了形狀為立方體和棒狀混合的TiC顆粒粉體,其中立方體顆粒大小約60~140 nm,棒狀的寬度約30~185 nm,平均顆粒尺寸為35 nm,其形貌如圖1所示。

圖1 立方形和棒狀的TiC顆粒[22]Fig.1 TiC particles in cubic and rods[22]
此外,鈦源的種類、粒度也對合成TiC的形貌有影響,且鈦源種類致使合成機理也不盡相同。Gotoh等[23]以TiO2溶膠(粒徑<5 nm)、甲基纖維素(MC)為原料,于1 300 ℃保溫2 h發(fā)生碳熱還原反應生成TiC粉體。合成過程中,MC首先分解為C,隨后C與TiO2于1 050 ℃反應生成TiCxOy,最后TiCxOy被還原為TiC。合成溫度較傳統(tǒng)碳熱還原法(1 550 ℃)顯著降低,氧含量更低,但合成產(chǎn)物中有碳殘余。當采用高爐鈦渣為鈦源時,具有成本低的優(yōu)點,且工業(yè)廢渣回收利用有助于環(huán)境保護。以含鈦高爐渣和碳粉(渣與碳粉質量比100/38)為原料,采用真空碳熱還原-酸浸聯(lián)合工藝,在1 400 ℃、真空度為1 Pa條件下保溫2~3 h合成出了TiCx(x=0.957)粉體[24-25],合成過程中,原料之間首先反應生成CaTiO3,CaTiO3相直接被還原轉化為TiC,沒有中間產(chǎn)物出現(xiàn),但產(chǎn)品中含有較多的雜質元素,并含有一定的氧化物。

圖2 TiC粉體的顯微結構[26]Fig.2 Microstructure of TiC powder[26]
合成工藝也對TiC粉體合成有重要影響,若在真空中合成TiC粉體,同樣以納米TiO2粉和炭黑為原料,合成溫度可降至1 300 ℃,TiC粒徑為200 nm左右,且合成時間較短(1 h)、產(chǎn)品純度較高,但會出現(xiàn)一定團聚現(xiàn)象,如圖2所示[26]。若采用微波加熱,可進一步降低合成溫度或縮短反應時間。以納米TiO2和炭黑為原料,采用微波加熱方法在1 100~1 200 ℃、Ar氣氛下可合成納米級TiC粉體(粒徑35~70 nm),TiC顆粒分散較為均勻,僅有輕微團聚現(xiàn)象,且合成的TiC純度高[27-29]。Zhang等[30]以鈦酸四丁酯、C2H5OH、冰醋酸和乙酰丙酮等為原料制備了TiO2溶膠,以蔗糖為碳源,采用微波加熱法在1 200 ℃、Ar氣氛下還原2 h后制備出了超細TiC粉體(粒徑0.1~0.5 μm)。在較低溫度下(980 ℃)合成時,碳含量對TiC超細粉體制備有顯著的影響,TiO2/C摩爾比從1 ∶3增加到1 ∶6時,TiC產(chǎn)量從83%增加到93%;當TiO2/C摩爾比為1 ∶3時,在1 200~1 300 ℃加熱后TiC純度提高,晶格參數(shù)隨加熱溫度的升高而增大,1 300 ℃時達到最大值0.430 2 nm(晶格參數(shù)的這種變化,可能是由于碳化鈦的納米晶體性質,以及碳化鈦納米粉體的非化學計量組成)。這種用溶膠-凝膠結合微波碳熱的合成工藝與傳統(tǒng)碳熱還原工藝相比,可以在較低溫度(1 200 ℃)和較短時間(2 h)下合成TiC粉體,TiC晶粒細小。但是合成出的TiC顆粒尺寸不均勻,在產(chǎn)物中檢測到O和Si雜質元素,粉體出現(xiàn)明顯的團聚現(xiàn)象。
碳熱還原法是典型的固相反應,需要較高的溫度和較長的反應時間,所合成的TiC在高溫下還可能被再氧化,難以獲得高純的TiC,且粉體易團聚。
1.2 金屬熱還原法
金屬熱還原法是利用Mg、Ca、Na等活潑金屬的強還原性將TiO2還原從而合成TiC粉體。此方法合成溫度低(一般為800~900 ℃)、能耗較低,但活潑金屬成本高、工藝復雜,合成的產(chǎn)物含有殘余的金屬和金屬氧化物,需用酸洗去除金屬氧化物。
金屬還原劑中最常用的為Mg,采用Mg作為還原劑時,通常有副產(chǎn)物MgO、MgCl2等,需要借助真空分離法或其他方法除去殘留產(chǎn)物,且合成產(chǎn)物多為塊狀,還需破碎才能形成粉體,工藝復雜,耗時長。Dyjak等[31]以Mg粉、六氯乙烷粉體C2Cl6和液體TiCl4為原料,采用熱電點火燃燒工藝,在氬氣中制備出了亞微米級別的球狀TiC,其平均顆粒尺寸約90 nm。此外,本方法新穎之處在于用一種簡單的鈣熔方法除殘余碳:在865 ℃下碳與熔融的鈣反應,將游離碳轉化為電石,然后用鹽酸萃取電石,去除游離碳。其合成的TiC粉體具有高純度、不團聚、具有亞微米級尺度等優(yōu)點。Lee等[32]通過鎂還原TiCl4和CCl4釋放出Ti和C原子,Ti和C進一步反應生成細小海綿塊狀的TiC顆粒,該塊狀顆粒易于破碎,破碎后形成粉體。反應方程式為:
TiCl4(g)+2Mg(l)=Ti(s)+2MgCl2(l)
(2)
CCl4(g)+2Mg(l)=C(s)+2MgCl2(l)
(3)
TiCl4(g)+CCl4(g)+4Mg(l)=TiC(s)+4MgCl2(l)
(4)
Ma等[33]也采用金屬Mg粉作為還原劑,以TiO2和堿式碳酸鎂((MgCO3)4·Mg(OH)2·5H2O)為原料,在高壓釜中Ar氣氛下于550 ℃并保溫10 h合成了平均粒徑約30 nm的納米TiC,其反應式為:
(MgCO3)4·Mg(OH)2·5H2O+4TiO2+22Mg→4TiC+27MgO+6H2
(5)
不同原料及金屬種類的使用致使合成過程中發(fā)生的反應及所需的溫度不盡相同。Bavbande等[34]用鈣熱還原法,將TiO2、Ca和C粉體混合物在純氬氣中于950 ℃下反應2 h原位合成了TiC。首先TiO2與Ca還原形成Ti金屬粉體,Ti金屬粉體與碳原位反應生成TiC,再用冷水和稀鹽酸溶液各洗滌兩次,除去殘余的鈣和氧化鈣后得到產(chǎn)物TiC粉體。其反應方程式如下:
TiO2(s)+2Ca(l)=Ti(s)+2CaO(s)
(6)
除Mg、Ca之外,金屬Na在合成TiC時也常用來作為還原劑。Lu等[35]用固態(tài)金屬Na還原液態(tài)的TiCl4和CCl4制備了粒徑為10~20 nm的TiC,反應如下:
TiCl4(l)+CCl4(l)+8Na(s)=TiC(s)+8NaCl(s)
(7)
將還原劑和原料放入高壓反應釜中,利用高壓釜中試劑蒸發(fā)產(chǎn)生的高壓和合成反應過程中的高熱放熱能,在450 ℃下保溫8 h后得到了產(chǎn)物樣品,對樣品進行4次酸洗、水洗后,在真空中70 ℃下干燥4 h得到了TiC粉體。
采用金屬熱還原合成TiC不需要復雜的實驗設備,但合成后常常有金屬還原劑殘留或金屬還原劑的副產(chǎn)物出現(xiàn),因此在合成后需要對產(chǎn)物進行多次處理,如:借助超聲波清洗機,或用稀鹽酸水溶液清洗產(chǎn)物,再經(jīng)過離心凈化后得到純凈的TiC。整個過程相較于傳統(tǒng)碳熱還原法比較復雜,且產(chǎn)物的純度難以保證。
2 熔鹽輔助合成法
熔鹽輔助合成法,是用一種或幾種低熔點的金屬鹽類作為反應介質,溫度控制在金屬鹽熔點以上,反應物置于熔融的鹽中來合成材料的一種方法,該方法包括熔鹽輔助碳熱還原法、熔鹽輔助電解法等。反應結束后待熔鹽冷卻,再用合適的溶劑將鹽類溶解,過濾后得到產(chǎn)物。在熔鹽輔助合成TiC粉體的過程中常用的鈦源為TiO2粉、鈦粉和K2TiF6等,常用的熔鹽為堿金屬氯化物,如:NaCl、LiCl、KCl或其中的2~3種作為混合熔鹽。各熔鹽的熔點不同,因此加入不同熔鹽會直接影響合成溫度。此外,不同熔鹽所含的離子會對原料的分散、遷移產(chǎn)生不同的影響,進而影響到產(chǎn)物的顆粒尺寸。
在熔鹽輔助碳熱還原合成法制備TiC中,常以石墨、炭黑、乙炔黑、多壁碳納米管以及石墨烯等為碳源。采用不同碳源可合成TiC納米線、納米片、八面體TiC、棱柱狀TiC等,碳源的種類及粒徑對合成的TiC的顯微結構及形貌影響顯著。Song等[36]以TiO2、炭黑和為原料,利用熔鹽法(NaCl熔鹽)在TiO2和炭黑不同摩爾比的情況下,保溫3 h合成了八面體(顆粒尺寸約3 μm)和頭部為四面體的棱柱狀TiC顆粒。當TiO2與C的摩爾比小于1 ∶3時才能合成出符合化學計量比的TiC粉體。而Yang等[37]以乙炔黑和MWCNTs(多壁碳納米管)以及石墨烯為碳源時,在800~900 ℃的NaCl-KCl熔鹽中原位合成了粒徑約50 nm的TiC粉體。溫度越高、反應時間越長對TiC的合成越有利。在750 ℃時已經(jīng)有大量的TiC形成,但仍有一些Ti的氧化產(chǎn)物出現(xiàn),如Ti6O、TiO2和TiOCl2;當溫度升高至800 ℃并保溫2 h獲得了純凈的TiC粉體。生成的TiC單個粒子由于范得瓦爾斯力和靜電力會有輕微的團聚現(xiàn)象出現(xiàn),有些TiC粒子團聚成納米棒和納米片,TiC的TEM照片如圖3所示。

圖3 TiC的TEM照片[37]Fig.3 TEM images of TiC[37]
采用熔鹽輔助電解法合成TiC時,首先將鈦源和碳源混合均勻后制備成陰極,將陰極和陽極放入提前預電解制備成的熔鹽介質中,含鈦物質被電解為Ti,然后Ti與C反應生成TiC。此方法合成的TiC顆粒細小(微米尺度)、產(chǎn)物純凈,但是在制備過程中工藝復雜、耗時長,產(chǎn)物陰極孔內會有殘余鹽,須經(jīng)過酸洗處理后才可得到純凈的TiC。崔富暉等[38]在CaCl2熔鹽中于850 ℃下電解5~7 h合成了粒徑為5 μm左右的TiC粉體。首先將炭黑和NaTiO3混合,在4 MPa下壓片,并在氬氣保護下于400 ℃低溫制備出陰極片,然后在CaCl2熔鹽中通過3.1 V恒壓電解后得到TiC。通過添加NaOH和鈦酸鈉來改變合成工藝,隨著鈦酸鈉添加量的增加,陰極產(chǎn)物轉化速率提高、完全電解時間縮短。Zhang等[39]同樣以熔融CaCl2為熔鹽,但其采用TiO2作為鈦源,將原料制備成TiO2/C復合陰極后在900 ℃下電解6 h合成含氧的TiC復合粉體(TiCxOy,x=0.5、y=0.5),該粉體顆粒尺寸均勻,沒有明顯的團聚現(xiàn)象,但粉體中氧含量較高。Yan等[40]以CaCl2-NaCl為混合熔鹽,以純度>99.5%(質量分數(shù),下文出現(xiàn)純度約為質量分數(shù))的TiO2和石墨為原料,將TiO2/C摩爾比為1 ∶1的反應原料制成反應陰極,并以石墨棒為陽極,在850 ℃下電解4 h合成了多孔TiC納米顆粒,平均粒徑為20 μm。Cao等[41]以NaCl-KCl為混合熔鹽、以金剛石納米顆粒、K2TiF6為反應原料,在900 ℃下合成了粒徑約為10 nm的球狀TiC顆粒粉體,此外,作者還將制備出的體積分數(shù)為2.5%的TiC納米顆粒加入Al金屬基體中,該復合材料的顯微硬度為原來的2.5倍,其原因是TiC顆粒彌散在Al金屬基體中,高溫下阻礙金屬的位錯運動和再結晶過程,起到細化基體組織作用,從而提高基體的顯微硬度。用此方法制備出的TiC粒徑小(<10 nm),并且可以實現(xiàn)大規(guī)模制備,實驗的重現(xiàn)性很好,為大規(guī)模合成小尺寸的TiC粉體提供了思路。但由于采用金剛石納米顆粒,制備成本高,粉體會發(fā)生輕微團聚,耗時較長。
熔鹽輔助合成法與碳熱還原法相比,合成溫度從1 500 ℃降到了1 000 ℃以下,節(jié)約了能源,且實驗成本較低,得到TiC粉體通常不會發(fā)生團聚現(xiàn)象,但是合成過程中步驟較多,熔鹽輔助電解法不僅需要制備陰極還需要對熔鹽進行預電解,且反應后往往有熔鹽殘留,需要對陰極產(chǎn)物進行清洗、干燥后才可得到TiC粉體。
3 機械合金化法
機械合金化法是在高能球磨條件下,將兩種或兩種以上金屬粉體或非金屬粉體充分球磨混合,利用粉體混合物的反復變形、斷裂、焊合、原子間相互擴散或發(fā)生固態(tài)反應來合成新的粉體,在此過程中原料產(chǎn)生嚴重的晶格畸變或產(chǎn)生大量缺陷從而使反應易于進行。該方法包括傳統(tǒng)機械合金化法(MA)和機械誘導自蔓延反應法(MSR),兩者合成TiC的機理不同,合成時間也有較大差異。在合成時常使用金屬Ti粉與碳粉直接反應來合成TiC。
MA反應中,Ti和C粉體球磨時,C向Ti擴散,這種擴散所需的能量是由球磨過程和材料細度引起的擴散路徑縮短而形成[42]。晶體向非晶轉變的機制是擴散控制機制,球磨時間越長,合成的TiC晶粒就越小,并且顆粒越均勻;此外,原料的粒度及純度對于合成時間的影響顯著。Razavi等[43]在探討以廉價鈦原料制備TiC的可能性時,以小于50目(355 μm)的工業(yè)鈦(含有質量分數(shù)為0.32%的Al、0.37%的Si和0.41%的V等雜質)和非晶態(tài)炭黑(粒徑<58 μm)為原料,采用行星式球磨機球磨15 h合成了納米TiC粉體。球磨9 h以內原料之間不發(fā)生反應,當球磨時間延長至15 h可獲得晶粒尺寸25.68 nm的TiC,隨球磨時間的進一步延長,當球磨20 h可獲得晶粒尺寸更小(20.69 nm)的TiC。
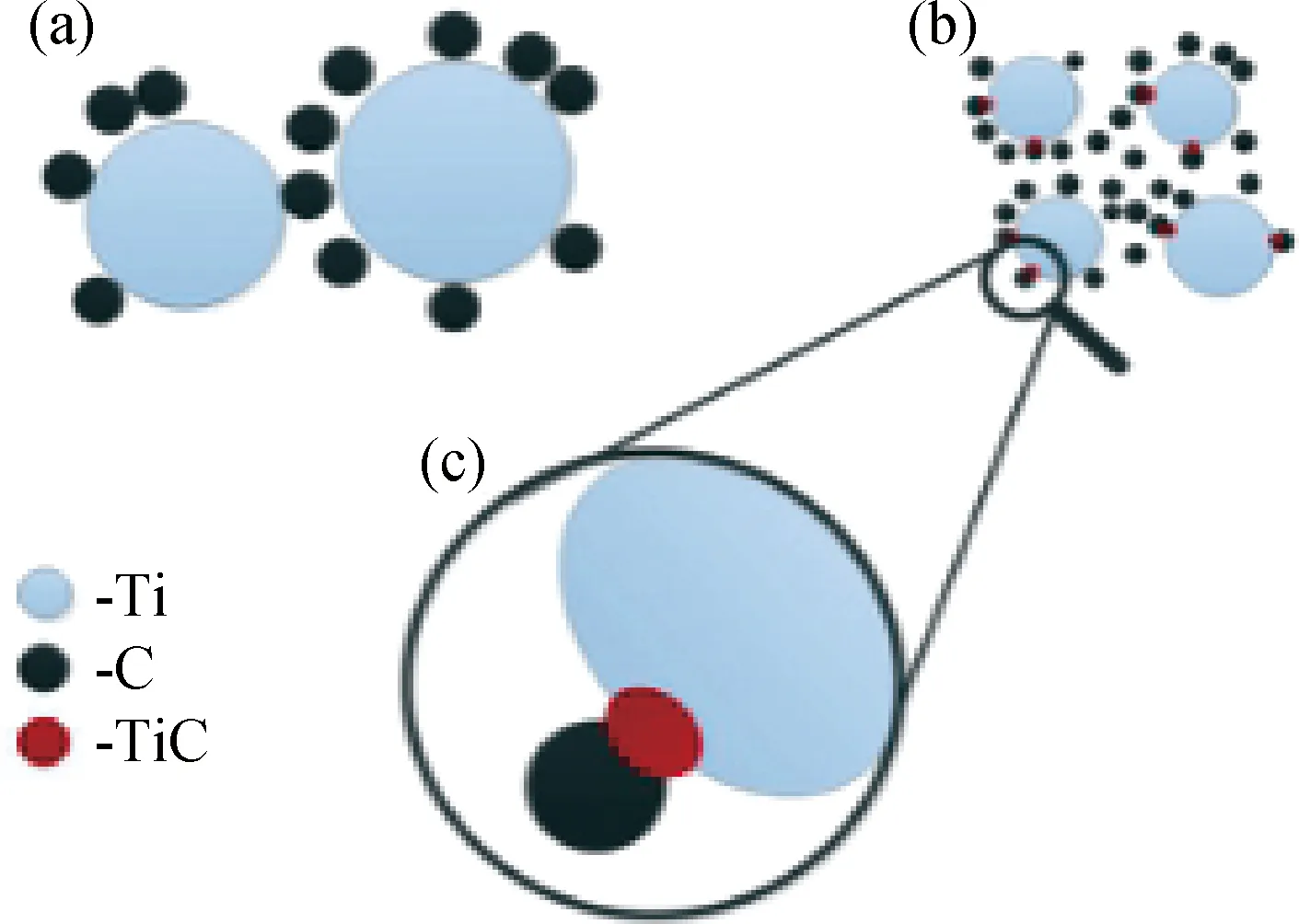
圖4 鈦和石墨球磨過程中在界面處形成納米TiC晶體的示意圖(a)球磨早期;(b)增加球磨次數(shù)后,溫度在點火點之前;(c)更高放大倍數(shù)的界面[46]Fig.4 Schematic diagram of formation of nano-TiCcrystals at the interfaces during the millingof titanium and graphite powders (a) early;(b) increase milling times, before the ignition point;(c) higher magnification of the interface[46]
MSR也是合成TiC的常用方法,在制備TiC的過程中,Ti與C首先在高能球磨下借助機械力放出大量的熱量誘發(fā)反應的發(fā)生,引發(fā)該反應后則按自蔓延模式不斷反應直到反應完全[44]。Lohse等[45]利用高能球磨誘導自蔓延反應在高純He氣氛下球磨Ti粉(粒徑<250 μm)和活性炭粉(粒徑<150 μm)合成了納米級TiC粉體(晶粒尺寸約為33 nm)。鈦、碳混合粉體的初始比例對球磨過程中形成TiC的反應動力學有一定的影響:Ti50C50粉末混合物在球磨70 h時溫度突然升高,達到點火溫度點;而Ti60C40的點火時間約為40 h;球磨Ti70C30時未出現(xiàn)溫度突然升高現(xiàn)象,隨著球磨的進行,TiC逐漸形成,產(chǎn)物由TiC與未反應鈦組成。Oghenevweta等[46]在探究MSR合成TiC機理時,以鈦(純度99.9%,粒徑<250 μm)和石墨(純度99.9%,粒徑<20 μm)為原料,合成了非化學計量的TiC(合成過程見圖4)。溫度在點火溫度之前,Ti粉和石墨由于球磨產(chǎn)生強烈塑性變形使顯微結構發(fā)生變化,石墨由薄層狀變?yōu)榍驙睿⒀刈冃蔚拟侇w粒界面排列;當溫度到達點火溫度后,Ti局部熔化,并與C發(fā)生反應生成了TiC。
在MSR合成法中,原料的顆粒尺寸、純度以及球磨時間是影響合成時間及產(chǎn)物尺寸的主要因素。朱心昆等[47]用Ti粉(粒徑<74 μm、純度>99%)和C粉(粒徑<74 μm、純度>99%)為原料,球磨75 min合成了納米級TiC晶粒(平均粒徑約為4 μm),當球磨時間延長至120 min時,可合成粒徑為18 nm的TiC粉體。而Yang等[48]以高純細鈦粉(粒徑為25 μm,純度99.5%)及更細的合成石墨粉(粒徑為10.2 μm,純度99.9%)為原料,球磨至30 min時,獲得粒徑為5.61 μm的TiC,延長球磨時間至210 min時,TiC形成粒徑為2.75 μm的聚集態(tài)。而用大粒徑純鈦(粒徑為75 μm,純度99.5%)和石墨(粒徑為50 μm,純度99.5%)作為起始原料時,球磨6 h后得到平均粒徑13 nm的TiC[49],所合成的TiC顆粒結晶良好,但粉體含有雜質。
機械合金化是合成TiC的一種常用方法,這種方法工藝簡單,可以實現(xiàn)快速、大規(guī)模制備TiC粉體,節(jié)省大量的資金開支,合成的TiC顆粒具有高度結晶相。但研磨過程中易出現(xiàn)雜質、污染、氧化和應力(應力會導致晶格參數(shù)偏離標準范圍以及不精確化學計量組分出現(xiàn))。本方法顯示了高速水平旋轉球磨在制備細小均勻陶瓷粉體方面的巨大潛力。
4 其他合成方法
4.1 高溫誘導自蔓延合成法
近年來,自蔓延高溫合成技術(SHS)在制備金屬間化合物、碳化物、硼化物、硅化物和氮化物等先進高溫材料方面得到了廣泛的應用[50]。自蔓延反應合成TiC的過程中,反應物體系首先借助外部能量誘發(fā)反應開始,反應開始后便會形成前沿燃燒波,依靠反應放出的熱量繼續(xù)維持反應進行,燃燒波會一直向未反應區(qū)域推進,直至反應結束形成TiC粉體。
Mishra等[51]以鈦粉、非晶碳和鎳粉為原料,以聚乙烯醇(PVA)為粘合劑,將原料充分混合壓制成球后,于373~473 K的烘箱中進行干燥;以氬氣作為保護氣體,將壓制好的Ti和C混合物小球置于石墨坩堝中并點燃,大約30 s后可得到樣品。采用差熱分析技術分析得出混合物的點火溫度約為1 423 K。在自蔓延高溫合成中不同的功率下TiC的轉化率不同,研究發(fā)現(xiàn)80 V、80 A是最佳功率水平,在此功率下可合成大量TiC相。試驗中鎳的添加吸收了Ti和C反應過程中產(chǎn)生的熱量,并且在反應過程中,鎳不進入基體,也不與鈦形成任何金屬間化合物,它保持鎳金屬的狀態(tài)并分散在基體中有助于產(chǎn)品致密化。添加質量分數(shù)為9%的Ni生成的TiC形貌如圖5所示,該結構較為疏松且不均勻。
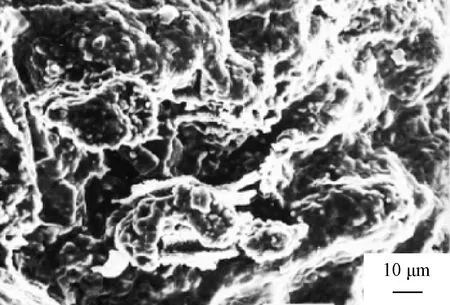
圖5 添加質量分數(shù)為9%的Ni生成的TiC顯微結構[51]Fig.5 Microstructure of TiC powders withmass fraction of 9% Ni [51]
陳怡元等[52]研究了高溫自蔓延反應合成TiC過程中碳源種類對TiC粉體微觀結構的影響。以活性炭、炭黑和石墨為碳源分別與Ti粉反應,活性炭最易與Ti粉反應,而石墨最難與之反應;用石墨合成的產(chǎn)物中非化學計量化合物最少,TiCx組成最接近化學計量比,且所制備的TiC晶型最完整。王金淑等[53]利用自蔓延反應技術研究了原料、稀釋劑對所合成的TiC粉體的影響。用兩種不同碳源作為實驗原料來制備TiC,規(guī)則的球形石墨合成的TiC呈規(guī)則的球狀,而不規(guī)則的活性炭合成的TiC為不規(guī)則粒狀。此外,稀釋劑可以吸收反應放出的一部分熱量,且可作為形核劑,對反應的順利進行起到促進作用。
與傳統(tǒng)方法相比,該技術具有固有的優(yōu)勢,其比傳統(tǒng)方法反應所需的溫度更低、時間更短,能耗也較低;但是由于反應一旦被“點燃”便不可停下,人為難以控制反應過程。
4.2 沖擊波合成法
沖擊波合成法是一種十分快捷的合成TiC粉體方法,這種方法一般借助炸藥爆炸瞬間產(chǎn)生的高溫高壓和沖擊波,使得顆粒產(chǎn)生大量結構缺陷,粒子表面被活化,從而引發(fā)Ti與C發(fā)生化學反應。
賈麗改等[54]用沖擊波法將粒度46 μm的鈦粉和石墨球磨均勻后裝入金屬包套中,然后將金屬包套埋入SB型乳化炸藥(使用玻璃微球發(fā)泡)中,采用軸對稱柱狀爆炸合成裝置點燃炸藥合成TiC粉體。合成機理為:在高溫高壓下,金屬Ti粉首先融化并包圍碳顆粒,形成預熱區(qū);之后片狀的石墨開始在金屬Ti相中熔解與擴散,并開始與Ti部分反應生成TiCx(x=0.47~1.0)顆粒,形成過渡區(qū)域;試件的中心區(qū)域為產(chǎn)物區(qū),此區(qū)域的溫度和壓力都很高,TiC的結晶程度提高,生成的TiC是球狀顆粒,粒徑大小不一。此外,賈麗改等[55]在用沖擊波法合成TiC時還研究了初始裝填密度、碳原料的種類及其加入量對合成TiC的影響。用金屬鈦粉(粒徑≤74 μm)分別與活性炭(粒徑≤45 μm)、炭黑(粒徑≤45 μm)和石墨(粒徑≤45 μm)反應,發(fā)現(xiàn)鈦粉與活性炭在炸藥轟擊后,Ti與C并未發(fā)生反應,樣品仍為黑色;鈦粉與石墨在沖擊波作用后樣品的中心部位變?yōu)榛野咨粗行牟课簧闪薚iC;鈦粉與炭黑反應后反應物全部變?yōu)榛野咨f明Ti粉最容易與炭黑發(fā)生反應生成TiC。在裝填密度相同的情況下,不同Ti和C配比對生成物TiC的影響不大,合成的產(chǎn)物都比較密實。尹政等[56]在制備TiC粉體時采用奧克托今(HMX)炸藥為TiO2和活性炭粉體的反應提供高溫、高壓條件,成功制備出了粒徑小于50 nm的TiC顆粒。首先用炸藥的爆炸沖擊波爆轟原料,之后將爆轟灰放入400 ℃的馬弗爐中進行煅燒,400 min后得到了銀灰色的TiC粉體。TiC粒徑分布均勻且顆粒細小,顆粒之間具有良好的分散性,但是在產(chǎn)物粉體中含有殘留的TiO2,產(chǎn)物的純度不高。
利用此法合成的TiC效率較高、綠色環(huán)保。但是粒徑的均勻性較差,由于沖擊波引發(fā)的化學反應速度快,反應物之間難以充分接觸與反應,容易導致反應不完全,難以實現(xiàn)批量制備TiC。此外,合成的TiC較密實,在后續(xù)應用時需進一步破碎、研磨才能得到較細的TiC粉體。
4.3 化學氣相沉積法
用化學氣相沉積法(CVD)合成TiC,是利用還原化合沉積等技術將氣體金屬鹵化物原料(主要是氯化物)制備成TiC。在采用化學氣相沉積法制備TiC過程中是利用氣態(tài)的TiCl4和甲烷(或其他碳氫化合物)在800~1 200 ℃下反應,從而析出固態(tài)TiC。
Ti(s)+CH4(g)=TiC(s)+2H2(g)
(8)
TiCl4(g)+2H2(g)+C(s)=TiC(s)+4HCl(l)
(9)
在研究化學氣相法合成TiC的動力學機制時,郭海明等[57]在氮氣中用TiCl4、CH4和 H2作為反應原料,制備了碳/碳復合材料的TiC防氧化涂層。研究得出TiCl4和CH4反應沉積TiC所需溫度T>1 060 K,且隨著溫度的升高反應平衡常數(shù)Kp迅速增大。在化學氣相沉積過程中TiC的沉積形態(tài)和沉積時的形核過程與過飽和度和動力學控制機制有很大的關系。除溫度的影響外,TiC的沉積速率還與氣體原料的進料速度與含量有關。王坤杰等[58]以TiCl4(體積分數(shù)99.99%)為鈦源,H2(體積分數(shù)99.99%)為載氣和反應氣體,Ar(體積分數(shù)99.99%)為保護和稀釋氣體,石墨(CG)為基體和碳源,利用化學氣相沉積法在標準大氣壓下合成了TiC。氣體的流速與TiCl4的轉化率以及TiCl4含量和沉積速率之間存在一定的關系:隨著氣體流速的減小,TiCl4的轉化率逐漸增加,當氣體流速小于7 cm·s-1后,TiCl4轉化率的變化比較平緩;隨著TiCl4含量的增加,沉積速率也明顯增加,當TiCl4含量大于8%后,沉積速率的變化比較緩慢。Cetinkaya等[59]以純度>99.7%,粒度<25 nm的TiO2為鈦源,CH4(體積分數(shù)99.5%)為碳源,利用化學氣相沉積法,在高純Ar(體積分數(shù)99.999%)環(huán)境下,于1 750~1 800 K下反應30 min合成了平均粒徑為125 nm的TiC粉體,產(chǎn)物較為純凈。合成過程中產(chǎn)物的顏色以及產(chǎn)物質量隨溫度的升高發(fā)生了變化:產(chǎn)物由900 K時的白色逐漸變?yōu)? 200 K時的深灰色,當溫度升到1 300 K時,質量分數(shù)迅速上升到26%。
該方法設備工藝相對復雜,并且反應過程中氣相的過飽和蒸氣壓難以確定,同時會生成某些有害副產(chǎn)物,但用此方法可以合成純度很高的TiC材料,也適合于表面改性用TiC涂層的制備[60]。
4.4 熱等離子體法
熱等離子體法(TPP)是采用處于單原子氣態(tài)的反應物來合成TiC。熱等離子體可為合成TiC提供較高的反應溫度,在該溫度下,所有反應物都處于單原子氣態(tài),更易形核;且反應后冷卻速度大,可抑制產(chǎn)物晶體的生長過程,從而有利于納米級別粉體的合成,因此是合成納米尺度粉體的較佳選擇。
Tong等[61]用純度較高的Ti粉與CH4為起始原料,將氬氣和甲烷氣體按固定的摩爾比混合,采用熱等離子體法合成了TiC粉體,粉體平均粒徑小于100 nm。當CH4與Ti的摩爾比接近1 ∶1時,可得到純凈的TiC粉體。于瀛秀等[62]通過熱等離子體法合成了具有優(yōu)異的電催化性能的TiC電極材料;以制成塊的鈦粉為陽極,用石墨棒作陰極,通入純凈的CH4和H2后起弧,使Ti粉氣化,合成了一層1 nm厚的碳包覆納米TiC結構粒子,這種粒子呈規(guī)則的六角形態(tài);用這種材料作為陰極來電解2,4-二氯酚達到了很好的電催化降解效果。
這種方法可采用廉價原料得到較高純度的TiC粉體,但原料間的摩爾比需精確控制。
4.5 聲化學法
聲化學法制備陶瓷是近幾年發(fā)展的一種新型的、綠色安全、省時省力、簡便快捷的合成方法。超聲波的頻率范圍約為15 kHz~1 GHz,高強度超聲波可以在很短的時間引入大量的能量,這種能量可增強質量的傳輸、乳化等作用。在高強度超聲輻照的液體中,聲空化(氣泡的形成、生長和潰滅)提供了聲化學效應的主要機制:空化過程中,氣泡潰滅產(chǎn)生強烈的局部加熱、高壓,這些瞬態(tài)、局部熱點驅動高能化學反應快速進行[63]。
Sivasankaran等[64]以TiO2和活性炭為實驗原料,以20 kHz的超聲能量在液氨中60 ℃反應1 h合成了TiC納米粉體,其顆粒形貌如圖6所示,TiC的平均顆粒尺寸為126.95 nm,納米粉體吸附量為731.78 m2·g-1,粉體粒徑差別較大,甚至有些團聚成簇。這種新型的合成方法最大的特點在于所需能量極高,但合成時間極短,雖能合成納米級別的TiC粉體,但由于反應時間較短,通常難以獲得粒徑分布均勻的產(chǎn)物。
除以上方法外,F(xiàn)eng等[65]提出來一種簡單的合成納米TiC的方法。其用TiCl4和CaC2粉體為原料合成了黑色的TiC粉體。反應式如下:
TiCl4+2CaC2=TiC+2CaCl2+3C
(10)

圖6 超聲化學法合成的TiC粉體顆粒[64]Fig.6 TiC particles synthesized by ultrasonic chemistry[64]
首先將原料放入不銹鋼高壓釜中并通入氮氣,之后將高壓釜加熱到500 ℃,并在該溫度下保溫8 h,待到爐內冷卻至室溫后將產(chǎn)物收集、過濾,用無水乙醇、熱氯酸、蒸餾水依次洗滌,最后在60 ℃真空下干燥后得到粒徑約40 nm的黑色TiC粉體。該方法合成TiC粉體所需的溫度低(500 ℃)、合成原料簡單、合成途徑簡便易控。
5 總結與展望
現(xiàn)代合成TiC粉體方法多樣、工藝成熟。至今,相關研究主要通過在合成時改變原料之間比例及助燒劑種類,借助碳熱還原機理和反應動力學機理,合理控制保溫時間、合成溫度及球磨時間等工藝參數(shù),制備出多種粒度不同、形貌有別、純度不同的TiC粉體。在多種方法中,碳熱還原法具有原料豐富、工藝簡單、成本低等優(yōu)點。除此之外,其他形態(tài)TiC的合成與制備也備受關注,如:TiC纖維、TiC涂層及TiC復合物等。多種形態(tài)、粒度和純度TiC的成功制備,也使其應用范圍十分廣泛。
在應用時,粒度細小、粒徑均勻、結晶度良好及化學計量比良好的TiC常被擇優(yōu)使用。目前常用的工業(yè)方法通常能夠制造平均尺寸為微米級的TiC粉體,而納米粉體TiC的制備卻備受限制。此外,目前所合成的TiC粉體還存在純度不易控制、易團聚等問題。針對目前TiC粉體制備工藝中存在的缺點,開發(fā)一種節(jié)能高效、純度和形貌可控的,可用于合成多種粉體材料的制備技術,應當成為當前研究熱點。
除了應用于復合陶瓷、刀具及耐高溫構件等傳統(tǒng)領域,TiC材料由于其較好的光譜吸收性能、高熔點、高導電率和高導熱率等獨特的性能,未來將在生物醫(yī)學、過濾材料及吸附材料等方面有新的應用研究。但合成出的TiC粉體的結構形貌、光學性能、抗氧化性能及力學性能等方面需進一步提高。因此,未來對于TiC粉體制備的研究方向應朝著控制粒徑、調控形貌、提高光學和力學性能以及控制團聚等方面努力。

