大孔樹脂純化縱條紋炭角菌中環肽Xylastriamide A工藝
任志洋,唐凡淋,袁小紅*
西南科技大學生命科學與工程學院(綿陽 621000)
縱條紋炭角菌(Xylaria striataPat. 1887)為子囊菌門(Ascomycota)炭角菌科(Xylariaceae)炭角菌屬(XylariaHill ex Schrank)真菌,生長范圍主要在腐朽樹皮和活樹根上[1]。前期對縱條紋炭角菌進行多年研究,包括縱條紋炭角菌子實體的培養[1]、液體培養優化[2-3]、子實體化學成分研究[4]及抗菌活性方案[5]、抗腫瘤活性[6]等,為縱條紋炭角菌的開發利用提供基礎。從炭角菌屬真菌的菌絲體中分離得到多種新穎的化合物,且證明其具有良好的生物活性[7]。環肽物質因其特殊的結構和構象關系[8]而具有較好的抗腫瘤、抗癌活性[9],其在新藥開發中得到了極大的重視。雷傳文[10]運用多種色譜技術從縱條紋炭角菌中分離得到一種新的環肽Xylastriamide A,其作為一種新穎的環肽類物質,發現具有顯著的抗腫瘤活性,并且對秀麗隱桿線蟲也有一定的抗蟲活性,表明該環肽有著極大的研究價值和應用前景。
該類化合物傳統的分離方法[11]是通過一系列的色譜技術進行純化,從而獲得單體物質,該法步驟多且效率低,會耗費大量的溶劑和時間,且固相吸附嚴重。為更好地對環肽Xylastriamide A進行研究開發,有必要改良該環肽的分離純化過程,從而為該環肽的進一步分析提供基礎保障。大孔吸附樹脂因其吸附效果好,操作簡便,可反復使用的特性,被廣泛運用于中藥材的有效成分富集及分離純化工藝中[12-13]。為很好地對環肽Xylastriamide A進行分離,試驗以縱條紋炭角菌為材料,采用不同型號、性能的樹脂對縱條紋炭角菌環肽進行吸附、解吸試驗,篩選出最適宜分離該環肽的樹脂,并對縱條紋炭角菌環肽分離純化條件進行優化,以達到對環肽富集的效果,為縱條紋炭角菌的開發利用奠定基礎。
1 材料與方法
1.1 材料與設備
1.1.1 材料與試劑
縱條紋炭角菌(2012年7月由賀新生教授采于西南科技大學楊樹樁,鑒定為炭角菌科炭角菌屬縱條紋炭角菌Xylaria striataPat. 1887)。
鹽酸(分析純);氫氧化鈉(分析純);無水乙醇(分析純);乙腈(色譜純);超純水。
根據環肽Xylastriamide A的極性,故選擇不同型號的大孔樹脂來進行后續研究。

表1 不同型號的大孔吸附樹脂參數
1.1.2 儀器與設備
XJ-2小型提取濃縮機組(天津大明制藥設備廠);高效液相色譜儀(Agilent Technologies 1260Infinity);色譜柱(Agilent ZORBAX Eclipse XDB-C18,4.6 mm×250 mm,5 μm);SHB-Ⅲ 循環水式多用真空泵;Rotavapor R-210旋轉蒸發儀。
1.2 方法
1.2.1 縱條紋炭角菌粗提液制備
取縱條紋炭角菌子實體,粉碎過孔徑0.425 mm篩,按料液比1︰5(g/mL)加入90%乙醇在70 ℃下浸提3次,每次2 h,合并濾液,旋轉蒸發濃縮至浸膏后,加入蒸餾水溶解,得到縱條紋炭角菌粗提液。
1.2.2 縱條紋炭角菌中環肽Xylastriamide A含量測定
采用HPLC法,準確稱取1 mg縱條紋炭角菌環肽Xylastriamide A標準品,用乙腈將其溶解,配成一系列的質量濃度梯度溶液。按照流動相采用乙腈-水(65︰35),流速1.0 mL/min,檢測波長216 nm,進樣量20 μL,柱溫35 ℃,等度洗脫的方式,在該條件下測定目標物峰面積,以峰面積(Y)和環肽質量濃度(X)作圖,得標準回歸曲線方程為Y=32.789X+2.198 6(R2=0.999 6),線性關系良好。
1.2.3 大孔樹脂預處理[14]
將新購買的大孔樹脂(H103、HP20、D101、AB-8)用無水乙醇浸泡過夜,使其充分溶脹,再濕法裝柱,用乙醇洗至流出液不渾濁為止,用蒸餾水沖洗至無醇味。依次酸洗,用2 BV的5%鹽酸溶液浸泡4 h,用蒸餾水洗至中性;堿洗,用2 BV的2%氫氧化鈉溶液浸泡4 h,用蒸餾水洗至中性。備用。
1.2.4 大孔樹脂篩選
分別取預處理好的不同類型的大孔樹脂(AB-8、D101、HP20、H103)適量,用濾紙吸干水分后,各自稱取1 g于100 mL錐形瓶中,加入20 mL的縱條紋炭角菌粗提物,置于搖床中(25 ℃,120 r/min)靜態吸附24 h。各自取一定量上清液測定環肽Xylastriamide A濃度,按式(1)計算出各樹脂對該環肽的吸附率。將大孔樹脂取出,用濾紙吸干表面提取液,加入100%乙醇20 mL進行靜態解析,解吸液經HPLC測定環肽含量并按式(2)計算各樹脂對該環肽的解析率。
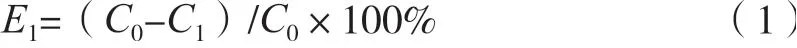
式中:E1為樹脂的吸附率,%;C0為吸附液中環肽的初始質量濃度,mg/mL;C1為吸附后剩余的環肽質量濃度,mg/mL。
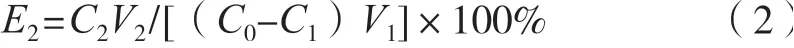
式中:E2為樹脂解吸率,%,C0為吸附液中環肽初始質量濃度,mg/mL;C1為吸附后剩余環肽質量濃度,mg/mL;C2為解吸液中環肽質量濃度,mg/mL;V1為吸附液體積,mL;V2為解吸液體積,mL。
1.2.5 大孔樹脂靜態吸附研究
取處理好的D101樹脂,用濾紙吸干水分,稱取1 g于100 mL錐形瓶中,加入20 mL的縱條紋炭角菌提取液,置于搖床中(25 ℃,120 r/min)靜態吸附24 h,并分別在1,2,3,4,6,8和12 h取樣進行HPLC檢測,測定環肽Xylastriamide A含量,按式(3)測量吸附量,作吸附量-時間圖。
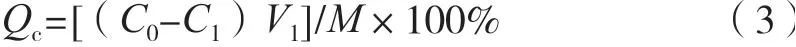
式中:Qc為樹脂的吸附量,mg/g;C0為吸附液中環肽的初始質量濃度,mg/mL;C1為吸附后剩余的環肽質量濃度,mg/mL;V1為吸附液體積,mL;M為樹脂質量,g。
1.2.6 大孔樹脂對該環肽的動態吸附條件優化[15]
1.2.6.1 不同上樣流速對大孔樹脂吸附效果的影響
取100 mL質量濃度3 mg/mL的縱條紋炭角菌提取液,改變上樣流速進行動態吸附,柱體積(BV)為30mL,分別以1,2,3,4和5 BV/h的流速上柱吸附,收集流出液,計算吸附率。作吸附率-流速圖。
1.2.6.2 不同上樣濃度對大孔樹脂吸附效果的影響
取4份3 mL質量濃度100 mg/mL的縱條紋炭角菌提取液,分別加入297,97,57和39.8 mL用水制成1,3,5和7 mg/mL的混懸液,柱體積(BV)30 mL,流速2 BV/h,以不同質量濃度上柱吸附,收集流出液,計算吸附率。作吸附率-質量濃度圖。
1.2.6.3 不同上樣量對大孔樹脂吸附效果的影響
取質量濃度3 mg/mL的縱條紋炭角菌提取液,以2 BV/h的吸附流速上柱,每處理1 BV樣液(1 BV=30 mL)的流出液單獨收集,測定流出液中的環肽Xylastriamide A濃度。流出液中該環肽質量濃度達到上樣液質量濃度的10%時,確定樹脂的吸附已達到飽和[16]。作流出液質量濃度-流出液體積圖。
1.2.7 大孔樹脂對該環肽的動態解吸條件優化
1.2.7.1 不同體積分數乙醇對大孔樹脂解吸條件的影響
取質量濃度3 mg/mL的縱條紋炭角菌提取液7 BV(5份),分別以2 BV/h上柱吸附,收集流出液,計算吸附量,用3 BV的40%乙醇解吸,測定流出液中環肽Xylastriamide A含量,分別用60%,70%,80%,90%和100%乙醇溶液進行解吸,解吸流速為2 BV/h,收集解吸液,測定環肽Xylastriamide A濃度,計算解析率,比較不同體積分數解吸劑對大孔樹脂解吸效果的影響。
1.2.7.2 洗脫劑量對大孔樹脂解吸條件的影響
取質量濃度3 mg/mL的縱條紋炭角菌提取液7 BV,以2 BV/h上柱吸附,收集流出液,計算吸附量,用3 BV的40%乙醇洗去雜質,用100%乙醇溶液進行洗脫,每1 BV單獨收集,測定環肽Xylastriamide A濃度。作流出液質量濃度-洗脫液量體積圖。
1.2.8 純化工藝驗證
取質量濃度3 mg/mL的縱條紋炭角菌提取液7 BV,以2 BV/h上柱吸附,收集流出液,計算吸附量,用3BV的40%乙醇洗去雜質,用3 BV的100%乙醇溶液進行解吸。平行操作3次,按最佳工藝條件,通過HPLC分析大孔樹脂處理前后環肽Xylastriamide A占比。
2 結果與分析
2.1 大孔樹脂的篩選
由表2可以看出,4種大孔吸附樹脂對縱條紋炭角菌中環肽的吸附和解吸效果不同。在這4種大孔樹脂中,HP20、D101、AB-8均對縱條紋炭角菌中環肽有著較好的吸附率和解析率,但D101的吸附率最大,解析率適中,且D101更加適合工業生產使用,因此,綜合考慮,選用D101作為純化縱條紋炭角菌中環肽的最佳樹脂。

表2 不同型號的大孔吸附樹脂篩選
2.2 大孔樹脂靜態吸附動力學曲線
由圖1可以看出,D101大孔樹脂在0~4 h之間,吸附量隨著時間延長呈現急劇增加趨勢,為快速吸附階段;在4~6 h之間,吸附量增加不明顯,為慢速吸附階段;6 h以后,吸附量的變化不大,樹脂的吸附已經接近飽和。故在實際應用中,綜合考慮生產周期、效率等因素,上柱液靜態吸附最佳時間為6 h。
2.3 大孔樹脂對該環肽的動態吸附條件優化
2.3.1 不同上樣流速對大孔樹脂吸附效果的影響
由圖2可知,隨著上樣流速增加,環肽的吸附率不斷降低。可能是上樣流速較慢時,該環肽在柱中下降的速度較慢,有利于該環肽在樹脂內的擴散,讓樹脂與該環肽得以更加充分的接觸和吸附,上樣流速變快時,上樣液中的環肽成分未能充分的擴散到樹脂內就被沖出柱外,使樹脂對環肽的吸附率降低。對照圖2,1和2 BV/h時均有較大的吸附率,綜合時間考慮,選擇2 BV/h為最佳上樣流速。
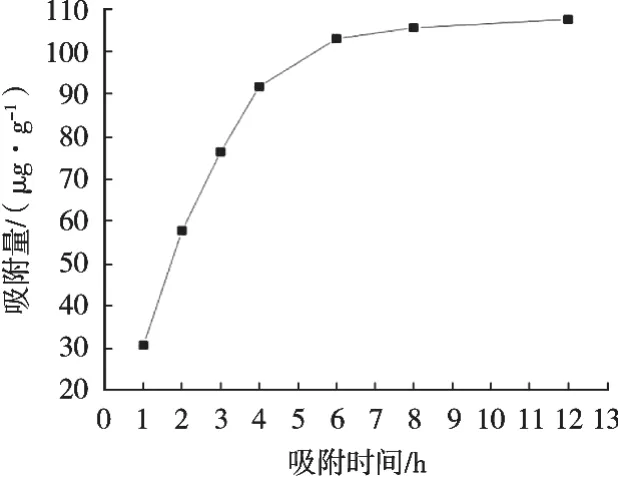
圖1 大孔吸附樹脂靜態吸附動力學曲線
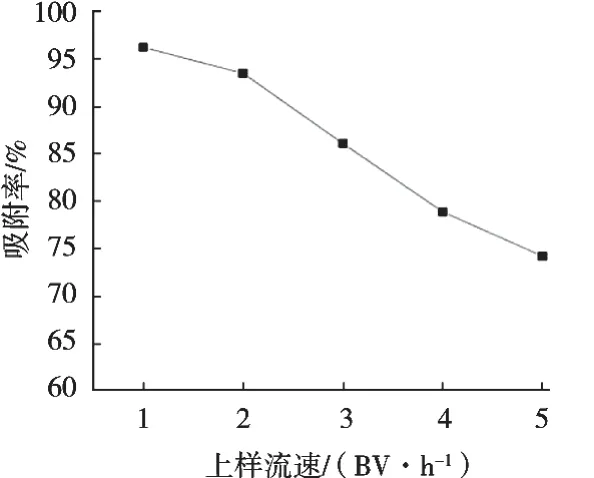
圖2 上樣流速對D101大孔樹脂吸附效果的影響
2.3.2 不同上樣質量濃度對大孔樹脂吸附效果的影響
由圖3可知,D101樹脂吸附率隨著上樣液質量濃度增加而降低,1 mg/mL時對應的吸附率最大,這也符合低質量濃度有利于吸附的原則。隨著上樣質量濃度增加,吸附率下降程度逐漸增大,可能是上樣質量濃度大時,環肽對于大孔樹脂的吸附存在競爭,同時上樣質量濃度過大會導致大孔樹脂柱堵塞,影響使用。1和3 mg/mL的吸附率相差不大,綜合時間、效率考慮,選擇3 mg/mL為最佳上樣質量濃度。
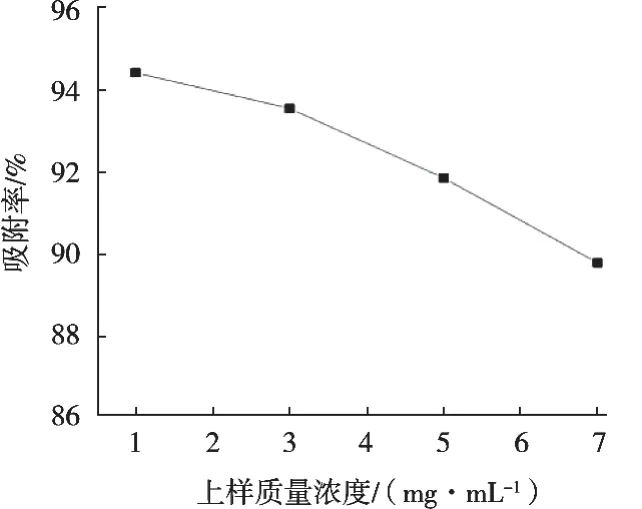
圖3 上樣質量濃度對大孔樹脂吸附效果的影響
2.3.3 不同上樣量對大孔樹脂吸附效果的影響
由圖4結果可以看出,隨著上樣量增加,流出液中環肽質量濃度不斷增加,根據泄漏點的定義,上樣量7 BV時,此時的流出液中環肽質量濃度達到上樣液中環肽質量濃度的10%,繼續增加上樣量,會使流出液環肽質量濃度繼續增加。因此,優選最佳上樣量為7 BV。
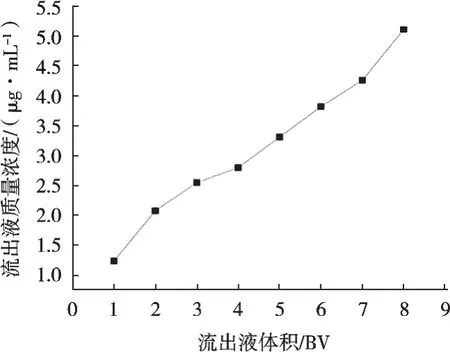
圖4 上樣量對大孔樹脂吸附效果的影響
2.4 大孔樹脂對該環肽的動態解吸條件優化
2.4.1 不同體積分數乙醇對大孔樹脂解吸條件的影響
由圖5可知,體積分數40%的乙醇進行洗脫時,流出液中檢測不到環肽,說明40%乙醇不能使目標物洗脫,即可以用來除去雜質;乙醇體積分數60%時,環肽開始有少量泄露;隨著乙醇體積分數增大,解吸率也隨之提高,乙醇體積分數100%時,解吸率最高。因此,優選100%乙醇作為洗脫液。
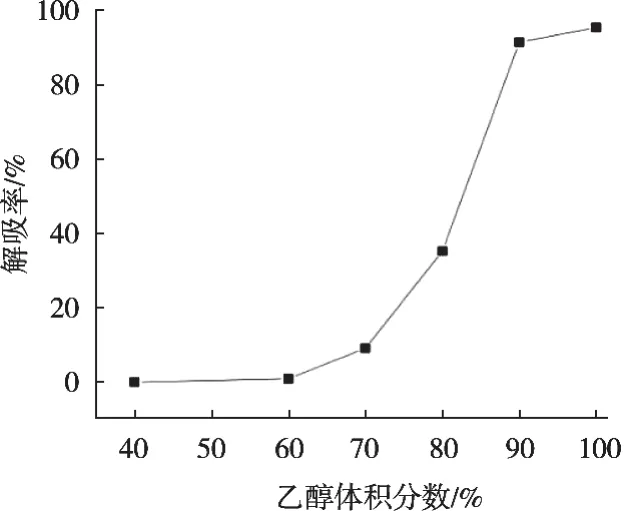
圖5 乙醇體積分數對大孔樹脂解吸條件的影響
2.4.2 洗脫劑量對大孔樹脂解吸條件的影響
由圖6可知,洗脫液中環肽含量隨洗脫液增加而呈現先上升后下降趨勢,洗脫量達到3 BV時,流出液中環肽含量較低,此時環肽基本被洗脫,因此最佳洗脫劑量為3 BV。
2.5 純化工藝驗證
結果見表3,可以得出,縱條紋炭角菌粗提物中Xylastriamide A純度為4.13%,經過大孔樹脂純化后,該環肽含量平均純度為39.63%,純化后該環肽純度有極大提高,說明D101對縱條紋炭角菌中的環肽Xylastriamide A純化效果良好。
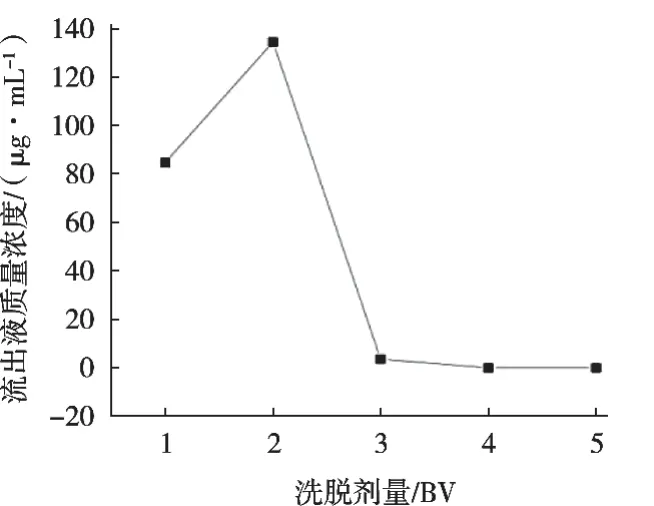
圖6 洗脫劑量對大孔樹脂解吸條件的影響
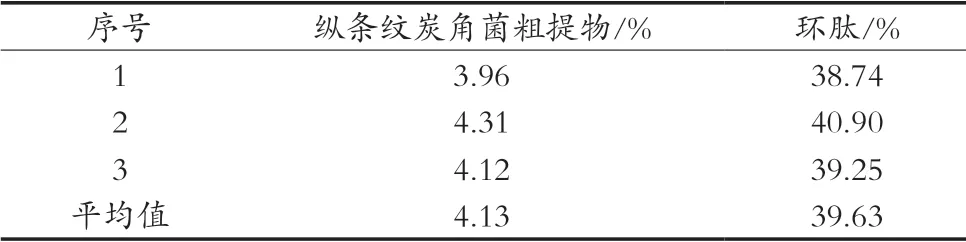
表3 Xylastriamide A在大孔樹脂中純化前后對比
3 結論與討論
通過比較4種大孔吸附樹脂(H101、HP20、D101、AB-8)對縱條紋炭角菌中環肽Xylastriamide A的吸附-解析效果影響,同時對D101大孔樹脂的靜態吸附及靜態動力學進行研究,結果表明,D101大孔樹脂對縱條紋炭角菌中環肽Xylastriamide A具有較好的吸附-解吸作用,且綜合成本考慮,選用D101大孔吸附樹脂來分離純化縱條紋炭角菌中環肽。
D101大孔樹脂對縱條紋炭角菌中環肽動態吸附-解吸的最佳工藝條件為上樣液質量濃度3 mg/mL,上樣流速2 BV/h,上樣量7 BV;解吸時用40%乙醇3 BV洗去雜質,用100%乙醇3 BV解吸,解吸流速2 BV/h。
D101大孔樹脂經過多次的吸附-解吸試驗,其依然具有良好的吸附效果,說明D101大孔樹脂具有較好的重復利用性,且樹脂預處理簡單,成本低廉,安全無害,適合工業生產或者大規模利用。采取該工藝分離縱條紋炭角菌中環肽Xylastriamide A可以減少環肽損失,提高環肽純度,也為用D101樹脂來分離純化其他類型的環肽研究奠定基礎,提供一定參考價值。

