健脾滲濕方對尿酸酶基因缺失高尿酸血癥模式動物腎損傷及腸道微生態干預的研究*
殷 娜,李小絲,劉維超,祁 燕,李兆福,段為鋼,彭江云,萬春平
(云南中醫藥大學,云南 昆明 650500)
痛風(Gout)是一種嘌呤代謝紊亂所致的疾病。臨床流行病學提示,我國高尿酸血癥的患病率急劇攀升,成為僅次于糖尿病的第2大代謝性疾病[1]。痛風危害最大的是腎臟損害和骨質破壞。慢性尿酸性腎病,即痛風性腎病,是指在長期高尿酸血癥狀態下,尿酸鹽晶體沉積于腎組織導致腎臟病變[2]。痛風患者大多都有不同程度的腎功能受損。痛風性腎病,多隱匿發病,早期癥狀不典型,進展緩慢,不易引起重視,一旦出現明顯癥狀已到腎損害期,甚至發展到腎衰竭期導致死亡[3]。因此,治療和控制高尿酸血癥及痛風性腎病已經成為一個亟待解決的公共衛生問題。
中醫學認為“先天不足,正氣虧虛,經脈失養;濕濁排泄減少,留滯經脈;脾胃失司,痰濁凝滯關節;感受外邪,邪痹經脈,氣血運行不暢”是痛風發病的基本病機。云南吳氏學派吳生元教授提出“三期六型辨證論治”理論,針對間歇期(脾虛濕阻證)痛風患者,運用“健脾化痰,滲濕通絡”治法[4],提出健脾滲濕方,該方由黨參、白術、茯苓、貓須草等十余味藥組成,具有脾滲濕、化痰逐瘀、通絡除痹之功,臨床主要用于高尿酸血癥的治療,適用于痛風的間歇期、慢性痛風石病變期及腎臟病變。前期臨床及基礎研究顯示,健脾滲濕方降尿酸療效顯著,明顯改善痛風及高尿酸血癥的臨床癥狀,顯著降低高尿酸血癥大鼠模型血尿酸水平,其作用機制可能主要與調節尿酸鹽轉運蛋白有關。前期課題組團隊采用 CRISPR/Cas9技術敲除Uox基因,獲得遺傳性狀穩定的尿酸酶基因缺失大鼠,該模式動物表型明顯,體內尿酸水平明顯高于野生型,腎功能異常且腎臟存在損傷,為高尿酸血癥和痛風的研究提供與人類尿酸代謝規律最接近的模型大鼠。研究已證實,人體內超過一半的血尿酸經腎臟排出體外,1/3的血尿酸從消化道排出[5]。目前有關健脾滲濕方治療痛風的研究主要聚焦酵母喂養型高尿酸血癥模型腎臟尿酸代謝,而對尿酸酶缺失高尿酸血癥模式動物消化道尿酸代謝及腸道菌群尚未明確,有必要進一步深入研究。
本研究在尿酸酶基因缺失高尿酸血癥大鼠模式動物上,從腎臟和腸道尿酸代謝、腸道菌群變化3個維度,明確健脾滲濕方干預尿酸代謝的效應途徑,解析中醫濁毒“脾腎虧虛,痰濕瘀阻”基本病機現代生物學內涵,為健脾滲濕方臨床應用治療痛風及相關并發癥提供科學基礎,傳承創新云南吳氏學術思想。
1 材料與方法
1.1 實驗動物 尿酸酶基因缺失高尿酸血癥大鼠(Uox-/-)16只,野生型SD大鼠(WT)8只,體質量180~200 g,雄性。由云南中醫藥大學段為鋼教授課題組提供。動物飼養在云南中醫藥大學第一附屬醫院中心實驗室屏障系統,飼料和水消毒后,給予實驗動物自由攝取。實驗方案通過云南中醫藥大學第一附屬醫院醫學倫理委員會審查。
1.2 主要藥物與試劑 健脾滲濕方主要由黨參、白術、法半夏、三七粉、土茯苓等十余味中藥組成,煎煮2次,濃縮成浸膏,4℃備用;尿酸檢測試劑盒、尿素氮檢測試劑盒、肌酐檢測試劑盒(羅氏診斷公司,貨號:03183807190;04460715190;03263991190);尿酸測試盒(南京建成生物工程公司,貨號:C012-1-1);蛋白染色試劑(伯樂生命醫學產品(上海)有限公司,貨號:#500-0006);BSA蛋白濃度測定試劑盒(上海碧云天生物技術有限公司,貨號:P0012S);Zymo Research BIOMICS DNA Microprep Kit(北京天漠科技有限公司,貨號:D4301);KOD-Plus-Neo DNA Polymerase(東洋紡(上海)生物科技有限公司,貨號:KOD-401B);NEBNext Ultra II DNA Library Prep Kit for Illumina(NEB(北京)有限公司,貨號:E7645L);Hiseq Rapid SBS Kit v2(因美納(中國)科學器材有限公司)。
1.3 主要儀器 羅氏cobas c311全自動生化分析儀(羅氏診斷產品(上海)有限公司),SpectraMax i3x型多功能酶標儀(美谷分子儀器(上海)有限公司),Heidolph旋轉蒸發儀(德祥科技有限公司),ASP 300S全自動脫水機、EG 1150H組織包埋機、CM 1950冷凍臺、RM2235切片機、HI1210烘片機、、DM2500正置顯微鏡和圖文系統(均為德國萊卡儀器有限公司),Qubit@2.0 Fluorometer DNA定量儀(賽默飛世爾科技有限公司),9700 PCR儀(美國應用生物系統公司),Hiseq 2500測序儀(因美納(中國)科學器材有限公司)。
2 方法
2.1 分組與給藥 測定Uox-/-大鼠血清尿酸,按尿酸平均值相近隨機分為高尿酸組(Uox-/-)、健脾滲濕方組(JPSSF),野生型 SD 大鼠為對照組(WT),每組 8只。動物自由飲水、進食1周后開始實驗。JPSSF組給予健脾滲濕方中藥液12.50 g/(kg·d)灌胃,高尿酸組和對照組給予相同體積的生理鹽水灌胃,連續給藥60 d。
2.2 腎功能檢測 末次給藥后,10%水合氯醛腹腔注射麻醉大鼠,眼眶靜脈叢取血,3 000 r/min離心10 min分離血清,采用全自動生化分析儀測定血清尿酸(UA)、尿素氮(BUN)、肌酐(Cr)水平。
2.3 尿蛋白的測定 給藥結束后,大鼠禁食、不禁水,收集24 h尿量并記錄。取1 mL收集的尿液,離心去除沉淀,參照考馬斯亮藍G-250法測定尿蛋白。簡言之,將標準品和離心后尿液加入96孔板中,各孔再加入200 μL稀釋后的染色液,室溫放置5 min,酶標儀595 nm測定OD值,計算各組大鼠1 d尿蛋白含量。
2.4 HE檢測高尿酸血癥模式動物腎臟病理損傷程度水合氯醛麻醉大鼠,取腎臟固定于10%福爾馬林中,75%、85%、95%、100%濃度梯度乙醇依次對標本進行脫水,二甲苯透明,石蠟包埋,切成4 μm薄片,二甲苯、濃度梯度乙醇脫蠟到水,蘇木素-伊紅(HE)染色,中性樹膠封片,光鏡下觀察腎臟組織病理損傷程度。
2.5 磷鎢酸法測定腸組織尿酸含量 精密稱取適量腸組織,加入9倍體積的PBS緩沖液冰上勻漿,4 000 r/min室溫離心10 min,取上清轉移至新的離心管,采用BSA蛋白測定試劑盒將腸組織蛋白含量調一致,接著按照尿酸測試盒說明書測定腸組織尿酸含量,酶標儀690 nm測定OD值,計算各組大鼠腸組織尿酸含量。
2.6 熒光定量PCR(q-PCR)檢測腎臟組織尿酸鹽轉運蛋白相關基因的表達 精密稱取腎組織,加入RZ裂解液,冰上勻漿,15~30℃放置5 min,使核酸蛋白復合物完全分離,應用Trizol試劑盒提取總RNA。取總RNA含量4 μg按Takara逆轉錄試劑盒合成cDNA。以合成的cDNA第1鏈為模板,按SYBR?Premix Ex TaqTMⅡ(Tli RNaseH Plus)試劑盒說明書進行q-PCR擴增,檢測尿酸鹽轉運蛋白基因:URAT1,UAT,OAT1的表達。設置GAPDH為內參對照,目的基因表達的相對差異量用2-△△Ct法進行統計分析。特異基因引物序列如下。

2.7 16S rRNA V4區檢測腸道菌群微生態結構多樣性健脾滲濕方干預治療結束后,將大鼠置代謝籠內,采集大鼠自然排出的新鮮糞便。每組隨機選出5只大鼠糞便,采用Zymo Research BIOMICS DNA Microprep Kit試劑盒純化糞便樣本gDNA。以每個樣品提取的DNA 為模板,引物序列:Primer 5’-3’:515F(5’-GTGYCAGCMGCCGCGGTAA-3’)和 806R(5’-GGACTACHVGGGTWTCTAAT-3’)擴增16S rDNA基因V4區,瓊脂糖凝膠進行目的片段電泳檢測、純化,按照每個樣本的測序量要求,進行相應比例的混合。NEBNext Ultra II DNA Library Prep Kit for Illumina試劑盒建庫,Hiseq Rapid SBS Kit v2試劑盒上機高通量測序,測序方式為PE250。在數據分析上:QIIME進行質控過濾掉不符合要求的序列,應用UPARSE算法在97%一致性水平上進行OTU聚類,用UCLUST分類法與SILVA數據庫注釋分析,R語言分析群落組成分。
2.8 統計學分析 采用SPSS 18.0軟件進行數據分析,所有實驗數據均以均數±標準差(±s)表示,正態分布采用單因素方差分析,非正態分布資料采用非參數檢驗,P<0.05表示差異具有統計學意義。
3 結果
3.1 健脾滲濕方對高尿酸血癥大鼠腎功能的影響
腎功能檢測結果顯示,與WT組相比,Uox-/-組血清尿酸含量顯著升高,差異具有統計學意義(P<0.01);與Uox-/-組相比,健脾滲濕方干預后能有效降低血清尿酸水平(P<0.05),結果見圖1A。Uox-/-組血清尿素氮和肌酐水平顯著高于WT組,其中血清尿素氮差異具有顯著性意義(P<0.01);JPSSF組尿素氮、肌酐水均低于 Uox-/-組,差異均具有統計學意義(P<0.05),結果見圖1B-C。這些結果提示,健脾滲濕方對高尿酸血癥腎功能損傷具有顯著的保護作用。檢測腸組織尿酸含量,發現Uox-/-組尿酸水平顯著高于WT組,差異具有統計學意義(P<0.01),健脾滲濕方干預后,對腸組織尿酸水平無顯著性影響(P>0.05),結果見圖1D。
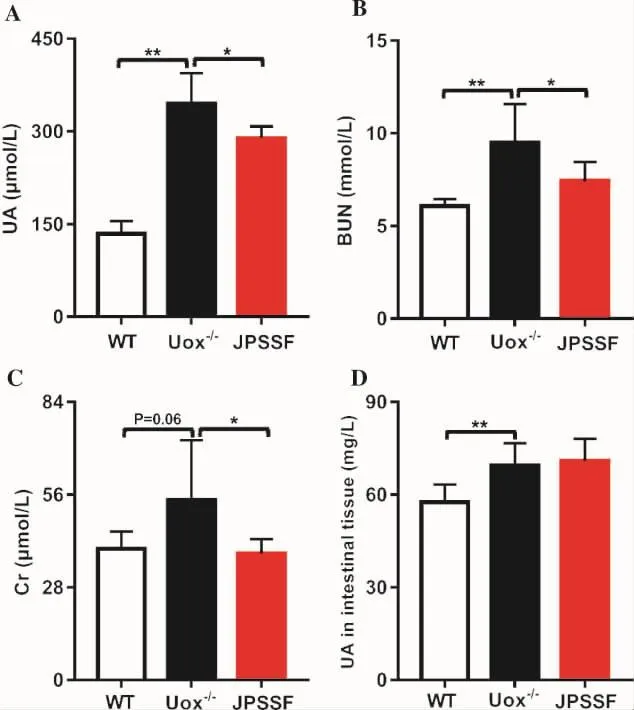
圖1 各組大鼠腎功能及腸組織尿酸的變化
3.2 健脾滲濕方對高尿酸血癥大鼠腎臟病理損傷及蛋白尿的影響 腎臟是尿酸排泄的主要器官,也是最主要的受累器官。HE染色結果如圖2A-C所示,WT組大鼠腎臟組織結構正常,腎小球及周圍腎小管、腎皮質、髓質結構清晰。與WT組相比,Uox-/-組大鼠腎小球結構紊亂甚至萎縮,出現大面積的炎細胞浸潤,有尿酸鈉結晶析出;健脾滲濕方組大鼠腎小球結構相對較完整,尿酸鈉結晶、炎癥反應均顯著減輕。尿蛋白常作為預測腎病的指標之一,檢測結果如圖2D所示,與WT組相比,Uox-/-組日尿蛋白量顯著增加,差異具有統計學意義(P<0.05);健脾滲濕方干預后,JPSSF組日尿蛋白量低于Uox-/-組,但差異無統計學意義(P>0.05)。
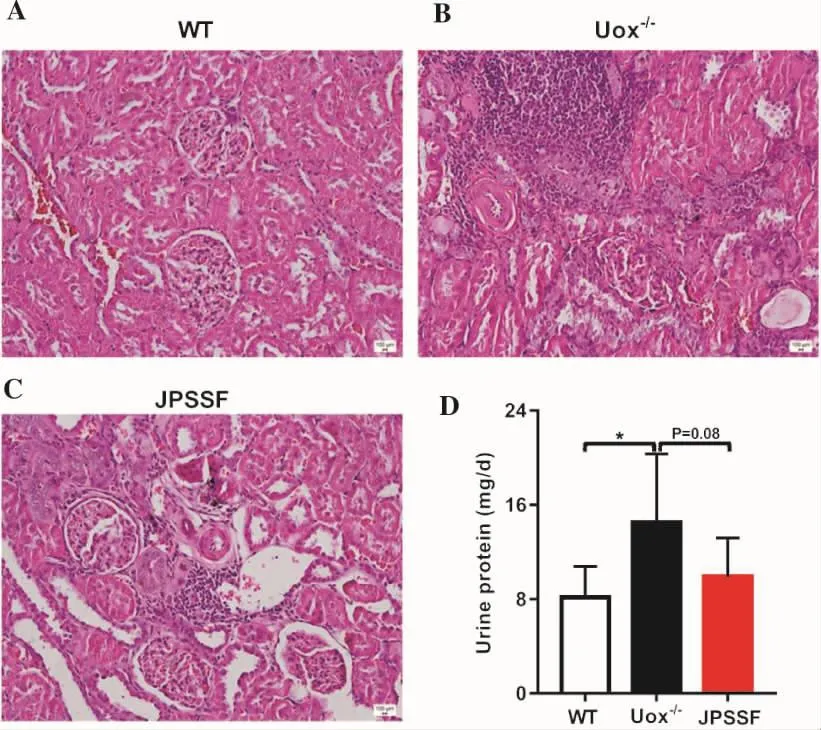
圖2 各組大鼠腎臟形態學改變(HE染色,×20)及日尿蛋白量
3.3 健脾滲濕方對高尿酸血癥大鼠腎臟組織尿酸鹽轉運蛋白的影響 位于腎小管頂膜、基底膜的4種尿酸鹽轉運蛋白(UAT、URAT1、OAT1、OAT3)參與了人近曲腎小管對尿酸鹽的轉運,進而促進尿酸的代謝。結果顯示:Uox-/-組 URAT1、UAT、OAT1 基因轉錄表達水平高于 WT組(P<0.05),JPSSF組 URAT1轉錄水平低于Uox-/-高尿酸血癥組,差異有統計學意義(P<0.05),UAT、OAT1轉錄水平沒有變化。提示健脾滲濕方干預能抑制腎近曲小管對尿酸鹽的重吸收,結果見圖3A-C。
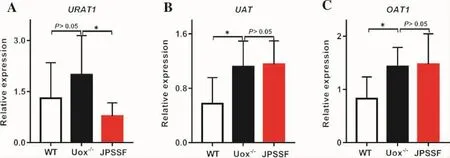
圖3 各組大鼠腎臟組織在轉錄組水平尿酸鹽轉運蛋白相關基因mRNA表達
3.4 健脾滲濕方對高尿酸血癥大鼠腸道菌群多樣性的影響 采用主坐標分析(PCoA)和非度量多維尺度分析(NMDS)法考察大鼠腸道菌群樣本間的差異程度以及差異變化規律。PCoA結果顯示,WT組菌群組成比較相似,Uox-/-組點間距離比較遠,表明高尿酸血癥引起腸道菌群紊亂,而JPSSF組組內點間距離和Uox-/-組相近,提示健脾滲濕方藥物干預后對高尿酸血癥大鼠腸道菌群無明顯的影響,結果見圖4A。NMDS分析結果顯示,Uox-/-組菌群間波動較大,而健脾滲濕方干預后,高尿酸血癥大鼠腸道菌群波動變小,菌群穩態,結果見圖4B。采用Alpha多樣性指數評價組內菌群的多樣性。Shannon指數和Simpson指數結果顯示,WT組、Uox-/-組之間菌群多樣性無明顯變化,JPSSF組菌群多樣性較Uox-/-組有下降趨勢(P>0.05),結果見圖 4C-D。

圖4 各組大鼠Beta多樣性和Alpha多樣性分析
3.5 健脾滲濕方對高尿酸血癥大鼠腸道菌群門水平的影響 物種相對豐度結果顯示,在門水平上厚壁菌門(Firmicutes)、變形菌門(proteobacteria)、擬桿菌門(Bacteroidetes)、放線菌門(Actinobacteria)、螺旋菌(Spirochaetes)為優勢物種,結果見圖5A。與WT組大鼠相比,Uox-/-模型組大鼠腸道微生物Firmicutes明顯 減 少 ,Bacteroidetes、Actinobacteria、Spirochaetes、Patescibacteria大量增加;與Uox-/-組相比,健脾滲濕方干預后 Firmicutes、Proteobacteria、Bacteroidetes 持續增加,而 Actinobacteria、Spirochaetes、Patescibacteria占比下降且具有一定向WT組恢復趨勢,但差異均無統計學意義(P>0.05),結果見表1。聚類熱圖結果顯示,WT組和JPSSF組的物種組成相似性大于WT組和Uox-/-組,結果見圖5B。這些結果提示,高尿酸血癥改變了大鼠腸道菌群的組成,而健脾滲濕方藥物干預后,在門水平上改善腸道菌群變化的作用有限。
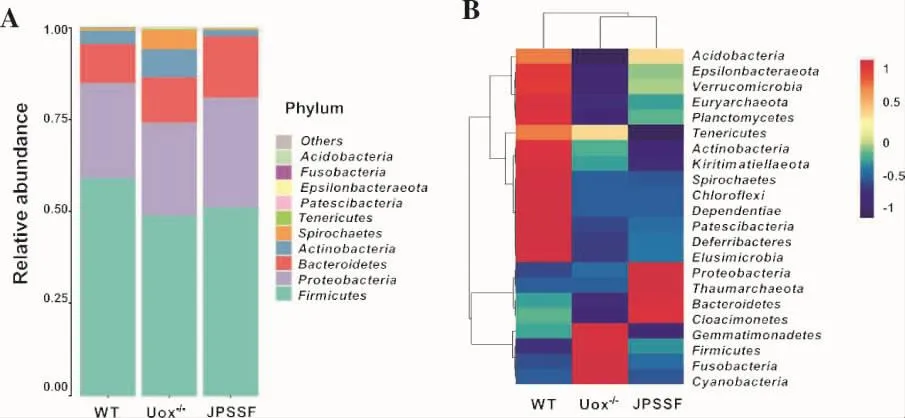
圖5 各組大鼠門水平上物種的相對豐度(A)和聚類熱圖(B)

表1 健脾滲濕方對門水平占比較高物種的影響(x± s,n=5,%)
3.6 健脾滲濕方對高尿酸血癥大鼠腸道菌群屬水平的影響 統計豐度排名前10的物種,在屬水平上埃希氏菌-志賀氏菌屬(Escherichia-Shigella)、乳桿菌屬(Lactobacillus)、腸球菌屬(Enterococcus)、梭菌屬(Clostridium sensu stricto 1)為優勢物種,結果見圖6A。Uox-/-組豐度前10的物種總量占比明顯低于WT組 , 其 中 Escherichia-Shigella,Clostridium sensu stricto 1,Prevotellaceae NK3B31 group,Aerococcus占比大量減少,Proteus,Bifidobacterium占比明顯增加,Lactobacillus,Enterococcus無明顯變化,差異均無顯著性意義(P>0.05);與 Uox-/-組相比,JPSSF 組大鼠腸道菌群 Lactobacillus,Proteus,Prevotellaceae NK3B31 group大量增加且Prevotellaceae NK3B31 group占比接近 WT 組,Clostridium sensu stricto 1,Bifidobacterium占比減少且Bifidobacterium有向WT組恢復趨勢,而 Escherichia-Shigella,Aerococcus,Bacteroides無明顯變化,差異均無顯著性意義(P>0.05),結果與屬水平聚類熱圖一致,見表2和圖6B。這些結果表明,健脾滲濕方對高尿酸血癥誘導的腸道菌群失調有一定恢復的趨勢,但作用并不顯著。
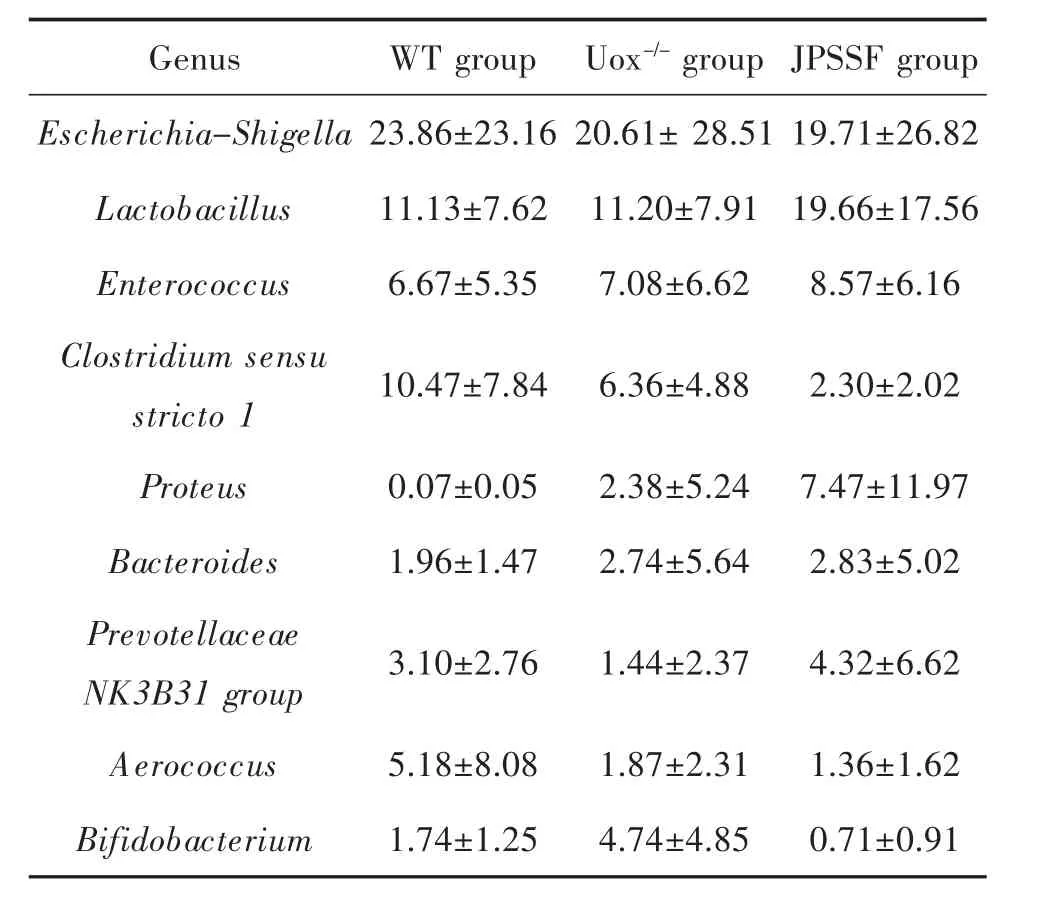
表2 健脾滲濕方對屬水平占比較高物種的影響(x± s,n=5,%)
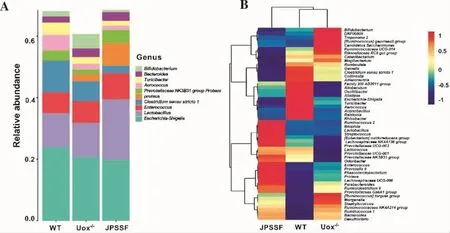
圖6 各組大鼠屬水平上物種的相對豐度(圖A)和聚類熱圖(圖B)
4 討論
動物體內的外源性或內源性嘌呤物質會代謝成黃嘌呤,黃嘌呤在黃嘌呤脫氫酶(Xdh)的催化下生成溶解度較低的尿酸,尿酸在尿酸酶(Uox)的催化下可以進一步轉化成溶解度較高的尿囊素[6]。課題組采用CRISPR/Cas9技術敲除Uox基因,獲得遺傳性狀穩定的尿酸酶基因缺失大鼠,該模式動物表型明顯,體內尿酸水平明顯高于野生型,腎功能異常且腎臟存在損傷[7],為高尿酸血癥和痛風的研究提供與人類尿酸代謝規律最接近的模型大鼠。
腎臟是尿酸排泄的主要器官,也是尿酸損傷的重要靶器官,尿酸鹽結晶沉積腎臟引起的直接、間接損傷,使腎臟的結構與功能發生病變,導致終末期腎臟疾病的發生[8]。痛風性腎病常以尿酸性腎結石、慢性間質性腎炎和纖維化為特征[9]。在尿酸酶基因缺失高尿酸血癥模式動物上,發現腎功能指標包括尿酸及尿素氮顯著高于野生對照組,腎小球及腎小管具有顯著的病理損傷,而健脾滲濕方藥物干預后顯著降低尿酸酶基因缺失大鼠血清尿酸和尿素氮水平,減少尿酸鈉結晶沉積于腎臟及誘導炎癥反應,對尿酸酶基因缺失高尿酸血癥模式動物腎損傷具有較好的保護作用。課題組前期在酵母喂養型高尿酸血癥模型中,發現健脾滲濕方上調腎小管尿酸鹽轉運蛋白UAT、OAT3,下調URAT1,從而促進尿酸排泄[10];同時顯著改善模型大鼠腎間質纖維化程度,下調大鼠腎臟內 COX-2、TNF-α、TGF-β1表達,從而發揮對腎臟的保護作用[11],上述研究結果與前期的文獻報道一致,進一步證明健脾滲濕方對尿酸晶體沉積于腎組織引起腎臟損害及纖維化具有較好的保護效應。
大多數哺乳動物體內的尿酸被尿酸酶催化為更易排出體外的尿囊素,而人類在進化過程中尿酸酶基因發生突變失去功能性,尿酸不能進一步分解[5],使得尿酸的代謝與排泄只能依靠尿液、糞便排出或腸道微生物進一步分解代謝。對于人體來說,體內的尿酸約2/3經腎臟排泄,不到1/3經腸道排泄。盡管院內制劑健脾滲濕方療效顯著,然而課題組前期研究主要聚焦腎臟尿酸代謝途徑及相關的損傷,而對于尿酸腸道分解代謝途徑,特別是腸道微生物研究較少,因此值得進一步深入研究。
腸道菌群及其構成的微生態環境對機體維持健康有重大意義,充分參與人體的生理、生化、病理和藥理的整個過程[12]。有研究報道,機體1/4到1/3的尿酸可以在糞便中恢復,這表明膽道或(和)腸道的分泌是尿酸排泄的一個重要的替代途徑,可能潛在地調節血清尿酸水平[13]。大多數健康人腸道菌群由厚壁菌門、擬桿菌門2個優勢類群組成[14],本研究體系中各組大鼠的優勢類群是厚壁菌門、變形菌門、擬桿菌門。與野生對照組相比,尿酸酶缺失高尿酸血癥模型大鼠Firmicutes豐度減少,Bacteroidetes豐度增加,這一結果與高脂飼料誘導高尿酸血癥模型腸道菌群分布一致[15]。厚壁菌門的代表性有益作用是產生丁酸鹽,緩解腸道炎癥反應[16]。健脾滲濕方組大鼠腸道Lactobacillus,Proteus,Prevotellaceae NK3B31 group 有 一定增加,而 Clostridium sensu stricto 1,Bifidobacterium具有減少趨勢,但差異均無統計學意義(P>0.05),提示健脾滲濕方對腸道微生物紊亂無明顯的影響,其主要通過影響腎臟尿酸排泄途徑,減少尿酸晶體沉積于腎組織,從而減輕痛風性腎損害。該方臨床更適合具有腎功能損傷的痛風患者,該研究為健脾滲濕方臨床應用治療痛風及相關并發癥提供科學依據。

