止抽湯對抽動障礙模型大鼠抽動行為及TNF-α、IL-6、IL-1β的影響*
程 艷,黃 爽,馮艷靜,唐 彥△
(1.曲靖市中醫醫院,云南 曲靖 655000;2.云南中醫藥大學第一臨床醫學院,云南 昆明 650500)
抽動障礙(TD)是兒童常見的神經精神疾病,主要表現為一個或多個部位反復、快速、無目的地肌肉抽搐或聲帶抽搐,可伴有情緒障礙、注意力缺失、強迫運動或思考等行為癥狀[1]。近年來其發病率呈上升趨勢[2]。研究發現腦基底神經節病變和多巴胺系統功能障礙與本病的發生密切相關[3],但單純針對神經遞質失衡的治療方案存在一定的局限性[4-5]。近年來國內外報道TD的發病機制與神經免疫網絡的失衡有關,研究發現TNF-α及白介素家族類中的IL-6、IL-1β、IL-2、IL-12等與本病可能存在關聯[6-7],以這些細胞因子在血清及腦組織增高為主要特點,提示促炎癥因子介導了神經免疫反應。
根據本病的臨床癥狀,TD屬于中醫“肝風證”范疇,目前多數學者認為本病主要與風、痰有關,以熄風化痰為主要治法[8-9]。
全國老中醫學術思想指導老師、云南省名中醫劉以敏教授在辨治TD時也以“風痰致病”立論,自擬的經驗方止抽湯不僅療效確切,且與同類治療TD復方相比,止抽湯主藥包含云南本地特有的中藥藍花參、山土瓜、薺菜花,有鮮明的地方特色[10]。前期研究發現止抽湯可通過調節紋狀體DA系統單胺類遞質改善TD模型大鼠抽動行為[11-12]。本實驗以此為基礎,進一步觀察止抽湯對TD模型大鼠細胞因子TNF-α、IL-6、IL-1β的影響,以期從不同環節探索其作用機制。
1 材料
1.1 實驗動物 24只Wistar大鼠,雄性,日齡28 d,體質量(120±15)g,購自長沙市天勤生物技術有限公司,動物許可證號為SCXK(湘)2014-0011。大鼠適應性飼養1周進入正式實驗。
1.2 藥物 止抽湯組成:藍花參15 g,山土瓜15 g,薺菜 15 g,天麻 10 g,鉤藤 10 g,白芍 20 g,烏梅 10 g,全蝎5 g,蜈蚣2條,甘草5 g,購自云南中醫藥大學第一附屬醫院中藥房,煎劑由醫院制劑中心提供,濃縮至生藥含量1.2 g/mL,貯存于4℃冰箱備用。鹽酸硫必利(江蘇天士力帝益藥業有限公司,批號H32026011),制劑濃度:1.7 mg/mL。
1.3 主要試劑與引物 主要試劑:IDPN(美國Sigma公司,貨號317306),使用前以生理鹽水稀釋成10%的溶液。TNF-α(貨號 E-EL-R0019c)、IL-6(貨號 EEL-R0015c)、IL-1β(貨號 E-EL-R0012c)酶聯免疫試劑盒由Elabscience公司提供。TNF-α抗體(貨號ab6671)、IL-6抗體(貨號 ab9324)、IL-1β 抗體(貨號ab9722)抗體,均由英國Abcam公司提供。RevertAidTM First Strand cDNA Synthesis Kit(Fermentas,貨號 K1622);SYBR Green master mix(KAPA,貨號KK4601);Trizol試劑盒(Lifetech,貨號 15596026)。
引物:引物合成由廣州invitrogen公司完成,應用beacon designer 7.90設計Q-PCR引物。引物序列如下。
TNF-ɑ引物:上游 5'-AACAAGGAGGAGAAGTTC-3',下游 3'-TTGAGAAGATGATCTGAGT-5';IL-6引物:上游 5'-GAACAACTTACAAGATAACA-3',下游 3'-GACTCTAACTTCTCCATTA-5';IL-1β 引物:上游 5'-AACATAAGCCAACAAGTG-3',下游3'-ACAGGACAGGTATAGATTC-5'。
1.4 主要儀器 電熱恒溫鼓風干燥箱(上海森信DGG-9140B);高速冷凍離心機(美國thermo scientific);酶標儀(美國 Molecular公司 SPECTCA MAX190);紫外分光光度計(美國NanoDrop ND-1000);定量 PCR 儀(美國 ABI StepOne);高速冷凍離心機(塞洛捷克D3024R);Vortex混合儀(上海啟前XH-D);酶標儀(美國 Molecular公司 SPECTCA MAX190)。
2 方法
2.1 造模及分組 24只Wistar大鼠隨機分為正常組6只、造模組18只。正常組腹腔注射生理鹽水,造模組腹腔注射 IDPN(150 mg·kg-1·d-1),連續 1 周,參照Napier等報道[13]的方法對大鼠刻板、運動行為進行評分。用藥后,造模組大鼠評分均>2分,造模成功。再將造模組隨機分為模型組、止抽湯組、鹽酸硫必利組,每組6只。
2.2 給藥 正常組、模型組均予生理鹽水灌胃,止抽湯組予止抽湯水煎液灌胃,鹽酸硫必利組予稀釋后的鹽酸硫必利溶液灌胃,均按2 mL/100g,1次/d;分別于藥物灌胃第7、14天后進行運動行為及刻板行為評分。
2.3 指標檢測
2.3.1 ELISA法檢測血清 TNF-α、IL-6、IL-1β的水平大鼠末次給藥和行為觀察后,腹腔注射10%水合氯醛溶液麻醉大鼠。在麻醉狀態下,抽取3 mL靜脈血并注入離心管。靜置15 min后,離心機(2 500 r/min)離心5 min,取上清液放入塑料離心管中。用ELISA試劑盒檢測大鼠血清TNF-α、IL-6、IL-1β的濃度,實驗操作嚴格按照ELISA試劑盒說明書進行。
2.3.2 熒光實時定量PCR法檢測TNF-α、IL-6、IL-1β的mRNA表達水平 用TRIzol試劑提取紋狀體中細胞總RNA,通過逆轉錄合成cDNA,以此cDNA為模板。用普通PCR反應擴增TNF-α、IL-6、IL-1β基因的產物。瓊脂糖凝膠電泳鑒定后,從凝膠中純化回收相應的DNA片段,用紫外分光光度計測定其濃度。以10倍梯度稀釋作為熒光定量PCR的標準曲線,建立定量PCR反應體系,對相應基因進行定量PCR反應。反應結束后,用熒光定量分析軟件測定電泳帶密度,以β-actin為內參照,計算目的基因mRNA相對水平。結果以TNF-α、IL-6、IL-1β條帶占βactin條帶密度的百分比(%)表示。
2.3.3 Western-blot法檢測 TNF-α、IL-6、IL-1β 的蛋白表達水平 組織蛋白樣品用蛋白中性裂解緩沖液提取,然后進行SDS-聚丙烯酰胺凝膠電泳并轉膜,麗春紅染色,3%脫脂牛奶在37℃下密封1 h,封閉液棄去。依次加入每種待測蛋白對應的一抗、二抗,用化學熒光試劑盒顯影固定顏色,并適當曝光。照片經掃描儀掃描后在軟件下分析各條帶光密度,結果以各蛋白光密度值占其內參照(β-actin)光密度的百分比(%)表示。
3 結果
3.1 各組大鼠運動行為、刻板行為評分比較 造模后第7天,模型大鼠的運動行為和刻板行為評分均高于正常組(P<0.01)。給藥7 d后,與模型組相比,止抽湯組和鹽酸硫必利組的刻板行為評分明顯下降(P<0.01),而運動行為評分無統計學意義(P=0.59,P=0.29),止抽湯組和鹽酸硫必利組之間差異無統計學意義(P=0.59,P=1.00)。給藥14 d后,與模型組相比,止抽湯組和鹽酸硫必利組的運動行為和刻板行為評分顯著降低(P<0.01),而止抽湯組和鹽酸硫必利組之間差異無統計學意義(P=0.30,P=0.11)。見表1、表2。
表1 各組大鼠運動行為評分比較(±s,n=6)
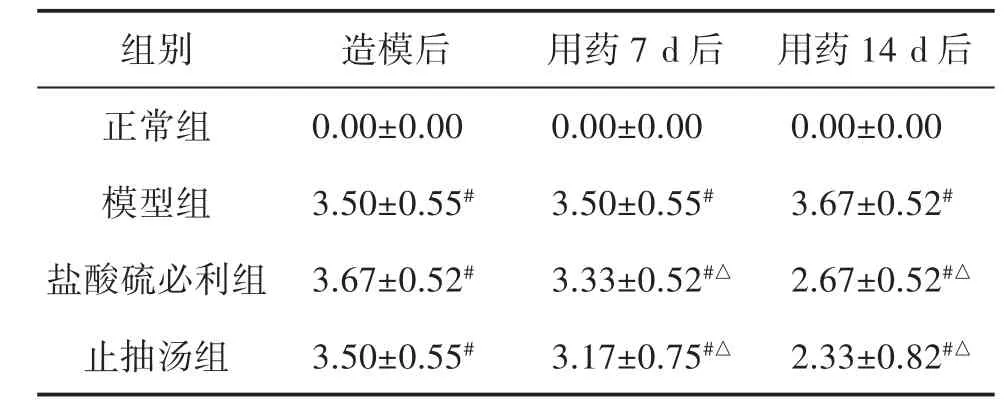
表1 各組大鼠運動行為評分比較(±s,n=6)
注:與正常組比較,#P<0.01;與模型組比較,△P<0.01。
組別 造模后 用藥7 d后 用藥1 4 d后正常組 0.0 0±0.0 0 0.0 0±0.0 0 0.0 0±0.0 0模型組 3.5 0±0.5 5# 3.5 0±0.5 5# 3.6 7±0.5 2#鹽酸硫必利組 3.6 7±0.5 2# 3.3 3±0.5 2#△ 2.6 7±0.5 2#△止抽湯組 3.5 0±0.5 5# 3.1 7±0.7 5#△ 2.3 3±0.8 2#△
表2 各組大鼠刻板行為評分比較(±s,n=6)
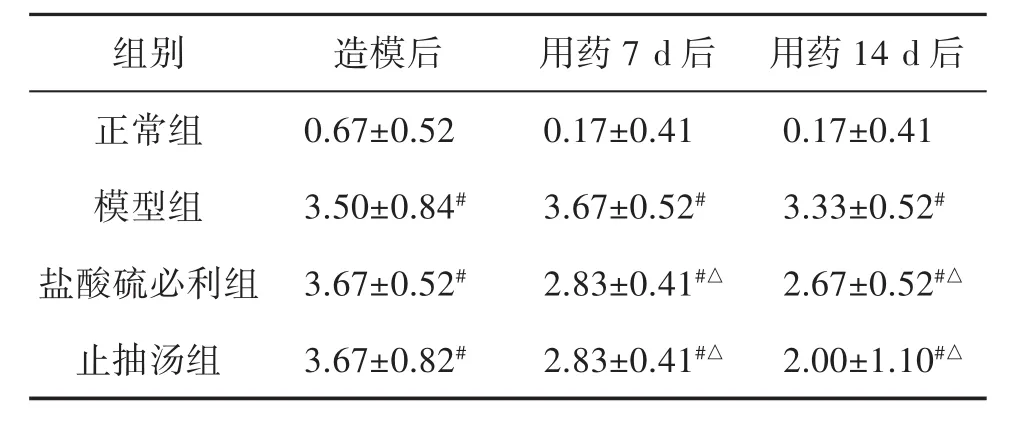
表2 各組大鼠刻板行為評分比較(±s,n=6)
注:與正常組比較,#P<0.01;與模型組比較,△P<0.01。
組別 造模后 用藥7 d后 用藥1 4 d后正常組 0.6 7±0.5 2 0.1 7±0.4 1 0.1 7±0.4 1模型組 3.5 0±0.8 4# 3.6 7±0.5 2# 3.3 3±0.5 2#鹽酸硫必利組 3.6 7±0.5 2# 2.8 3±0.4 1#△ 2.6 7±0.5 2#△止抽湯組 3.6 7±0.8 2# 2.8 3±0.4 1#△ 2.0 0±1.1 0#△
3.2 血清TNF-α、IL-6、IL-1β的結果比較 模型組血清TNF-α、IL-6、IL-1β水平明顯高于正常組(P<0.01)。與模型組相比,止抽湯組、鹽酸硫必利組明顯下降(P<0.01)。止抽湯組與鹽酸硫必利組比較差異無統計學意義(P=0.46、P=0.32、P=0.07)。見表 3。
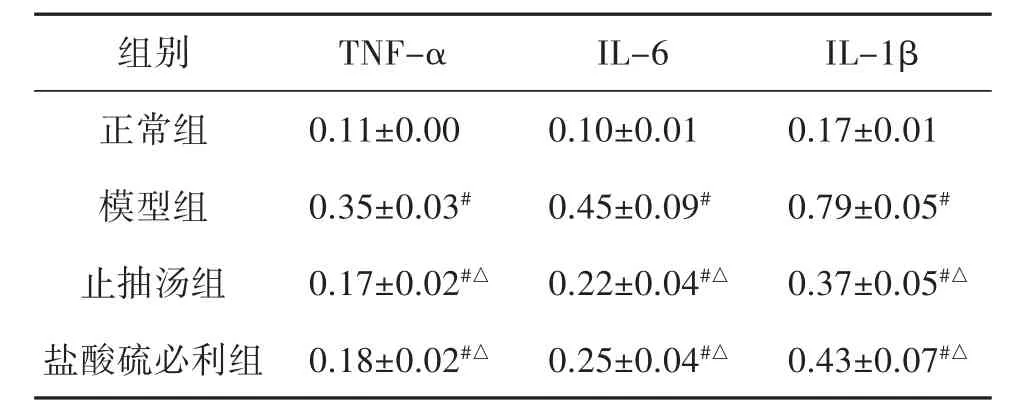
表3 大鼠血清TNF-α、IL-6、IL-1β水平比較(x± s,n=6)
3.3 紋狀體 TNF-α、IL-6、IL-1βmRNA表達水平及蛋白表達比較 各組大鼠紋狀體TNF-α、IL-6、IL-1βmRNA表達水平,模型組明顯高于正常組(P<0.05)。與模型組比較,止抽湯組、鹽酸硫必利組明顯下降(P<0.01)。止抽湯組與鹽酸硫必利組比較差異無統計學意義(P=0.59、P=0.59、P=0.21)。見表 4。
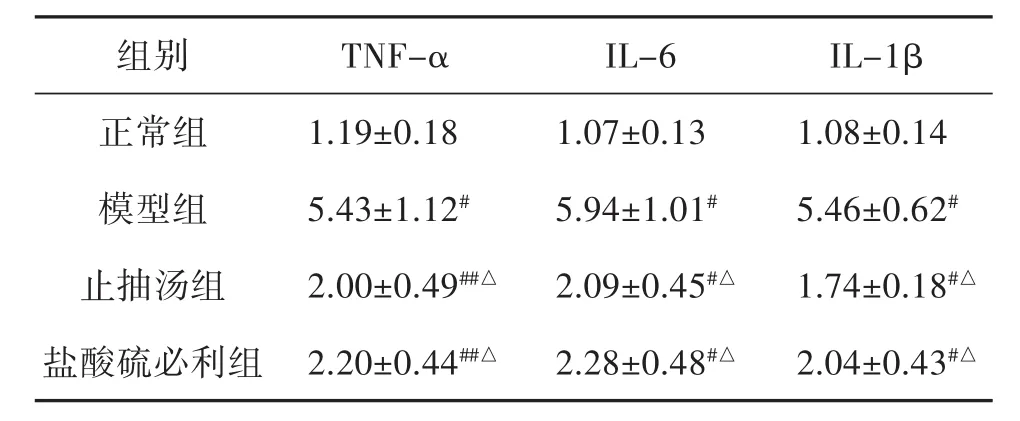
表4 大鼠紋狀體TNF-α、IL-6、IL-1βmRNA表達水平比較(x± s,n=6)
大鼠紋狀體TNF-α、IL-6、IL-1β的蛋白表達水平,模型組明顯高于正常組(P<0.05)。與模型組比較,止抽湯組、鹽酸硫必利組明顯下降(P<0.01);止抽湯組與鹽酸硫必利組比較差異無統計學意義(P=0.33、P=0.51、P=0.44)。見表 5。
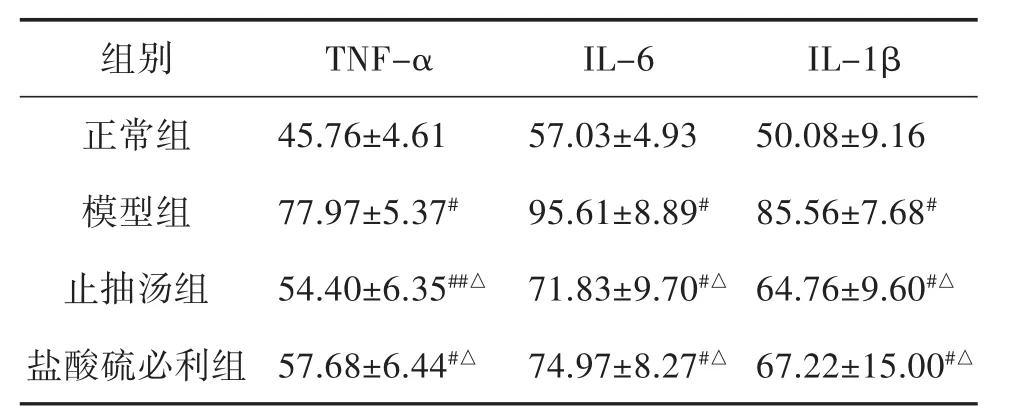
表5 大鼠紋狀體TNF-α、IL-6、IL-1β的蛋白表達水平比較(x± s,n=6)
4 討論
Diamond等[14]首次提出IDPN造模可成功誘發出大鼠抽動行為,以后陸續為國內外研究者所采用,成為研究本病最常用的造模方法[15]。本實驗中,IDPN也成功誘導出大鼠抽動行為,模型大鼠血清、紋狀體TNF-α、IL-6、IL-1β表達明顯增高,提示腹腔注射IDPN構建TD大鼠模型可誘導大鼠免疫功能紊亂,從而介導TD的發病,與同類研究的報道一致[16]。
細胞因子不僅是調節免疫炎癥反應的關鍵分子,在外周免疫系統和大腦之間的雙向信號傳導中起著至關重要的中介作用[17]。研究發現,大量的TNF-α對神經內分泌免疫有不良影響,并對基底神經節造成損害。若基底神經節受損,會影響多巴胺、乙酰膽堿、γ-氨基丁酸、β-內啡肽等神經遞質的釋放和傳遞,產生一系列不自主的運動行為障礙,從而影響TD的發生發展[7]。IL-6由神經元、星形膠質細胞和小膠質細胞產生,在中樞神經系統中起神經營養因子的作用[18]。它與神經遞質有關,能顯著增加海馬和額葉中的5-羥色胺和多巴胺的活性[19]。IL-1β是一種促炎癥細胞因子,參與組織破壞或水腫,可引起DA神經元凋亡和壞死,能激活DA神經元退變受體[20]。本實驗結果顯示TD模型大鼠存在細胞因子異常,以血清及紋狀體TNF-α、IL-6、IL-1β表達明顯增高為特點。
藥物干預后,止抽湯組大鼠抽動癥狀減少,血清及紋狀體TNF-α、IL-6、IL-1β水平明顯下降。推測止抽湯可通過抑制以上促炎細胞因子的表達,減少炎癥介質釋放,減輕TD神經炎癥和腦神經元損傷,進而影響神經遞質多巴胺、5-羥色胺、γ-氨基丁酸等的釋放,從而控制抽動癥狀。國內張夢嬌等[20]報道玉屏風散通過降低炎癥因子TNF-α、IL-6、IL-1β的表達,減輕大鼠抽動癥狀,與本實驗結果一致。而高漢媛等[21]研究顯示TD模型大鼠腦組織IL-6含量變化不明顯,提示復方中藥對TD的神經免疫功能有調控作用,但可能由于復方組成藥物不同,具有多途徑、多靶點、整體調節作用特點,因此研究結果也有所不同。
綜上,本研究證實TD模型大鼠存在細胞因子的異常,神經炎癥是本病的重要致病因素。止抽湯改善TD大鼠抽動行為與降低血清及紋狀體TNF-α、IL-6、IL-1β的高表達有關。但止抽湯調節外周和中樞炎癥的具體機制如何,通過什么途徑影響相關神經遞質的釋放,仍需進一步研究。

