ZNRF2 抑制自噬保護氧糖剝奪/復糖復氧致PC12細胞損傷
顧 超,譚曉丹,向 葡,羅 映,楊俊卿,王 紅
(1.重慶市生物化學與分子藥理學重點實驗室,2.重慶醫科大學藥理學教研室,重慶 400016;3.重慶市墊江縣人民醫院藥劑科,重慶 408300)
腦卒中是世界上致死率、致殘率最高的疾病之一,嚴重威脅人類的生命健康[1]。其中缺血性卒中占腦卒中的60%-80%,目前臨床上針對缺血性腦卒中主要治療方式是通過物理或藥物溶栓,恢復缺血區血流供應,但血流復灌又會引起腦缺血/再灌注損傷[2]。腦缺血/再灌注損傷的發生發展十分復雜,其發病機制與氧化應激、神經炎癥、神經元凋亡、細胞內鈣離子超載等多種因素相關,且尚不完全明確。越來越多研究發現自噬參與腦缺血/再灌注損傷的發生發展,且在腦缺血/再灌注不同時期,發揮著截然不同的作用[3-5]。因此,深入探究腦缺血/再灌注中自噬的調控機制,尋找缺血性腦卒中的干預新靶點,為腦缺血/再灌注損傷的預防和治療提供新的方向顯得十分必要。
鋅指/環指蛋白2(zinc and ring finger 2,ZNRF2)是一類特殊的膜相關E3泛素連接酶,在中樞和外周神經系統高表達,在維持突觸建立發揮著重要的作用[6];ZNRF2還參與氨基酸調節,維持細胞的生長[7]。最新研究表明,ZNRF2在腫瘤細胞的增殖、凋亡進程上發揮著重要作用,然而目前尚未見ZNRF2在神經系統疾病中的作用相關研究報道。因此,本實驗擬采用氧糖剝奪/復糖復氧模型(oxygen-glucose deprivation/reoxygenation,OGD/R)模擬腦缺血/再灌注損傷體外模型,初步探討ZNRF2對腦缺血/再灌注損傷的作用及機制。
1 材料與方法
1.1 細胞PC12細胞(大鼠腎上腺嗜鉻瘤細胞),購于武漢普諾賽生命科技有限公司。
1.2 主要試劑DMEM高糖培養基(D649)購于Sigma公司;DMEM無糖培養基(2177535)購于美國Gibco公司;胎牛血清購于以色列Biological Industries公司;馬血清(abs989)購于上海愛必信生物科技有限公司;胰蛋白酶(BL512A)、雙抗(BL505A)、PBS(BL302A)均購于biosharp公司;ZNRF2過表達慢病毒(LVCON294)載體構建委托上海吉凱基因公司完成;ZNRF2 siRNA干擾序列(R11077.2)由銳博公司合成;ZNRF2抗體(20200-1-AP)購于武漢三鷹生物公司;mTOR(A5866)、LC3B(A52502)、β-actin(A5538)等抗體購于bimake公司;p62(ab56416)、Beclin-1一抗均購于美國Abcam公司;p-mTOR(ser2448)(D9C2)抗體購于CST公司。
1.3 實驗儀器細胞超凈臺(SW-CJ-2FD),高速低溫離心機(iCEN-24R),二氧化碳細胞培養箱(311),三氣培養箱(3423),多功能酶標儀(721BR05752)均購于美國Thermo Scientific公司;電泳儀(041BR304570),成像儀(VLBL00D2)購于BIO-RAD。
1.4 實驗方法
1.4.1實驗分組 首先將PC12細胞分為正常組(normal)、模型組(OGD/R),觀察ZNRF2在OGD/R模型中的改變;為了進一步觀察ZNRF2對OGD/R致PC12細胞損傷的作用,我們采用ZNRF2過表達慢病毒上調ZNRF2表達以及ZNRF2小干擾RNA抑制ZNRF2表達,分別以ZNRF2空載病毒組、siRNA陰性對照作為空白對照組;將PC12細胞分為6組:正常組(normal)、氧糖剝奪/復糖復氧組(OGD/R)、ZNRF2空載病毒組(LV-NC)、ZRNF2過表達慢病毒組(LV-ZNRF2)、siRNA 陰性對照組(siNC)、ZNRF2小干擾RNA組(siR-ZNRF2)。
1.4.2OGD/R模型建立 除正常組外,其他組均需氧糖剝奪1 h,復糖復氧24 h建立OGD/R模型:將原有的DMEM高糖培養基棄去,加入DMEM無糖培養基,放入三氣培養箱(95% N2、5% O2,37 ℃)氧糖剝奪1 h后,將DMEM無糖培養基替換成DMEM高糖培養基,在5% CO2,37 ℃細胞培養箱中繼續培養24 h。
1.4.3 細胞培養與傳代在DMEM高糖培養基中加入10%馬血清和5%胎牛血清,1%雙抗(抗青霉素/鏈霉素)培養PC12細胞,PC12置于5% CO2、37 ℃溫度適宜的培養箱中培養2 d,待細胞生長密度達到85%左右進行傳代。
1.4.4細胞轉染 PC12按需求密度接種于細胞培養板后,分別加入ZNRF2過表達慢病毒(滴度:4×108kU·L-1)、空載病毒(病毒滴度:1×109kU·L-1)感染細胞6-8 h,更換新鮮培養基,繼續培養96 h后觀察熒光。按riboFECTTMCP Reagent轉染試劑說明書轉染ZNRF2 siRNA,轉染濃度為100 nmol·L-1,于培養箱中培養36 h,經預實驗篩選,確定siRNA2為有效序列,后續實驗均用siRNA2序列進行,ZNRF2 siRNA序列分別為:siRNA1:5′-CAGATGAAATGGATTTGCA-3′;siRNA2: 5′-AGAGCACCCTTCGGATTAA-3′; siRNA3: 5′-GCAATATGCCTTGAAGAAT-3′; siNC: 5′-GGCUCUAGAAAAGCCUAUGC-3′; 3′-TCCGAGAUCUUUUCGGAUACG-5′。
1.4.5MTT實驗 將PC12細胞以8 000個/孔接種于96孔板中培養24 h,建立OGD/R 模型后,避光加入配置好的MTT溶液(0.5 g·L-1)20 μL/孔于37 ℃孵育4 h,棄去培養基,避光加入DMSO 150 μL/孔,水平搖床上震蕩15 min后,用多功能酶標儀于490 nm處測定吸光度值。
1.4.6流式細胞術檢測各組細胞凋亡率 接種于6孔板中的PC12細胞給藥造模后,收集上清于15 mL離心管中,用不含EDTA的0.25%胰酶將細胞細化為單個細胞,然后用PBS緩沖液1 000 r·min-1離心5 min,棄去上清,反復兩次。最后將細胞重懸于PBS(pH 7.2)500 μL緩沖液中,裝于1.5 mL的EP管中,及時送于重慶醫科大學生命科學研究院進行細胞凋亡檢測。
1.4.7qRT-PCR檢測細胞中ZNRF2 mRNA的表達 細胞接種于6孔板中培養,OGD/R后,棄去培養基,加入預冷PBS緩沖液輕輕清洗后,加入1 mL TRIzol 提取細胞總RNA,根據cDNA逆轉錄試劑盒操作步驟得到cDNA,以大鼠源β-actin作為內參,采用qRT-RCR檢測ZNRF2 mRNA的相對表達量。大鼠源ZNRF2引物序列:前引物:3′-TAAGTGCCCGGTATGCTCAA-5′;后引物:5′-ATATACACAGGCAAGGCAGT-3′。
1.4.8Western blot檢測細胞各類蛋白表達 各組細胞給藥造模后,用預冷的PBS緩沖液清洗3次,加入RIPA ∶PMSF ∶磷酸酶抑制劑=100 ∶1 ∶2裂解液,用細胞刮收集細胞裂解液置于冰上裂解30 min,低溫高速離心12 000 r·min-1,15 min,取上清用BCA試劑盒測量蛋白濃度。凝膠電泳分離蛋白后,轉膜后,將含有蛋白的PVDF膜于5% BSA封閉液中室溫封閉2 h,加入ZNRF2 (1 ∶800)、LC3B (1 ∶1 000)、p62 (1 ∶2 000)、Beclin-1 (1 ∶1 000)、mTOR (1 ∶1 000)、p-mTOR (1 ∶1 000)、β-actin (1 ∶1 000)一抗4 ℃過夜,TBST緩沖液清洗3次(每次5 min),加入辣根過氧化物標記的二抗(1 ∶4 000)室溫孵育1 h,洗膜后,ECL發光液作用后,置于成像儀中成像,Image Lab軟件分析,β-actin作為內參。
2 結果
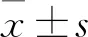
2.1 ZNRF2在OGD/R處理PC12細胞損傷模型中明顯下調為了探究ZNRF2在OGD/R致PC12細胞損傷中的變化,采用qRT-PCR、Western blot實驗分別檢測ZNRF2 mRNA、蛋白的表達變化。與Normal組相比,氧糖剝奪1 h,復糖復氧24 h后,ZNRF2 mRNA和蛋白均明顯下調,見Fig 1。

Fig 1 Expression of ZNRF2 down-regulated significantly in OGD/R-induced PC12
2.2 ZNRF2保護OGD/R誘導的PC12細胞損傷為了進一步觀察ZNRF2對OGD/R誘導的PC12細胞損傷的影響,采用MTT實驗、流式細胞術觀察細胞活力和細胞凋亡情況。結果如Fig 2所示,與Normal組相比,PC12細胞經氧糖剝奪/復糖復氧處理后,PC12細胞活力明顯減低、凋亡率明顯增加,LV-NC組、siNC組與OGD/R組相比無統計學差異,與LV-NC組相比,給予ZNRF2過表達慢病毒組后,PC12細胞活力、細胞凋亡明顯改善,而與siNC組相比,siR-ZNRF2組細胞活力進一步降低,細胞凋亡率增加,加重了細胞損傷。結果表明,ZNRF2保護 OGD/R導致的PC12細胞損傷。

Fig 2 Effect of ZNRF2 on cell viability and apoptosis of OGD/R-induced PC12
2.3 ZNRF2對OGD/R處理的PC12細胞自噬水平的影響為了初步探討ZNRF2保護OGD/R導致的PC12細胞損傷的機制,通過Western blot實驗觀察PC12細胞中自噬相關蛋白LC3II、Beclin-1以及p62的表達改變。結果如Fig 3所示,氧糖剝奪/復糖復糖后,與Normal組相比,PC12 細胞中自噬相關蛋白p62蛋白表達減少、Beclin-1蛋白和LC3II蛋白明顯增多,自噬被激活;與LV-NC組相比,LV-ZNRF2組中p62蛋白明顯上調,Beclin-1蛋白和LC3II蛋白表達降低,說明上調ZNRF2后,自噬被抑制;而相比于siNC組,下調ZNRF2后,p62蛋白表達降低,Beclin-1蛋白和LC3II蛋白表達增加,自噬加劇,差異具有統計學意義。

Fig 3 ZNRF2 inhibited OGD/R-induced excessive activation of autophagy in PC12
2.4 過表達ZNRF2上調mTOR、p-mTOR(ser2448)蛋白表達為了初步探究ZNRF2調控自噬的機制,采用Western blot檢測mTOR、p-mTOR(ser2448)蛋白的表達變化。結果如Fig 4所示,與Normal組相比,模型組中,mTOR、p-mTOR(ser2448)蛋白表達降低,給予ZNRF2過表達慢病毒后,mTOR、p-mTOR(ser2448)蛋白均明顯上調。

Fig 4 The protein expressions of mTOR and p-mTOR (ser2448) upregulated after transfecting ZNRF2 overexpression lentivirus
3 討論
自噬是真核細胞中通過溶酶體降解胞質中受損細胞器或錯誤蛋白的細胞自我保護途徑,在維持細胞內環境穩態中發揮著重要作用[8]。自噬不僅在許多生理過程如細胞增殖、分化與衰老中扮演著重要角色,亦在病理條件下也發揮著重要的作用,其中包括神經退行性疾病、糖尿病、癌癥、腦血管疾病等。研究表明,腦缺血/再灌注損傷中自噬被激活,在不同階段發揮著不同的作用,在再灌注前期,自噬通過清除細胞內受損細胞器或錯誤折疊蛋白產生保護作用;再灌注后期自噬持續激活,導致細胞自噬性死亡或造成細胞二次傷害[9]。有研究發現,黃芪甲苷可以通過上調自噬減輕氧糖剝奪誘導PC12細胞的氧化應激,從而產生保護作用[10];而TP53介導糖酵解和細胞凋亡調節因子上調明顯改善OGD/R導致的原代培養的皮層神經元的損傷,且自噬激活劑雷帕霉素可以逆轉其保護作用[11];自噬抑制劑3-甲基腺嘌呤可減少OGD/R誘導的PC12細胞損傷[12]。本次研究發現,OGD/R處理的PC12細胞中自噬激活,PC12細胞活性降低、細胞凋亡增加,結果提示OGD/R誘導的自噬過度激活導致PC12細胞損傷。自噬是一把“雙刃劍”,參與腦缺血/再灌注損傷的發生與發展,探究自噬在腦缺血/再灌注損傷中的具體作用,明確自噬調控機制十分重要。
ZNRF2是一類膜相關的E3泛素酶,在中樞和外周神經元高度表達,在維持細胞氨基酸穩定、突觸可塑性方面發揮著重要作用。有研究證實,ZNRF2抑制人骨肉瘤細胞的生長[13];在非小細胞肺癌中,上調ZNRF2可促進癌細胞增殖,抑制癌細胞凋亡[14]。最新研究表明LncRNA TTN-AS1/miR-153-3p/ZNRF2軸可以通過激活PI3K/AKT/mTOR調控癌細胞的增殖與凋亡參與乳頭狀甲狀腺癌病理進程[15],但在神經系統疾病中研究較少。本研究結果發現,上調ZNRF2表達可以明顯增加PC12細胞活力,減少PC12細胞凋亡率,從而保護OGD/R導致的PC12細胞損傷,而抑制PC12細胞中ZNRF2表達顯著加劇了OGD/R導致的PC12細胞損傷。有趣的是,本研究發現上調ZNRF2表達可顯著逆轉OGD/R誘導的PC12細胞中LC3II/LC3I、Beclin-1蛋白表達增加伴隨p62蛋白表達降低的現象,抑制PC12細胞中自噬的過度激活,而下調ZNRF2表達后,OGD/R誘導PC12細胞中自噬激活進一步加劇,PC12細胞損傷加重。結果提示,ZNRF2減輕OGD/R誘導的PC12細胞損傷,可能與抑制PC12細胞中的自噬激活相關。
哺乳動物雷帕霉素靶點(mammalian target of rapamycin,mTOR)是一類高度保守的絲氨酸/蘇氨酸激酶,在多種疾病的發生發展中扮演者重要角色,是調控自噬的關鍵蛋白[16]。有研究發現,在非小細胞肺癌中,ZNRF2通過上調mTOR,激活下游分子促進癌細胞的增殖,抑制癌細胞的凋亡[14];且有研究通過生物信息學預測分析發現,ZNRF2與mTOR可能有直接的結合位點[17]。同時本研究發現,上調ZNRF2后,抑制自噬過度激活,而mTOR、p-mTOR(ser2448)相應上調。因此,我們推測,ZNRF2抑制OGD/R誘導的PC12細胞自噬激活,可能與上調mTOR相關,但該機制需要進一步的實驗來探究。
綜上所述,ZNRF2對OGD/R誘導的PC12細胞損傷有明顯保護作用,其機制可能與上調mTOR,抑制OGD/R誘導的自噬激活途徑相關。ZNRF2有望成為干預腦缺血/再灌注損傷的新靶點。

