基于ADR報告數據的MAH生產線風險預警系統的研發與應用
雷保環 徐夢丹 鄧劍雄 楊悅 陳文戈 朱鑫


中圖分類號 R95 文獻標志碼 A 文章編號 1001-0408(2021)08-0904-07
DOI 10.6039/j.issn.1001-0408.2021.08.02
摘 要 目的:為藥品上市許可持有人(MAH)有效利用藥品不良反應(ADR)報告數據,對生產質量風險進行主動監測與控制、開展藥品生產風險管理提供技術方法。方法:通過建立三維風險矩陣、風險趨勢模型,設計研發了基于ADR報告數據的MAH生產線風險預警系統,并根據某企業的ADR報告數據對系統的主要功能進行實例應用分析。結果:初步建立了MAH生產線風險預警系統,其主要框架包括數據來源與處理、模型構建(三維矩陣模型包括可能性指標、嚴重程度指標和敏感性指標等3個維度,風險趨勢模型則根據產品生產批號編制原則設置)、結果輸出與分析等三大模塊,主要包含系統配置、生產線信號檢測、可視化統計預警、ADR報告管理、標準數據管理等五大功能模塊。通過某企業ADR報告數據的應用分析顯示,該系統可實現對其生產線風險及時、主動地檢測及預警,能較直觀地反映其高風險生產線、品種及批號,與該企業品種的實際安全性情況相吻合。結論:該系統可幫助MAH利用ADR報告數據及時、主動地監測藥品生產質量風險,排查高風險生產線、高風險品種、高風險批號的風險因素,輔助決策風險排查方向。
關鍵詞 藥品不良反應報告;藥品上市許可持有人;生產線;風險預警系統
Development and Application of MAH Production Line Risk Warning System Based on ADR Report Data
LEI Baohuan1,XU Mengdan1,2,DENG Jianxiong3,YANG Yue4,CHEN Wenge5,ZHU Xin6(1. School of Clinical Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, China; 2. NMPA Key Laboratory for Pharmacovigilance Technology Researoh and Evaluation, Guangzhou 510006; 3. Guangdong Pharmacological Society, Guangzhou 510080, China; 4. School of Pharmacy, Tsinghua University, Beijing 100084, China; 5. School of Mechanical and Electrical Engineering, Guangdong University of Technology, Guangzhou 510090, China; 6. Guangzhou Pinyi Technology Co., Ltd., Guangzhou 510095, China)
ABSTRACT? ?OBJECTIVE: To provide technical methods for marketing authorization holder (MAH) to effectively use the data of adverse drug reaction (ADR), actively monitor and control the production quality risk, and carry out drug production risk management. METHODS: Through establishing three-dimensional risk matrix and risk trend model, the risk early warning system of MAH production line based on ADR report data is designed and developed; the main functions of the system were applied and analyzed according to the actual ADR report data of a certain company.? RESULTS: MAH production line risk warning system was established preliminarily. The main framework included data source and and processing module, model construction module (three-dimensional matrix model included possibility index, severity index and sensitivity index, risk trend model was set according to the principle of product production batch number preparation), and result output & analysis module. Five major functional modules included system configuratio, production line signal detection, visual statistical early warning, ADR report management and standard data management. The application and analysis of ADR report data of a certain company showed that the system could realize detection and warning of the companys production line risk, which intuitively reflected its high-risk production lines, varieties and batch numbers. It was consistent with the actual safety situation of the companys varieties. CONCLUSIONS: The system can help MAH make use of ADR report data to actively monitor drug production quality risks in a timely manner, investigate risk factors for high-risk production lines, high-risk varieties and high-risk batch numbers, and assist in decision-making on the direction of risk investigation.
KEYWORDS? ?Adverse drug reaction report; Marketing authorization holder; Production line; Risk warning system
近年來,我國每年藥品不良反應(ADR)報告的上報數量呈快速增長趨勢,ADR報告數量由2009年的63萬份增長至2019年的近151.4萬份,增長率約為140%[1-2]。而ADR/不良事件既可源于藥品有效成分本身、藥用輔料的不可控因素,也可源于生產過程中的可控質量因素,如“亮菌甲素注射液事件”“黃柏膠囊事件”“克林霉素磷酸酯葡萄糖注射液(欣弗事件)”等因藥品質量問題導致的不良事件[3]。藥品質量問題導致的不良事件通常影響范圍較廣、受害人群較多,常會給企業帶來巨大的損失甚至導致其破產。2019年新修訂的《藥品管理法》規定我國實行藥品上市許可持有人(MAH)制度和藥物警戒制度,要求MAH對藥品全生命周期的質量安全負責。目前,結合筆者工作實際發現,MAH對藥品生產質量的管理與臨床使用安全風險的識別較為割裂和被動,因此為幫助MAH有效利用臨床ADR報告數據對生產質量風險進行主動監測與控制,本文通過建立三維風險矩陣、風險趨勢模型,設計研發了基于ADR報告數據的MAH生產線風險預警系統,使MAH能及時、主動地識別生產線風險并通過個性化風險評價方案分析生產線風險影響因素,輔助MAH制定風險控制措施,以期為MAH開展藥品生產風險管理、保證臨床用藥安全提供一種新的技術方法。
1 國內外藥品安全風險信號挖掘研究現狀
目前國內外常用比例失衡法、聚類計算法、關聯規則法、決策樹法等對ADR報告數據進行風險信號的挖掘[4-10],此類研究主要關注藥物本身固有的ADR發生情況或影響因素,以評估其上市后使用的安全性。孫怡園等[11]構建了改進的加權Apriori關聯模型,通過ADR報告數據驗證了該模型對生產風險的監測與預警作用。楊悅等[12]創新性地使用三維風險矩陣模型設計了基于ADR報告數據進行藥品生產風險識別的方法與自動預警系統,使藥品監督管理部門可以監測藥品生產企業的生產風險。林偉強等[13]選取Apriori、馬爾科夫鏈模型、3σ-層次分析法、CV-SES等算法建立了基于藥品監督管理部門抽驗數據的藥品質量風險預警模型。以上對藥品質量風險監測的研究,均為基于藥品監督管理部門角度的對既往數據的回顧性被動監測,尚未見基于MAH角度的生產線風險監測預警研究,也未見信息化監測平臺的構建和應用研究。
2 MAH生產線風險預警系統設計框架
Paul等[14]認為,風險發生的可能性和風險后果的嚴重性決定了風險程度,即風險程度=風險概率×損失程度。由于用藥基數的不確定導致風險概率難以計算,因此本文將藥品單批號風險劃分為風險發生的可能性指標、嚴重程度指標、敏感性指標等3個維度來構建三維風險矩陣模型;同時,通過設置生產線識別機制、信號組批規則、風險等級劃分標準與風險信號標識構建批號風險趨勢模型,基于以上2個模型運算藥品生產批號風險趨勢(具體運算方法詳見后文)。根據生產線每日新增報告運算生產線風險等級與R值(可能性指標,詳見后文敘述),并完成可視化風險趨勢分析與信號預警。本系統主要框架包括數據來源與處理、模型構建、結果輸出與分析等三大模塊,如圖1所示。
2.1 數據來源與處理
目前,MAH的ADR報告數據來源主要包括國家ADR直接報告系統的反饋、MAH自主收集、文獻檢索、上市后臨床研究等,由以上數據導入后形成ADR報告數據集。但由于以上原始ADR報告數據存在藥品或ADR信息缺漏、錯誤、不規范等問題,故為保證數據結果分析的正確性、完整性和規范性,本研究在該系統設計時建立了包含國際通用醫學術語集世界衛生組織不良反應術語集(WHO-art)或監管活動醫學詞典(MedDRA)與MAH藥品信息的標準數據庫,作為ADR報告信息規整的數據來源,對ADR報告數據進行規整。
2.2 模型構建
2.2.1 三維風險矩陣模型
藥品單批號綜合風險程度計算分為3個維度,即可能性指標(設為R值)、嚴重程度指標(設為SIADR值)、敏感性指標(設為T值),確立風險評估指標集為{R,SIADR,T},構建出三維風險矩陣模型。每個指標具體的算法如下:
①R值——可能性指標。根據藥品生產日期、有效期、出廠銷售時間等可估算某批次藥品ADR的發生時間,即ADR報告數據范圍。本文以ADR報告數據范圍作為選定生產線風險分析的數據范圍,以計算單批號的R值,計算公式為:R=[a+c b] (式中,a為同品種同批號藥品發生ADR的數量;b為同品種所有批號藥品的ADR總數;c為同品種藥品發生ADR的所有批號數)。
②SIADR值——嚴重程度指標。生產線風險包括熱原、可見異物,此類風險可導致熱原反應、肝腎功能損害、過敏性休克等不良事件的發生。本文通過制定目標事件涉及ADR的嚴重程度分級標準,按1~6級分別賦予1~6分的權重分值,以計算單批號的風險嚴重程度SIADR值。ADR在目標事件中的嚴重程度或關注度越高,權重分值越大。考慮到不同劑型(或品種)生產線的生產工藝不同,風險原因也會有所差別,因此目標事件中ADR的選擇、權重分值的大小可根據產品的特點并結合臨床專家經驗進行自行設置。SIADR值的計算公式為: SIADR=[∑x n] (其中,x為同批號藥品每份ADR報告中ADR的權重分值;n為同批號藥品的ADR報告總數)。
③T值——敏感性指標。首先,同批號藥品的ADR報告按ADR發生時間進行排序,以統計相鄰ADR報告的時間距離。通過對時間權重的設置以計算風險發生的敏感性T值,相鄰ADR發生間隔時間越近意味風險發生的敏感性越強,權重分值越高,具體詳見表1。根據各時間距離組的批號數量計算T值,計算公式為:T=[∑(Xi·Yi) n] (其中,i為時間距離組中分組類別,取值為0,1,2,3,4,5,6,7;X為每個分組類別所賦的分值; Y為分組中的時間差值;n表示同批號藥品的批數)。
為進一步識別單批號的風險程度,根據各風險指標值大小將綜合風險程度{R,SIADR,T}劃分成Ⅰ、Ⅱ、Ⅲ、Ⅳ等4個等級,詳見表2。
2.2.2 風險趨勢模型
目前,國內外尚未見對生產線進行過具體定義,但其有著確定的內涵及豐富的外延[15]。產品相關的生產環境、設備設施、特定生產線的批量范圍、工藝規程、批生產記錄要求等均屬于生產線的范圍。同一條生產線可同時生產幾個不同的品種,即共線生產,因此生產線風險監測(詳見“2.3”項下敘述)首先需要識別ADR報告中藥品對應的生產線。本文通過ADR報告中生產批號、產品規格或批準文號信息,根據產品生產批號編制原則,設置生產線在生產批號中的標識位置來實現生產線的識別。以某企業8位數字的生產批號(圖2)為例,該生產批號前4位代表生產年份、月份,第5位表示規格,第6位表示生產線,最后2位表示流水號,因此該生產線的標識為第6位數字“2”,標識字符個數為“1”,即生產線可表示為“2[6-1]”。若生產批號中無生產線標識字符,也可根據各企業產品規格、批準文號對應的生產線規則識別生產線。
由于藥品風險影響因素較多,單批號風險等級偏高具有偶然性,因此本文以相鄰的3個批號作為一組,根據3個單批號的綜合風險程度形成一個組批信號,如圖3所示:1704201、1704202、1704205這3個相鄰批號綜合風險程度組合成一個A1級組批信號。組批信號根據相鄰單批號綜合風險程度從高到低依次劃為A1、A2、A3、B1、B2、B3、C1、C2、D1共計9個等級,劃分標準詳見表3。分別以不同的幾何形狀在可視化風險趨勢圖上予以標識,如圖3所示。為識別批號聚集的高風險區域,將組批風險劃分成4個等級區域,從高到低分別用紅色(A1~A3)、橙色(B1~B3)、黃色(C1~C2)、藍色(D1)標識。本文將高風險組批信號劃分規則確定為出現A3以上預警信號,生產批號R值>5。關于高風險組批信號的劃分,企業可根據具體產品的風險特點、關注程度進行自定義設置。
2.3 結果輸出與分析
利用E-charts圖表插件來展示預警數據,如以信號檢測時間范圍為橫坐標,以信號級別、R值、新增報告數為縱坐標,生成生產線風險監測預警圖,可快速識別高風險生產線信號及變化趨勢;以相鄰3個批號中最早發生ADR的日期為橫坐標,以其組批風險等級為縱坐標,繪制不同階段、相鄰批號的組批信號風險趨勢圖,可快速識別高風險批號聚集區域、高風險品種。同樣,通過E-charts圖表插件展示風險信號相關ADR數據、涉及品種、風險批號信息等,利用信號形狀標記及預警顏色標記可達到預警的目的。
3 MAH生產線風險預警系統的實現
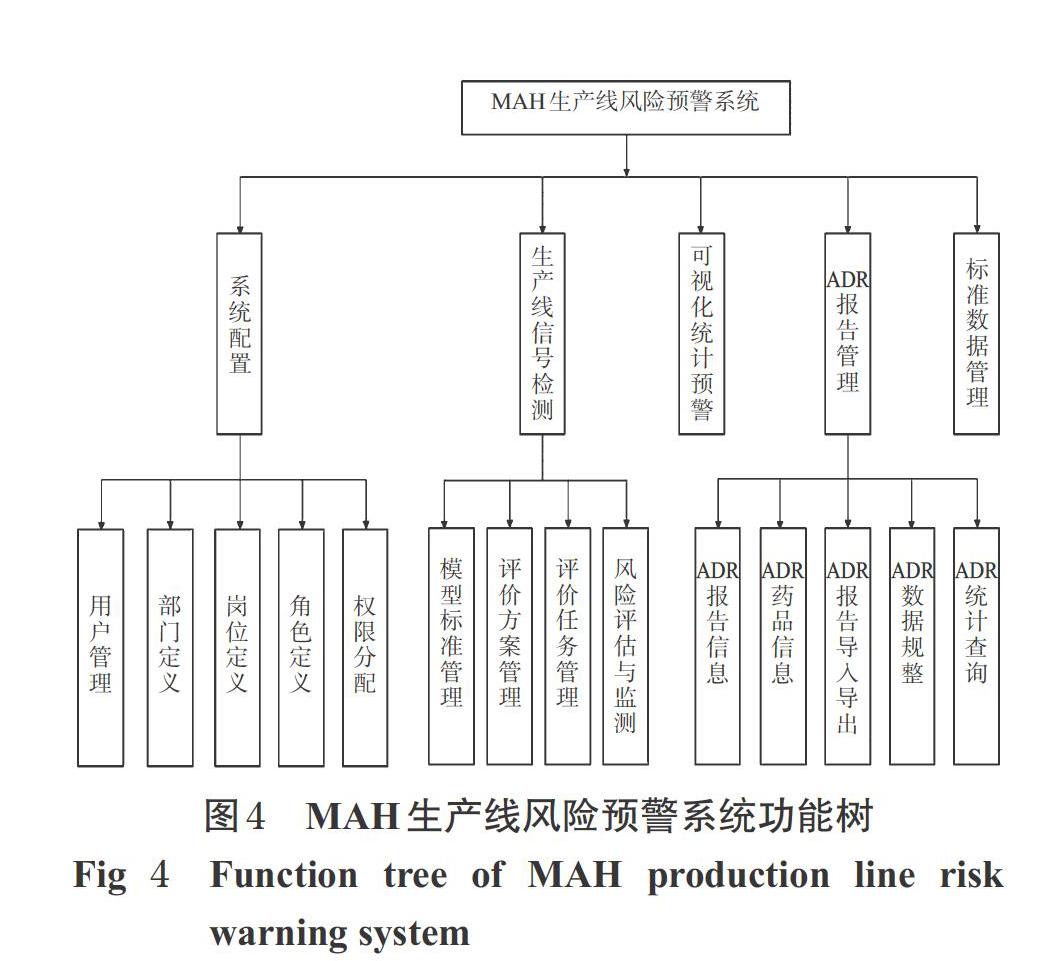
企業生產線風險預警系統從技術體系上選用J2EE技術,采用Browser/WebServer/DataBaseServer三層結構進行應用系統的開發。結合實際工作的需求,遵循模塊化設計的思想,基于前文系統框架完成MAH生產線風險預警系統的整體設計,其主要功能分為5個部分,如圖4所示。
3.1 系統配置
系統配置包含用戶管理、部門定義、崗位定義、角色定義、權限分配等的配置。
3.2 生產線信號檢測
生產線信號檢測主要包括模型標準管理、評價方案管理、評價任務管理、風險評估與監測等4個模塊。模型標準管理是對生產線識別規則、風險等級劃分標準等的設置;評價方案管理及評價任務管理主要為根據風險檢測目標設置個性化風險評價方案,包括任務執行模式、執行時間、選定ADR報告數據范圍、目標事件等參數的設置;風險評估與監測可實現批號風險值的計算與組批信號標識及生產線風險信號的更新預警。
3.3 可視化統計預警
使用E-charts圖表插件對運算出的預警數據進行展示,通過警戒線和顏色標記達到預警的目的。
3.4 ADR報告管理
ADR報告管理可為MAH提供豐富的ADR報告信息及MAH持有品種的藥品信息存儲、檢索、更新和ADR報告導入導出、規整及ADR報告數據統計查詢功能。
3.5 標準數據管理
標準數據管理可實現對藥品生產廠家、藥品劑型、ADR術語集以及其他基礎分類信息的添加、刪除、更新、審核等操作,為規整ADR報告數據提供基準。
4 系統應用及結果分析
4.1 ADR報告數據準備
本文以某企業為例,以ADR發生時間“2018年1月1日-2019年12月30日”為篩選條件,選擇該企業的ADR報告數據,對本系統的主要功能進行實例應用分析。該企業該時間段內共收集到3 109例ADR報告,均為來自國家ADR直接報告系統的反饋報告,共涉及17個品種,包括口服制劑和注射劑。其中,X、Y、Z等3個共線品種注射液的ADR報告共2 939例,占該時間段內總ADR報告數的94.53%。由于這3個品種注射液ADR報告數占比較大,且為共線產品,故本文以注射劑型生產線為例,回顧性分析該企業該時間段內3個品種的生產線風險情況。系統導入以上數據后,對ADR報告中的ADR、產品信息等內容進行規范化處理,本系統自動生成規整后的ADR報告數據集,作為生產線風險檢測的數據來源。
4.2 風險評價方案及任務設置
風險評價方案的設置是系統使用過程中的關鍵步驟,也是風險識別模型的建立基礎。根據前文風險檢測目標,該風險評價方案主要參數設置如表4所示:注射液生產線為2[5-1];目標事件設置為熱原反應,并對熱原反應相關ADR嚴重程度進行權重賦分;時間權重配置如前文表1所示。
4.3 批號風險趨勢結果分析
系統基于三維風險矩陣模型、風險趨勢模型進行生產線風險分析,并生成生產線風險圖、批號風險趨勢圖。生產線風險監測圖為根據每日新增報告數更新指定ADR報告數據周期內的各生產線風險等級及R值,點擊生產線風險監測圖,可進入新的界面,查看該生產線上批號的風險趨勢圖、生產批號R值統計圖,以詳細分析生產線風險信號情況。
基于以上風險評價方案設置,該企業“2[5-1]”生產線風險趨勢分析結果如圖5所示,3個品種各自的批號風險趨勢圖如圖6所示。
4.3.1 風險信號整體情況
①信號級別——2018-2019年,該生產線3個品種共生成1 807個信號,A1~D1級信號均有涉及。其中,主要以B、C級信號最為密集,高風險A級信號也為數不少,這提示該條生產線存在較高風險,企業需進一步篩查信號涉及各品種的風險情況。若出現單品種風險居高,應優先排查單品種生產線風險,如重點排查該品種生產工藝風險;若風險高低無明顯品種差異,應對整條生產線的原輔料、生產環境、機器設備、工藝等進行全面排查。
②信號聚集——該生產線批號信號主要聚集在2018年1月1日-3月1日、2018年9月1日-2019年1月1日、2019年3月1日-2020年1月1日這3個時間段,即2019年風險信號最為密集。而其中高風險批號主要聚集在2018年9月-2019年1月,提示企業需排查該時間段內ADR的發生是否存在時間、地區聚集性,以排除醫院用藥、運輸及儲存等影響因素,進一步鎖定對內或對外風險排查方向。
③單品種風險信號——通過品種篩選功能,分別查看3個品種的風險信號趨勢。如圖6所示,“2[5-1]”生產線上以X品種風險信號最為密集,這提示企業應重點關注X品種生產線風險的排查; Y品種存在A級信號聚集及較高頻次的B級信號。
考慮文章篇幅,本文僅以高風險的X品種為例,對該品種的信號聚集、高風險批次產生因素進行分析。
4.3.2 高風險品種分析
①信號聚集與ADR分析——該企業X品種在該時間段內為高風險品種,其批號風險信號主要集中在2018年1月1日-3月1日、2018年9月1日-2019年1月1日、2019年3月1日-2020年1月1日3個時間段,說明信號涉及批號產品的ADR主要發生在該時間段內。通過信號聚集區域生產批號,于ADR報告數據庫中查詢相關ADR報告的發生時間與上報地區,結果顯示,X品種ADR的發生未見單批號或相鄰批號ADR時間與區域聚集性,故不考慮醫院用藥、藥品運輸、儲存等外在影響因素。
②高風險批號分析——由于R值與批號綜合風險程度成正相關,故本文通過設置R值>5以進一步篩查X品種高風險生產批號及風險信息(結果見圖7、表5)。同時,對A級信號所涉及的生產批號進行統計(結果見表6),以綜合分析高風險批號,鎖定生產線質量自檢的高風險產品批號。綜上,X品種出現連續生產批號存在R值>5,如1811201、1811202、1811204、1811205批號,且均為B1信號,涉及ADR報告數達65份;連續批號1808201、1808202、1808203、1808204信號發生頻次較高,且包含A級信號;1812203、19062011批號的信號頻次及ADR報告數均較高。以上信息提示,針對該品種“2[5-1]”生產線風險,可優先排查這些高風險批號的生產質量問題。
綜上,根據生產線風險預警系統的信號檢測,顯示某企業該數據時間范圍內X產品可能存在生產線熱原風險,且高風險批次主要集中在2018年的生產批號。對于高風險信號批次,企業可權衡后采取相關控制措施,如針對高風險品種、批號以及相鄰批號開展相關質量自檢,查找質量風險影響因素。對于A級信號但信號頻次及ADR報告數較低的生產批號,企業可予以持續監測、重點關注。
經生產質量檢查專家建議及企業調查評估結果,結合風險因素及公眾用藥安全,該企業X品種已于2020年停止生產。
5 結論與展望
藥品生產質量安全一直是監管部門及企業十分注重的問題,既往藥品生產企業很大程度上依賴于藥品監督管理部門的飛行檢查、產品抽驗等方式發現風險,處于被動狀態,存在滯后性。本文從MAH承擔生產質量安全責任的角度出發,研發了一套基于ADR報告數據的MAH生產線風險預警系統,具有ADR報告數據規整、生產線風險趨勢分析及信號預警等功能,并基于某企業2018-2019年3種共線品種的ADR報告數據驗證了該系統的風險信號檢測等功能。回顧性分析結果顯示,該企業因質量風險已自行停產的X品種為高風險品種,這也驗證了該系統可幫助MAH充分利用ADR報告數據監測產品的生產質量風險,排查高風險生產線、高風險品種、高風險批號的風險因素,輔助決策風險排查方向。
綜上,MAH生產線風險預警系統的應用可提高MAH及時、主動、動態監測產品生產線風險的效率,避免或降低生產質量風險對公眾健康、MAH自身發展造成的損害。本系統目前已應用于20多家企業,由于目標事件配置屬于自定義方式,尚不明確其自定義配置的不同對風險信號檢測結果的影響,故未來筆者將通過專家咨詢等方法,根據醫學專家的理論知識及臨床經驗設置熱原反應、肝腎功能損害、過敏性休克、可見異物等目標事件的相關ADR及權重配置的固定模板,確保目標事件中ADR及權重的相對專業性、全面性、準確性,從而提高風險信號檢測的靈敏度。
參考文獻
[ 1 ] 王丹,任經天,董鐸,等.藥品不良反應監測年度報告十年趨勢分析[J].中國藥物警戒,2020,17(5):276-283.
[ 2 ] 國家食品藥品監督管理局.國家藥品不良反應監測年度報告:2019年[EB/OL]. (2020-04-13)[2020-10-02].https:// www.nmpa.gov.cn/xxgk/yjjsh/ypblfytb/20200413094901- 811.html.
[ 3 ] 侯珂露,黃琳,封宇飛.我國藥品質量相關的藥害事件的回顧性分析[J].中國醫院藥學雜志,2020,40(6):640- 643.
[ 4 ] YOGIT A,SANGMA J W,ANAL S R N,et al. Clusteringbased hybrid approach for identifying quantitative multidimensional associations between patient attributes,drugs and adverse drug reactions[J]. Interdiscip Sci Comput Life Sci,2020,12(3):237-251.
[ 5 ] IMAI S,YAMADA T,KASASHI K,et al. Construction of a flow chart-like risk prediction model of ganciclovir-induced neutropaenia including severity grade:a data? ? ?mining approach using decision tree[J]. J Clin Pharm Ther,2019,44(5):726-734.
[ 6 ] ZHANG D,LV J,ZHANG B,et al. The characteristics and regularities of cardiac adverse drug reactions induced by Chinese materia medica:a bibliometric research and association rules analysis[J]. J Ethnopharmacol,2020,252:112582.
[ 7 ] 唐學文,賈運濤,田曉江,等.基于報告比值比法對利奈唑胺安全警戒信號的挖掘與評價[J].中國藥房,2017,28(20):2779-2783.
[ 8 ] 朱正怡,倪映華,高鵬,等.基于FDA不良事件報告系統的氯喹及羥氯喹不良反應分析與評價[J].中國醫院藥學雜志,2020,40(17):1805-1810.
[ 9 ] CHAKRABORTYB S. Pharmacovigilance:a data mining approach to signal detection[J]. Indian J Pharmacol,2015,47(3):241-242.
[10] 張婧媛,白羽霞,韓晟,等.數據挖掘方法檢測藥品不良反應信號的應用研究[J].藥物不良反應雜志,2016,18(6):412-416.
[11] 孫怡園,鄧劍雄,楊悅.改進的加權關聯規則算法在識別企業生產風險的應用[J].中國藥物警戒,2017,14(6):346-349.
[12] 楊悅,鄧劍雄,孫怡園,等.一種藥品生產企業的生產風險識別的方法及自動預警系統:中國,201611081205.2[P]. 2018-06-05.
[13] 林偉強,郭曉敏,周宗梁,等.基于檢驗數據的藥品質量風險預警模型研究[J].軟件,2018,39(12):127-130.
[14] PAUL R,GARVEY P R,LANSDOWNE Z F. Risk matrix:an approach for identifying,assessing,and ranking program risks[J]. Air Force J Logist,1998,25(3):16-19.
[15] 龔青,田潔.我國化學藥品申報資料中關于生產線相關要求的審評考慮[J].中國藥學雜志,2020,55(3):239-244.
(收稿日期:2020-10-30 修回日期:2021-01-24)
(編輯:劉明偉)

