復方斑蝥膠囊聯合不同放化療方案治療原發性肝癌有效性與安全性的Meta分析及試驗序貫分析
鄺玉慧 徐方飚 趙哲 梁家琦 陳欣菊

中圖分類號 R735.7 文獻標志碼 A 文章編號 1001-0408(2021)08-0996-08
DOI 10.6039/j.issn.1001-0408.2021.08.17
摘 要 目的:系統評價復方斑蝥膠囊聯合不同放化療方案治療原發性肝癌(PHC)的有效性和安全性,旨在為臨床用藥提供循證參考。方法:計算機檢索中國生物醫學文獻數據庫、中國知網、萬方數據、維普網、PubMed、Embase、Cochrane圖書館等,檢索時限均為各數據庫建庫起至2020年9月,收集復方斑蝥膠囊聯合不同放化療方案(試驗組)對比不同放化療方案(對照組)的隨機對照試驗(RCT)、隊列研究。篩選文獻、提取資料后,采用Cochrane系統評價員手冊5.1.0推薦的偏倚風險評估工具對RCT進行質量評價;采用紐卡斯爾-渥太華量表對隊列研究進行質量評價;采用Rev Man 5.3軟件進行Meta分析,采用TSA 0.9.5.10 Beta軟件進行試驗序貫分析,采用GRADE Profiler 3.6.1證據等級質量評價工具對RCT和隊列研究進行證據質量等級評價。結果:共納入15項RCT,共計1 148例患者。Meta分析結果顯示,試驗組患者的治療有效率顯示高于對照組[RR=0.80,95%CI(0.73,0.88),P<0.000 01];按化療方案不同進行亞組分析的結果顯示,試驗組聯合肝動脈化療栓塞術(TACE)介入治療方案、三維適形放療方案患者的治療有效率均顯著高于對照組(P<0.05)。試驗組患者的生存率顯著高于對照組[RR=0.81,95%CI(0.74,0.89),P<0.000 1];按生存時間不同進行亞組分析的結果顯示,試驗組患者1年、2年、3年生存率均顯著高于對照組(P<0.05)。試驗組患者骨髓抑制發生率顯著低于對照組,自然殺傷細胞計數、T細胞亞群計數均顯著高于對照組(P<0.05);而兩組患者甲胎蛋白含量、肝功能指標比較,差異均無統計學意義(P>0.05)。試驗序貫分析結果顯示,復方斑蝥膠囊聯合TACE介入治療的治療有效率更優的證據確切。GRADE評價結果顯示,治療有效率的證據等級為中級,生存率及骨髓抑制發生率的證據等級為低級,其余指標均為極低級。結論:復方斑蝥膠囊聯合不同放化療方案用于PHC的療效顯著且安全性較好,尤以聯合TACE介入治療的療效最佳,且治療有效率的證據等級為中級。
關鍵詞 復方斑蝥膠囊;原發性肝癌;療效;安全性;Meta分析;試驗序貫分析;GRADE評價
Meta-analysis and Trial Sequential Analysis of Effectiveness and Safety of Compound Banmao Capsules Combined with Different Chemoradiotherapy in the Treatment of Primary Hepatic Carcinoma
KUANG Yuhui1,XU Fangbiao1,ZHAO Zhe2,LIANG Jiaqi3,CHEN Xinju4(1. First School of Clinical Medicine, Henan University of TCM, Zhengzhou 450046, China; 2. Second School of Clinical Medicine, Henan University of TCM, Zhengzhou 450046, China; 3. Dept. of Hepatic Disease, Beijing TCM Hospital Affiliated to Capital Medical University, Beijing 100010, China; 4. First Ward of Spleen, Stomach, Liver and Gall, the First Affiliated Hospital of Henan University of TCM, Zhengzhou 450002, China)
ABSTRACT? ?OBJECTIVE: To systematically evaluate the efficacy and safety of Compound banmao capsules combined with different chemoradiotherapy in the treatment of primary hepatic carcinoma (PHC). METHODS: Retrieved from CBM, CNKI, Wanfang database, VIP, PubMed, Embase and Cochrane Library during the inception to Sept. 2020, randomized controlled trial (RCTs), cohort study about Compound banmao capsules combined with different chemoradiotherapy plans (trial group) versus different chemoradiotherapy plans (control group) were collected. After literature screening and data extraction, the quality of included RCTs were evaluated with bias risk evaluation tool recommended by Cochrane system evaluator mannual 5.1.0. Newcastle Ottawa scale was used to evaluate the quality of cohort studies; Rev Man 5.3 software was used for Meta-analysis; TSA 0.9.5.10 Beta software was used for? trail sequential analysis, and GRADE Profiler 3.6.1 software was used for evidence quality evaluation of RCT and cohort studies. RESULTS: A total of 15 RCTs were included, involving? 1 148 patients. Meta-analysis showed that effective rate of trial group was significantly higher than that of control group [RR=0.80,95%CI(0.73,0.88),P<0.000 01]. The results of subgroup analysis according to different chemotherapy plan showed that the effective rate of trial group combined with TACE and three dimensional conformal radiotherapy were significantly higher than control group (P<0.05). The survival rate of trial group was significantly higher than control group [RR=0.81, 95%CI(0.74, 0.89), P<0.000 1]; the results of subgroup analysis according to different survival time showed that 1-year, 2-year and 3-year survival rates of trial group were significantly higher than control group (P<0.05). The incidence of myelosuppression in trial group was significantly lower than control group, and the natural killer cell count and T cell count of trial group were significantly higher than control group (P<0.05). There was no statistical significance in AFP content and liver function index between 2 groups (P>0.05). Trial sequential analysis showed that there was definite evidence for better effective rate of Compound banmao capsules combined with TACE. GRADE evaluation results showed that the evidence level of effective rate was intermediate, the evidence level of survival rate and incidence of myelosuppression was low, and other indicators were very low. CONCLUSIONS: Compound banmao capsules combined with different chemoradiotherapy in the treatment of PHC has significant efficacy and good safety, especially in combination with TACE, and the evidence level of effective rate is intermediate.
KEYWORDS? ?Compound banmao capsules; Primary hepatic carcinoma; Efficacy; Safety; Meta-analysis; Trial sequential analysis; GRADE evaluation
原發性肝癌(PHC)是常見的消化道惡性腫瘤,據2018年美國癌癥協會統計,肝癌是全球第六大常見的腫瘤,近10年來發病率呈逐年上升的趨勢,其死亡率居全球惡性腫瘤第4位,每年新發病例約84萬例、死亡約78萬例[1]。目前,PHC的治療方案主要有局部治療和全身治療。其中,局部治療包括手術切除、肝移植、射頻消融、肝動脈化療栓塞術(TACE)和放療等;全身治療包括分子靶向、免疫治療、系統化療和中醫藥治療等[2-3]。由于PHC發病較為隱匿,大部分患者在確診時已屬中晚期,失去了最佳手術治療時機[4]。雖然,西醫常規的放化療和TACE介入治療是目前PHC的有效治療方法,但上述方法會損害患者的免疫功能、肝功能,并引發骨髓抑制等不良反應[3]。
中醫藥治療肝癌具有緩解臨床癥狀、提高臨床療效、延長生存期、改善生存質量、減少放化療毒副反應等優勢[3]。多項基礎及臨床研究表明,復方斑蝥膠囊能夠抑制腫瘤細胞的增殖與分化、誘導腫瘤細胞凋亡、抑制血管生成、抑制腫瘤轉移、調節免疫等,具有扶正祛邪的雙重作用[5-6]。目前,已有研究報道指出,在西醫常規放化療、三維適形放療、TACE介入治療等基礎上加用復方斑蝥膠囊對PHC具有較好的臨床療效,但這些研究多為單中心、小樣本研究,且存在爭議[7-21]。基于此,本研究采用Meta分析的方法系統評價了復方斑蝥膠囊聯合不同放化療方案治療PHC的有效性和安全性,并結合試驗序貫分析(TSA)及證據等級質量評價工具對指標質量進行評估,旨在為臨床用藥提供循證參考。
1 資料與方法
1.1 納入與排除標準
1.1.1 研究類型 國內外公開發表的隨機對照試驗(RCT)、隊列研究;語種限定為中文和英文。
1.1.2 研究對象 均確診為PHC,均符合《原發性肝癌診斷標準》中的相關診斷標準[4]。
1.1.3 干預措施 兩組患者均給予常規基礎對癥治療,如抗感染、補液、保護臟器功能、營養支持等;對照組在此基礎上給予不同放化療方案,試驗組患者在對照組治療基礎上給予復方斑蝥膠囊。兩組患者用藥劑量、用法均不限。
1.1.4 結局指標 主要結局指標包括:①治療有效率,②生存率;次要結局指標包括:③甲胎蛋白(AFP)含量,④自然殺傷細胞(NK)計數,⑤T細胞亞群計數,如CD3+、CD4+、CD8+、CD4+/CD8+,⑥肝功能指標,如總膽紅素(TBIL)、丙氨酸轉氨酶(ALT)含量;⑦骨髓抑制發生率。按照世界衛生組織(WHO)實體瘤療效判定標準分為完全緩解(CR)、部分緩解(PR)、無變化(NC)和進展(PD),治療有效率=(CR例數+PR例數)/總例數×100%[20]。
1.1.5 排除標準 ①分組方法、研究方法不合理的文獻;②臨床干預措施不嚴謹或治療方法闡述不明確的文獻;③個案、綜述、基礎研究、會議論文;④無法獲取全文的文獻。
1.2 文獻檢索策略
計算機檢索中國生物醫學文獻數據庫(CBM)、中國知網(CNKI)、萬方數據、維普網、PubMed、Embase、Cochrane圖書館等數據庫。中文主題詞為“原發性肝癌”,自由詞為“肝腫瘤”“肝惡性腫瘤”“肝細胞癌”“肝臟腫瘤”“肝部腫瘤”“肝癌”,干預措施為“復方斑蝥膠囊”;英文主題詞為“Carcinoma hepatocellular”,自由詞為“Carcinomas hepatocellular” “Hepatocellular carcinomas”“Liver cell carcinoma”“Liver cancer”等,干預措施為“Fufang banmao capsule”。 采用主題詞結合自由詞進行檢索。檢索時限均為各數據庫建庫起至2020年9月。
1.3 文獻篩選與資料提取
由2位研究者獨立閱讀文獻,按照納入與排除標準進行文獻篩選;如遇分歧則與第3位研究者討論評判并綜合雙方意見后,再決定是否納入。提取信息包括第一作者、發表年份、患者例數、性別、療程、干預措施、結局指標等。
1.4 文獻質量評價
采用Cochrane系統評價員手冊5.1.0推薦的偏倚風險評估工具對RCT進行質量評價,具體包括隨機序列的產生、分配隱藏、研究對象和實施者的盲法、結局評估者盲法、結局數據完整性、選擇性報告結果、其他偏倚來源;每項均分為高風險、低風險和不清楚[22]。采用紐卡斯爾-渥太華量表(NOS)對隊列研究進行質量評價,具體包括研究人群的選擇、組間可比性、暴露等3個項目共8個條目(具體標準略)[23]。
1.5 統計學方法
采用Rev Man 5.3軟件對納入研究進行Meta分析。計數資料以相對危險度(RR)及其95%置信區間(CI)表示;計量資料以均數差(MD)及其95%CI表示。若各研究間統計學異質性較小(I 2<50%且P>0.1),采用固定效應模型進行分析;反之,則采取隨機效應模型進行分析。采用敏感性分析找出對異質性影響較大的文獻,并分析具體原因。采用Eggers檢驗進行發表偏倚分析。采用TSA 0.9.5.10 Beta軟件進行TSA[24]。P<0.05為差異有統計學意義。
1.6 證據等級評價
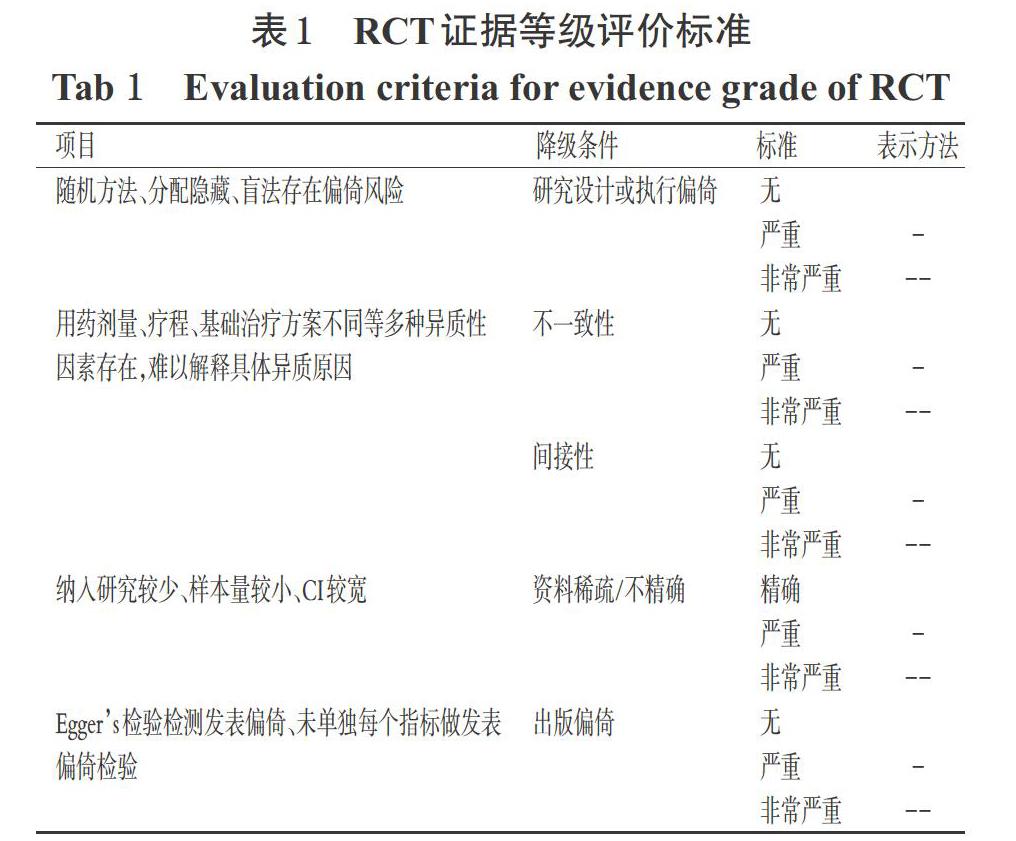
采用GRADE Profiler 3.6.1證據質量等級評價工具評價RCT和隊列研究中各結局指標,因RCT目前認為其證據等級最高,故有5個降級因素[25]。RCT證據等級評價標準見表1(表中,“表示方法”項下無降級條件符合表示“高”;1個條件符合為“-”,表示“中”,2個條件符合為“--”表示“低”,3個條件符合為“---”,表示“極低”;隊列研究的具體標準略)。
2 結果
2.1 文獻檢索結果與納入研究基本信息
初檢共獲得相關文獻210篇,經查重、閱讀標題及全文后,最終納入文獻15篇[7-21],共計1 148例患者,其中試驗組581例、對照組567例。文獻篩選流程見圖1,納入研究基本信息見表2。
2.2 納入文獻質量評價結果
15篇文獻均為RCT[7-21]。所有研究均提及隨機分組,其中7項研究[7,10-11,13-14,16,19]明確闡述了隨機分配方法(隨機數字表法或信封法);所有研究均未提及盲法,結果數據均完整,均未選擇性報告結果,均不清楚是否存在其他偏倚來源,結果見表3。
2.3 Meta分析結果
2.3.1 治療有效率 11項研究報道了患者的治療有效率[7,9,12-18,20-21]。各研究間無統計學異質性(P=0.24,I 2=21%),采用固定效應模型進行Meta分析,詳見圖2。Meta分析結果顯示,試驗組患者的治療有效率顯著高于對照組[RR=0.80,95%CI(0.73,0.88),P<0.000 01]。
按化療方案的不同進行亞組分析。Meta分析結果顯示,試驗組聯合TACE介入治療方案[RR=0.79,95%CI(0.70,0.89),P<0.000 1]、三維適形放療方案[RR=0.80,95%CI(0.69,0.93),P=0.04]患者的治療有效率均顯著高于對照組,而試驗組聯合FAP化療方案患者的治療有效率與對照組比較,差異無統計學意義[RR=0.86,95%CI(0.61,1.22),P=0.40],詳見圖2。
2.3.2 生存率 7項研究報道了生存率[8,11,14-16,20-21]。各研究間無統計學異質性(P=0.45,I 2=0),采用固定效應模型進行Meta分析,詳見圖3。Meta分析結果顯示,試驗組患者的生存率顯著高于對照組[RR=0.81,95%CI(0.74,0.89),P<0.000 1]。
按生存時間不同進行亞組分析。Meta分析結果顯示,兩組患者的6個月生存率比較,差異無統計學意義[RR=0.99,95%CI(0.85,1.16),P=0.92];試驗組患者的1年生存率 [RR=0.80,95%CI(0.69,0.93),P=0.004]、2年生存率[RR=0.77,95%CI(0.64,0.93),P=0.007]、3年生存率[RR=0.52,95%CI(0.30,0.92),P=0.02]均顯著高于對照組,詳見圖3。
2.3.3 AFP含量 3項研究報道了AFP含量[7-9]。各研究間有統計學異質性(P<0.000 1,I 2=91%),采用隨機效應模型進行Meta分析,詳見圖4。Meta分析結果顯示,兩組患者的AFP含量比較,差異無統計學意義[MD=22.08,95%CI(-1.28,45.43),P=0.06]。
2.3.4 NK細胞計數 3項研究報道了患者的NK細胞計數[10-11,19]。各研究間無統計學異質性(P=0.79,I 2=0),采用固定效應模型進行Meta分析,詳見圖5。Meta分析結果顯示,試驗組患者的NK細胞計數顯著高于對照組[MD=-3.89,95%CI(-4.70,-3.09),P<0.000 01]。
2.3.5 T細胞亞群計數 6項研究報道了T細胞亞群計數[9-11,14,17,19]。各研究間有統計學異質性(P<0.000 01,? I 2=99%),采用隨機效應模型進行Meta分析,詳見圖6。Meta分析結果顯示,試驗組患者的T細胞亞群計數顯著高于對照組[MD=-1.96,95%CI(-2.56,-1.36),P<0.000 01]。
按T細胞的不同進行亞組分析。Meta分析結果顯示,試驗組患者CD3+細胞計數[MD=-4.60,95%CI(-8.80,? -0.40),P=0.03]、CD4+細胞計數 [MD=-3.32,95%CI(-6.26,-0.38),P=0.03]、CD4+/CD8+[MD=-0.18,95%CI(-0.31,-0.05),P=0.006]均顯著高于對照組;兩組患者CD8+細胞計數比較,差異無統計學意義[MD=-1.78,95%CI(-4.15,0.59),P=0.14],詳見圖6。
2.3.6 肝功能指標 4項研究報道了肝功能指標[8-10,19]。各研究間有統計學異質性(P<0.000 01,I 2=97%),采用隨機效應模型進行Meta分析,詳見圖7。Meta分析結果顯示,兩組患者的肝功能指標含量比較,差異無統計學意義[MD=4.09,95%CI(-5.02,13.20),P=0.38]。
按肝功能指標的不同進行亞組分析。Meta分析結果顯示,兩組患者TBIL含量[MD=-0.31,95%CI(-3.20,2.57),P=0.83]、ALT含量[MD=7.39,95%CI(-8.58,23.37),P=0.36]比較,差異均無統計學意義,詳見圖7。
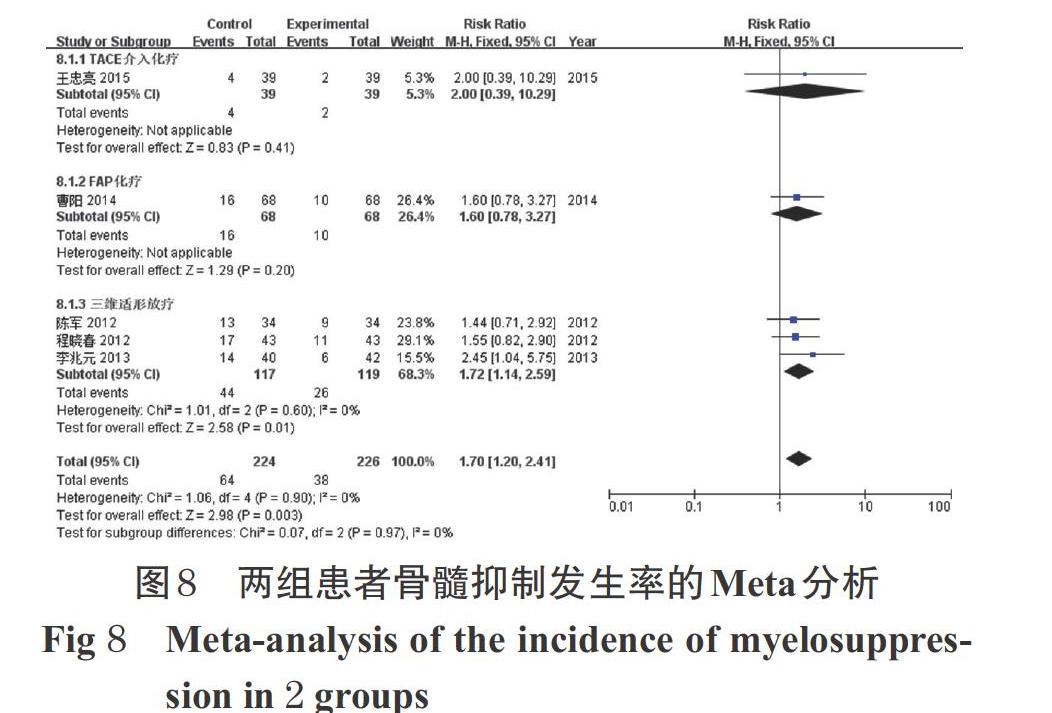
2.3.7 骨髓抑制發生率 5項研究報道了骨髓抑制發生率[12-16]。各研究間無統計學異質性(P=0.90,I 2=0),采用固定效應模型進行Meta分析,詳見圖8。Meta分析結果顯示,試驗組患者的骨髓抑制發生率顯著低于對照組[RR=1.70,95%CI(1.20,2.41),P=0.003]。
按化療方案的不同進行亞組分析。Meta分析結果顯示,試驗組聯合三維適形放療患者的骨髓抑制發生率顯著低于對照組[RR=1.72,95%CI(1.14,2.59),P=0.01]。因TACE介入治療和FAP化療方案亞組各僅有1項研究[13-14],故對結果進行描述性分析,試驗組聯合TACE介入治療和FAP化療方案患者的骨髓抑制發生率與對照組比較,差異均無統計學意義(P>0.05),詳見圖8。
2.4 敏感性分析
以治療有效率為指標進行敏感性分析,逐一剔除文獻,發現在剔除李兆元等[14]的研究后,三維適形放療亞組的統計學異質性降為(P=0.70,I 2=0);剔除后,試驗組聯合三維適形放療患者的治療有效率仍顯著高于對照組。以生存率為指標進行敏感性分析,逐一剔除文獻,發現各亞組的異質性無改變。
2.5 發表偏倚分析
分別以治療有效率、生存率為指標,采用Eggers檢驗進行發表偏倚分析,結果見圖9。由圖9可見,治療有效率Eggers檢驗的P=0.089>0.05,提示本研究存在發表偏倚的可能性較小;生存率Eggers檢驗的P=0.041<0.05,提示本研究存在發表偏倚的可能性較大。
2.6 TSA
本研究設定Ⅰ類錯誤概率α=0.05、Ⅱ類錯誤概率為β=0.2,以樣本量為期望信息值(RIS)。根據治療有效率的Meta分析結果對3個亞組進行TSA,結果見圖10。由圖10可見,FAP化療方案組的累積Z值在納入文獻[13,17]時穿過了TSA界值,但未穿過傳統界值,提示試驗組聯合FAP化療方案患者的治療有效率與對照組比較,差異無統計學意義的結果為真陰性。三維適形放療組的累積Z值在納入剩余兩篇文獻[15-16]時穿過了傳統界值,但未穿過TSA界值,提示試驗組聯合三維適形放療患者的治療有效率與對照組比較,差異有統計學意義的結果為假陽性的可能性較大,有待進一步驗證。TACE介入治療組的累積Z值在納入最后一篇文獻[7]時,已達到所需樣本量(RIS=436),即穿過了TSA界值,也穿過了傳統界值,提示試驗組聯合TACE介入治療患者的治療有效率顯著高于對照組的證據確切[23]。
2.7 GRADE證據質量等級評價
采用GRADE Profiler 3.6.1證據質量等級評價工具對結局指標進行證據質量評價,結果見表4。由表4可見,治療有效率的證據等級為中級,生存率及骨髓抑制發生率的證據等級為低級,其余指標均為極低級。
3 討論
PHC屬中醫“臌脹、癥瘕、積聚”范疇[3]。《素問五臟生成論》曰:“肝藏,心行之,人動則血運于諸經,人靜則血歸于肝臟,……肝主血海故也”,提示其病機演變過程為腫瘤毒邪在體內蘊藏,入絡客于血脈,影響氣、血、津、液的運行及輸布;此外,肝氣易郁結,常處于氣郁血凝狀態,使脈絡失于流暢,導致毒滯絡積聚,引起絡中氣滯、血瘀或津凝等病理改變[26]。復方斑蝥膠囊由斑蝥、人參、黃芪、三棱、刺五加、半枝蓮、莪術、山茱萸、熊膽粉、女貞子和甘草等11味藥材組成,方中斑蝥攻毒蝕瘡,逐瘀散結為君藥;莪術、三棱共為臣藥,以加強斑蝥活血化瘀之功;人參、黃芪、刺五加、山茱萸、女貞子健脾補腎、補益氣血、滋補肝腎、養陰生精,五藥合用可驅邪而不傷正、并防止瘀毒擴散[27];半枝蓮、熊膽粉為佐藥,能清熱解毒,化瘀利尿,助君藥攻毒蝕瘡;甘草調和諸藥,為使藥[28]。整方組合上扶正祛邪、攻補兼施,進而調節機體整體與局部的陰陽平衡,多用于治療肝癌、肺癌、直腸癌、卵巢癌等相關疾病[29]。現代藥理學研究表明,斑蝥所含的多種成分均具有抗腫瘤的特性,其主要活性成分斑蝥素可干擾腫瘤細胞核酸及蛋白質代謝,能明顯抑制多種動物移植性腫瘤,具有抗癌作用[5,30]。
本研究結果顯示,試驗組在提高治療有效率、生存率和NK細胞計數、T細胞計數(CD8+除外)、降低骨髓抑制發生率方面均顯著優于對照組;在損害肝功能、降低AFP含量方面則無明顯優勢。敏感性分析結果顯示,在以治療有效率為指標進行的敏感性分析中發現,李兆元等[14]的研究為主要異質性來源;以生存率為指標進行敏感性分析,逐一剔除文獻后,異質性無改變。發表偏倚分析結果顯示,以治療有效率為指標時提示本研究存在發表偏倚的可能性較小,以生存率為指標時提示本研究存在發表偏倚的可能性較大。TSA結果顯示,試驗組聯合三維適形放療方案治療有效率結果存在假陽性可能,需擴大樣本量進一步證實;試驗組聯合FAP化療方案治療有效率的結果為真陰性;試驗組聯合TACE介入治療組患者的治療有效率顯著高于對照組的證據確切。GRADE證據評價結果顯示,治療有效率的證據等級為中級,生存率及骨髓抑制發生率的證據等級為低級,其余指標均為極低級。
綜上所述,復方斑蝥膠囊聯合不同放化療方案用于PHC的療效顯著且安全性較好,尤以聯合TACE介入治療的療效最佳,且治療有效率的證據等級為中級。 但鑒于其余指標的證據等級不高,提示本研究仍存在偏倚的可能性。本研究局限性包括:(1)僅有7項研究明確了隨機分配方法,其余雖提及隨機分配但均未闡明具體方法,且無任一文獻提及盲法和分配隱藏;(2)部分結局指標納入的文獻數量和患者例數較少;(3)西醫常規治療方案較為寬泛,對癥治療的措施因地域的差異而有所不同,可能會造成偏倚,從而影響最終結果的準確性。因此,結論仍需更多高質量、多中心、大樣本的RCT進一步驗證。
參考文獻
[ 1 ] BRAY F,FERLAY J,SOERJOMATARAM I,et al. Glo- bal cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2018,68(6):394-424.
[ 2 ] 江杰,胡宗強,陳剛,等.原發性肝癌轉化治療研究進展[J].臨床肝膽病雜志,2020,36(8):1870-1873.
[ 3 ] 吳玉瀟,盛慶壽.中醫藥治療原發性肝癌的研究進展[J].廣西醫學,2020,42(4):483-485.
[ 4 ] 中國抗癌協會肝癌專業委員會.原發性肝癌診斷標準[J].中華肝臟病雜志,2000,8(3):135.
[ 5 ] 田劭丹,陳信義.中醫藥治療惡性腫瘤特色與優勢[J].現代中醫臨床,2019,26(2):8-17.
[ 6 ] 謝俊大,趙奎君,鐘萌.復方斑蝥膠囊的藥理與臨床研究概況[J].國際中醫中藥雜志,2011,33(10):954-955.
[ 7 ] 洪桂花,陳思環,黃珊.復方斑蝥膠囊對原發性肝癌患者免疫功能及臨床療效的影響[J].世界中西醫結合雜志,2020,15(2):365-368、373.
[ 8 ] 龍芳芳.觀察疏肝健脾散結湯、復方斑蝥膠囊聯合應用于原發性肝癌介入術后患者肝功能及生存率的影響[J].健康大視野,2020,(21):81、83.
[ 9 ] 趙士沖,謝長遠,姚平剛.復方斑蝥膠囊對原發性肝癌介入治療后細胞免疫功能的效果及機制[J].中華中醫藥學刊,2019,37(11):2785-2787.
[10] 趙延軍,單宇鵬.復方斑蝥膠囊對原發性肝癌患者介入治療后細胞免疫功能的影響[J].陜西中醫,2018,39(1):77-79、134.
[11] 靳松,黃兆明,吳春明.復方斑蝥聯合恩替卡韋治療乙肝相關性肝癌TACE術后效果及對免疫功能、VEGF的影響[J].浙江中西醫結合雜志,2018,28(11):939-941.
[12] 王忠亮.聯用復方斑蝥膠囊和TACE對中晚期原發性肝癌患者進行治療的效果分析[J].當代醫藥論叢,2015,13(22):260-261.
[13] 曹陽.復方斑蝥膠囊治療原發性肝癌的有效性、安全性及經濟性評價[J].中國醫院用藥評價與分析,2014,14(8):711-713.
[14] 李兆元,寧四清,易鐵男,等.復方斑蝥膠囊聯合化療及放療治療中晚期原發性肝癌的療效觀察[J].中華全科醫學,2013,11(8):1250-1251.
[15] 陳軍,陳典.復方斑蝥膠囊聯合三維適形放療治療中晚期原發性肝癌臨床觀察[J].現代腫瘤醫學,2012,20(1):114-116.
[16] 程曉春,陳俊,郭建新,等.三維適形放療聯合復方斑蝥膠囊治療中晚期原發性肝癌[J].中國基層醫藥,2012,19(18):2827-2828.
[17] 彭文達.復方斑蝥膠囊聯合化療治療中晚期原發性肝癌的臨床療效觀察[J].腫瘤藥學,2011,1(6):518-519、543.
[18] 雷飛飛,李芳,譚華炳.復方斑蝥膠囊聯合肝動脈栓塞化療治療原發性肝癌療效觀察[J].山西醫藥雜志,2011,40(10):1030-1031.
[19] 殷飛,李進軍,曹鳳,等.復方斑蝥膠囊對肝癌患者TACE治療前后細胞免疫功能的影響[J].世界華人消化雜志,2011,19(17):1843-1846.
[20] 徐虎.復方斑蝥膠囊對晚期原發性肝癌生存率的影響[J].湖北中醫雜志,2009,31(4):23-24.
[21] 李秋,陳紅,張孟瑜.復方斑蟊膠囊聯合肝動脈化療栓塞治療中晚期肝癌[J].中國中西醫結合外科雜志,2005,11(2):130-131.
[22] 谷鴻秋,王楊,李衛. Cochrane偏倚風險評估工具在隨機對照研究Meta分析中的應用[J].中國循環雜志,2014,29(2):147-148.
[23] 夏蕓,孫瑛,劉兆蘭,等.系統綜述或Meta分析的樣本量估算:試驗序貫分析[J].北京中醫藥大學學報(中醫臨床版),2013,20(5):31-33.
[24] 曾憲濤,冷衛東,李勝,等.如何正確理解及使用GRADE系統[J].中國循證醫學雜志,2011,11(9):985-990.
[25] 鄺玉慧,陳欣菊,徐方飚.金龍膠囊聯合放化療治療肝轉移瘤的療效與安全性Meta分析[J].腫瘤防治研究,2020,47(1):63-69.
[26] 高舒,華海清.中醫藥在肝癌免疫治療中的研究進展[J].現代腫瘤醫學,2013,21(6):1384-1387.
[27] 趙駿.復方斑蝥膠囊與吉非替尼聯合對非小細胞肺癌患者療效評價[J].中成藥,2019,41(4):959-962.
[28] 姜洋,牛曉輝,高葉梅.復方斑蝥膠囊聯合化療治療經典型骨肉瘤30例[J].中國中醫骨傷科雜志,2020,28(2):63-65.
[29] 曾瑤波,劉曉玲,李創軍,等.斑蝥化學成分及體外抗腫瘤活性研究[J].中國中藥雜志,2016,41(5):859-863.
(收稿日期:2020-11-21 修回日期:2021-02-25)
(編輯:陳 宏)

