外泌體介導miR-106a靶向Smad7調控間皮細胞MMT對胃癌腹膜轉移的影響
朱 萌,張 寧,陶 偉
腹膜轉移是進展期胃癌最常見的轉移方式。關于腹膜轉移,目前推測胃癌細胞、腹膜屏障之間的溝通與“對話”是形成移植瘤的關鍵,而在此之間起著傳遞“對話”作用的外泌體可能具有非常重要的作用。外泌體是一種細胞外物質,由腫瘤細胞分泌的外泌體稱為腫瘤源性外泌體(tumor-derived exosomes, TDEs),在其生成和釋放過程中可以攜帶原發腫瘤重要信息物質miRNA,隨外泌體以旁分泌的方式擴散到周圍細胞或環境中,或經循環系統運輸至遠隔器官,目的性地調整受體細胞的信號轉導,參與并促進癌組織的侵襲、轉移[1-2]。然而,外泌體是否參與胃癌的腹膜轉移,外泌體在其中發揮的作用及機制,尚未有統一認識。腹膜是癌細胞種植的場所,但癌細胞如何改造或調整以使其適宜于自身的種植尚有待于闡明。隨著外泌體研究不斷深入,證實胃癌細胞分泌的TDEs高表達miR-106a,TDEs搭載miR-106a進入腹腔,在miR-106a與靶標的作用下引發腹膜屏障損壞,腹膜間皮細胞形態與功能發生改變,有可能參與腹膜轉移的過程[3]。本實驗基于以上理論,擬在分子水平探討TDEs-miR-106a-Smad7參與胃癌腹膜轉移的可能機制。
1 材料與方法
1.1 主要材料、設備細胞培養:RPMI-1640培養基(Hyclone公司),胎牛血清(Gibco公司),青鏈霉素,胰蛋白酶(Genview公司)。轉染:Lipofectamin 2000(Invitrogen公司),hsa-miR-106a mimic(Genepharma公司)。試劑盒:外泌體提取試劑盒(Invitrogen公司),EdU檢測試劑盒(Ribobio公司)。其它試劑:Transwell小室(Costor公司),GW788388 Hydrate(Sigma公司),Recombinant Human TGF-β Protein(Sigma公司)。Western blot抗體:Smad7兔多克隆抗體(Proteinteck公司),SMA兔多克隆抗體(SAB公司),Fibronectin兔多克隆抗體(Abcam公司),E-cadherin、N-cadherin兔多克隆抗體(Immunoway公司)。
1.2 外泌體提取培養高轉移能力人胃癌細胞系AGS,無血清培養基處理2天后,吸取細胞上清液置于離心管內,2 000 r/min離心20 min,采用微孔濾膜過濾,按1 ∶2比例加入外泌體提取試劑至細胞上清液中,顛倒混勻;4 ℃過夜;次日4 ℃ 10 000g離心1 h,棄上清,PBS重懸,獲得PBS-Exos。
1.3 細胞造模實驗分組:(1)HMrSV5、HMrSV5+Exos-control、HMrSV5+Exos-NC、HMrSV5+Exos-mimic;(2)HMrSV5、HMrSV5+Exos-TGF-β、HMrSV5+Exos-GW788388;(3)HMrSV5+TGF-β+Exos+OE-NC、HMrSV5+TGF-β+Exos+OE-Smad7。將獲得的PBS-Exos(8 μg)與HMrSV5細胞共培養48 h,分別加入miRNA mimic轉染試劑、10 ng/mL TGF-β、10 μmol/L TGF-β抑制劑GW788388、過表達質粒pCMV-Smad7。
1.4 細胞轉染取生長至80%的細胞,PBS洗滌2次,加入胰蛋白酶消化液,制備單細胞懸液;按每毫升5×105個接種6孔培養板,37 ℃、5%CO2常規培養過夜;次日制備轉染溶液:250 μL MEM中加入5 μL miRNA,柔和混勻;250 μL MEM中加入5 μL Lipofectamine 2000,柔和混勻;放置5 min后將兩者混合,再放置20 min,形成RNA/Lipofectamine 2000復合物;加入細胞板中,繼續孵育4 h,更換完全培養基,培養48 h,進行后續實驗。
1.5 EdU檢測細胞增殖能力取上述處理后的細胞,消化離心后置于96孔板,每孔加入100 μL濃度為50 μmol/L EdU培養基孵育2 h,PBS洗滌2次,每次5 min;加入50 μL 4%多聚甲醛室溫固定30 min;按順序加入2 mg/mL甘氨酸溶液50 μL,0.5%TritonX-100滲透液100 μL,1×Apollo染色液100 μL,0.5%TritonX-100滲透液100 μL,甲醇溶液100 μL,PBS洗滌;加入1×Hoechst 33342反應液100 μL,室溫避光孵育30 min,PBS洗滌,Leica DMI6000B倒置顯微鏡觀察拍照。每組3個復孔。
1.6 Western blot法檢測蛋白表達取6孔板中常規培養的HMrSV5細胞,PBS洗滌后加入PMSF裂解液(稀釋比1 ∶100),將細胞裂解液吸入EP管,4 ℃ 14 000 r/min離心10 min。取蛋白行BCA法定量,并繪制標準曲線。SDS-PAGE凝膠電泳分離蛋白,蛋白上樣量為20 μg,電泳耗時1.5 h。然后轉膜至PVDF膜,電流300 mA。取出TBS漂洗,5%脫脂奶粉-TBS封閉,4 ℃搖床過夜。次日取出TBS洗膜,加一抗Smad7(稀釋比1 ∶1 000)、SMA(稀釋比1 ∶2 000)、Fibronectin(稀釋比1 ∶1 000)、E-cadherin(稀釋比1 ∶1 000)、N-cadherin(稀釋比1 ∶1 000)、GAPDH(稀釋比1 ∶10 000)室溫孵育1 h,TBST洗滌,加HRP標記山羊抗兔二抗IgG,TBST洗滌,ECL化學發光,凝膠圖像分析。
1.7 Transwell實驗檢測細胞遷移HMrSV5細胞無血清培養基培養12 h,按每毫升2×105個細胞100 μL加入24孔培養板中的Transwell小室,下室加入700 μL含有10%FBS的完全培養基,常規培養48 h;取出刮取小室上層細胞,PBS洗滌后,4%多聚甲醛固定20 min,置入結晶紫染色液中5 min,流水沖洗,封固,OLYMPUS CX41正置顯微鏡取6個互不重疊視野,用IPP軟件進行細胞計數。
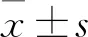
2 結果
2.1 胃癌細胞分泌外泌體傳遞miR-106a對間皮細胞增殖的影響采用胃癌細胞系AGS來源的外泌體,作用于腹膜間皮細胞HMrSV5,觀察間皮細胞在外泌體miR-106a作用下的表型改變。EdU檢測結果顯示,與Control組相比,Exos-control與Exos-mimic組陽性著色細胞數減少(圖1),且以后者為甚,初步表明腹膜間皮細胞在AGS-Exos的作用下增殖活力減弱,外泌體傳遞miR-106a具有抑制腹膜間皮增殖的能力。
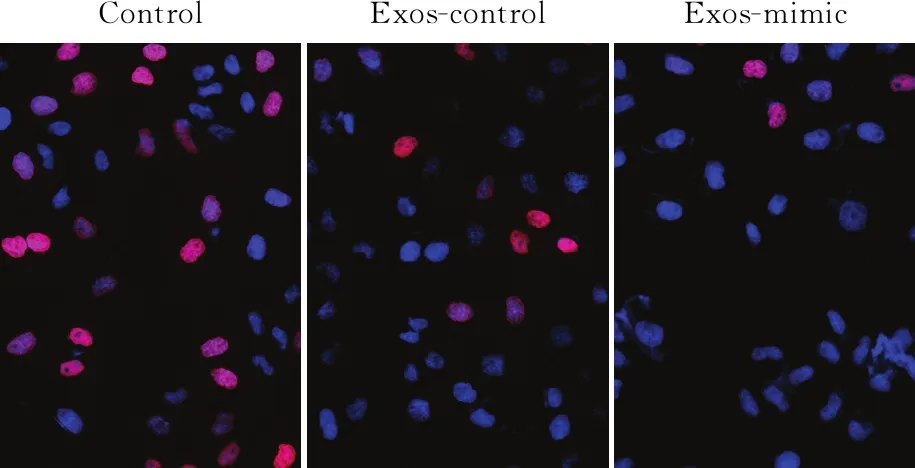
ControlExos-controlExos-mimic
2.2 外泌體介導miR-106a-Smad7對間皮細胞間質性轉化(mesothelial-to-mesenchymal transition, MMT)的影響前期已經證實miR-106a直接靶基因Smad7,為進一步分析外泌體作用下間皮細胞的基因表達,采用Western blot法檢測Smad7及相關蛋白表達,結果顯示,HMrSV5細胞在給予外泌體處理后,Smad7、E-cadherin表達下降,N-cadherin表達升高(圖2),四組間相比差異均有統計學意義(FSmad7=228.420,FE-cadherin=118.699,FN-cadherin=461.912,P均<0.000 1)。提示miR-106a-Smad7在外泌體作用下可能影響間皮細胞MMT。
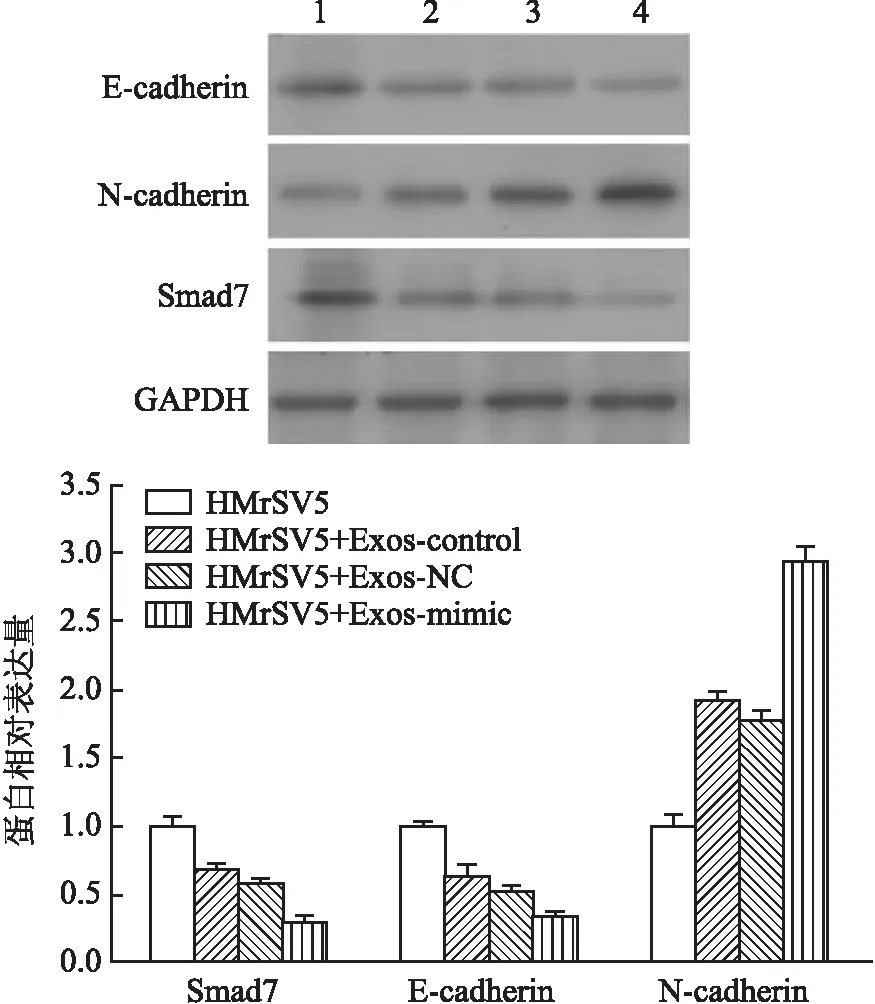
圖2 Western blot法檢測Smad7、E-cadherin、N-cadherin的表達:
2.3 TGF-β干預對間皮細胞增殖、MMT的影響TGF-β是細胞MMT轉化的關鍵信號分子。給予TGF-β抑制劑GW788388后,EdU檢測HMrSV5細胞增殖活力的變化,結果顯示,與Control組相比,給予Exos-TGF-β處理后,HMrSV5細胞增殖活力下降,但給予Exos-GW788388后,細胞增殖活力有所恢復(圖3),說明TGF-β誘導的信號可能參與間皮細胞表型的改變。Western blot法檢測顯示,Exos-TGF-β處理后,SMA、Fibronectin表達升高;但當給予Exos-GW788388后,SMA、Fibronectin表達降低(圖4),三組差異均有統計學意義(FSMA=61.449,FFibronectin=665.186,P均<0.000 1);提示間皮細胞表型和MMT的改變可能是TGF-β信號所誘導。
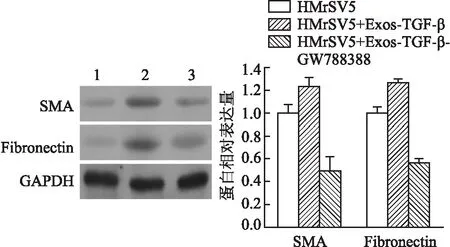
圖4 Western blot法檢測SMA、Fibronectin的表達:1.HMrSV5;2.HMrSV5+Exos-TGF-β;3.HMrSV5+Exos-TGF-β-GW788388
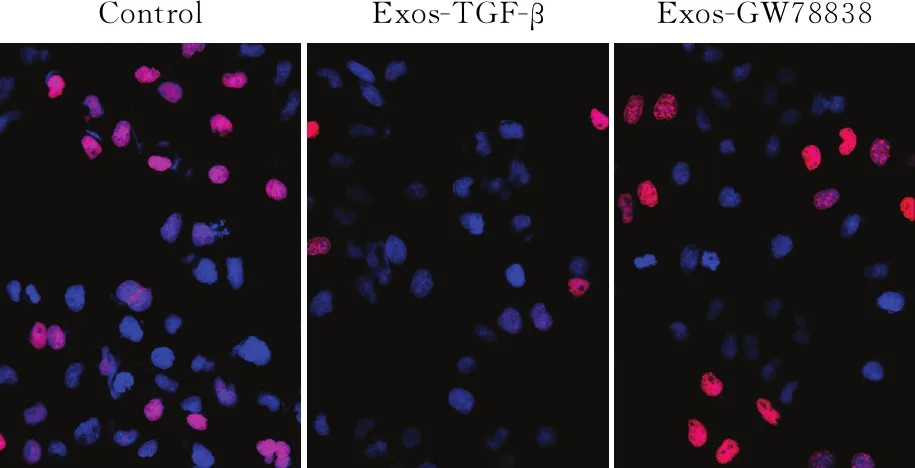
ControlExos-TGF-βExos-GW78838
2.4 Smad7過表達逆向觀察間皮細胞MMT及遷移能力AGS-Exos與pCMV-Smad7共同作用于HMrSV5細胞,再用TGF-β處理,逆向觀察靶基因的表達改變能否影響TGF-β/Smad7信號通路和間皮細胞表型。采用Western blot法檢測MMT相關蛋白表達,結果顯示,Smad7過表達組SMA、Fibronectin表達下降(圖5),兩組相比差異均有統計學意義(tSMA=7.772,P=0.001;tFibronectin=13.194,P<0.000 1)。Transwell實驗檢測顯示,給予Smad7過表達后,HMrSV5遷移能力下降,穿膜細胞數顯著低于對照組(圖6),差異有統計學意義(t=20.094,P<0.000 1),表明Smad7的過表達可以抑制外泌體介導的間皮細胞MMT。
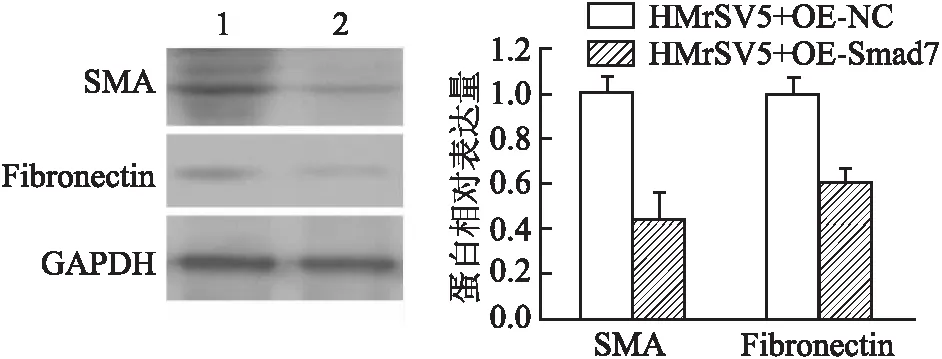
圖5 Western blot法檢測SMA、Fibronectin表達:1.HMrSV5+TGF-β+Exos+OE-NC;2.HMrSV5+TGF-β+Exos+OE-Smad7

圖6 Transwell實驗檢測細胞的遷移能力
3 討論
外泌體是由細胞所分泌的小的細胞器,富含選定的蛋白、脂類、核酸和糖復合物。在其生物發生過程中,通過質膜內陷和出芽釋放,具有重塑細胞外基質、傳遞信號、調控生命活動等作用,在人體發育、免疫、內穩態、腫瘤等疾病中發揮重要作用[4]。研究顯示,核酸類物質由外泌體在宿主細胞和受體細胞之間的傳遞可能影響了腫瘤細胞的生物學進程,包括轉移等,如三陰型乳腺癌細胞外泌體在乏氧條件下通過傳遞miR-221/222基因簇促進癌細胞上皮-間質轉化(epithelial-mesenchymal transition, EMT),遷移和侵襲能力加強[5]。巨噬細胞源性外泌體包裹miR-223對胃癌細胞轉移的影響在于靶向PTEN激活PI3K/AKT信號通路促進癌的侵襲[6]。本組前期實驗亦發現,胃癌中特異性表達的miR-106a富集于外泌體中,胃癌細胞源性外泌體包裹miR-106a可能與癌的腹膜轉移相關[3],但是對于TDEs-miR-106a-靶標模式如何調控腹膜轉移以及參與腹膜轉移的哪一方面尚未完全闡明。
胃癌腹膜轉移是一種器官特異性的轉移方式。腹膜微環境的構建是打造適宜于腫瘤細胞種植的必要前提[7]。而腫瘤細胞可分泌外泌體,一定程度上充當了先鋒或可以對腹膜局部微環境的構建起一定的促成作用。腹膜是一層由表層的間皮構成的屏障,生理上起著阻隔癌或其它感染源侵入的作用,但如果這種刺激長期存在就有可能使間皮細胞發生轉化,如長期腹膜透析的慢性腎臟病患者腹膜纖維化的發生就是由于間皮細胞的EMT[8]。目前,腫瘤轉移對間皮的影響尚未有詳細的報道。有限的研究顯示,間皮細胞MMT對間皮完整性的破壞、增殖凋亡紊亂、間質性轉化的調控和誘導作用參與腫瘤轉移前微環境的構建[9-10]。Li等[11]報道外泌體miR-21-5p自胃癌細胞分泌后,被人腹膜間皮細胞內化,MGC-803、SGC-7901外泌體均可以導致間皮遷移能力增強,miR-21 mimic促進該作用,inhibitor抑制該作用,且間皮細胞MMT導致裸鼠腹膜轉移灶的增大。本實驗采用人胃腺癌細胞系AGS富集外泌體,作用于間皮細胞HMrSV5,初步表明TDEs-miR-106a促進間皮細胞表型改變,表現為細胞增殖活力減弱。關于間皮細胞MMT的研究,文獻報道高轉移能力肝癌細胞分泌外泌體miR-1247靶向B4GALT3激活NF-κB通路,促使肺正常纖維細胞轉化為腫瘤相關成纖維細胞(carcinoma-associated fibroblasts, CAFs),活化的CAFs進一步分泌細胞因子IL-6/8促進腫瘤生長,形成肺轉移灶[12]。本實驗在TDEs-miR-106a的作用下,檢測miR-106a靶基因及MMT相關蛋白表達,發現Smad7表達的同時伴隨上皮性標志物E-cadherin和間質性標志物N-cadherin表達異常。可見,外泌體影響腫瘤轉移的過程應包含傳遞miR-106a誘導間皮間質化的步驟。
Smad7是TGF-β/Smad信號通路的抑制因子,參與TGF-β應答反應的負反饋調節[13]。為驗證TDEs-miR-106a是否通過該靶點對間皮細胞產生功能調控作用,本實驗采用TGF-β干預檢測間皮細胞表型、功能和MMT蛋白表達,結果顯示:TGF-β明顯減弱HMrSV5細胞增殖活力,并促使間質標志物SMA、Fibronectin表達升高,說明TGF-β信號參與調控腹膜間皮細胞表型。以上作用在合并外泌體TGF-β抑制劑處理后,可見部分恢復HMrSV5細胞的增殖和MMT轉化。此外,從逆向思維證實,Smad7的過表達也使得間質性標志物SMA、Fibronectin表達下降,間皮的遷移能力減弱,部分逆轉了間皮在TDEs-miR-106a作用下所發生的表型和MMT改變。進一步說明外泌體介導miR-106a靶向Smad7調控間皮細胞MMT,參與腹膜轉移的過程。
腫瘤轉移是腫瘤性疾病發展到頂峰的極盛狀態。外泌體實驗結果初步證實其作為一種必要的介質為胃癌細胞和腹膜之間的“對話”搭建了橋梁,有可能在一定程度上促成了種植反應。本實驗結果表明,TDEs-miR-106a-Smad7的構成模式可能通過調控間皮細胞MMT,參與促進胃癌腹膜轉移。

