Zn-MAF-6 修飾碳糊電極靈敏測定Pb2+的研究
朱 皓,劉 潔,張錢麗
(蘇州科技大學 化學與生命科學學院,江蘇 蘇州 215009)
重金屬鉛離子具有毒性強、不可生物降解和生物累積性等特點,對神經系統、骨骼造血功能和消化系統均有危害[1]。兒童對鉛尤其敏感,研究表明兒童的智力發展水平隨Pb 污染程度的加大而下降。日常生活中,人們接觸Pb 的途徑多種多樣,可能來自于土壤、塵埃、被污染的生物體、采礦煉鐵及蓄電池等行業排出的廢水。
原子吸收光譜法[2]和原子發射光譜法[3]是兩種檢測Pb2+常用方法,與原子光譜法相比,電化學檢測方法不僅靈敏度高,響應快,還具有儀器簡單、檢測成本低、可發展在線監測等優點[4],因此受到廣泛關注。
在電化學檢測中,電極是影響檢測性能的重要因素。碳糊電極(carbon paste electrode,CPE)由于具有成本低、殘余電流小、表面易更新等優點,被廣泛用于重金屬離子的檢測。為提高碳糊電極測定重金屬離子的靈敏度和穩定性,研究者還發展了碳糊修飾電極。例如Oularbi 等[5]制備了由一種離子液體、碳纖維和鉍顆粒組成的納米復合材料修飾碳糊電極(BiPs-CNFs/[EMIM]-[NTf2]/CPE)實現了Pb2+和Cd2+的靈敏檢測,Pb2+的檢出限為0.12 μg·L-1。Moutcine 等[6]采用浸漬法制備了NP-Al2O3粉體,采用循環伏安法和方波伏安法研究了NP-Al2O3/CPE 修飾電極對Pb2+和Hg2+的電化學響應,對Pb2+的檢測限為0.76 nmol·L-1。
金屬有機框架(Metal organic frameworks,MOFs)是一類由無機金屬離子或團簇與有機配體形成的結晶性多孔材料,具有高的比表面積和孔隙率,且孔道結構可調,在氣體儲存、催化、吸附等領域有廣泛應用[7]。金屬偶氮類框架材料(Metal azolate frameworks,MAFs)是MOFs 家族中的一個重要分支,有MAF-3、MAF-4、MAF-5、MAF-6 和MAF-32 等異構體,人們對MAF-3、MAF-4 的應用研究比較多,但其孔隙比較小。2015 年He 等[8]系統研究了MAF-6 的合成,表明Zn-MAF-6 是以Zn2+為中心離子簇,與兩個2-乙基咪唑配體組成的十二面體三維結構,具有較大的孔隙、較強的憎水性能和良好的穩定性,且具有優異的吸附性能。
筆者成功合成了Zn-MAF-6,并構建Zn-MAF-6/CPE,基于陽極溶出伏安原理,在負電位下富集Pb2+后,用差示脈沖伏安法進行陽極溶出,能夠靈敏檢測溶液中的Pb2+。Zn-MAF-6/CPE 具有制備簡單、靈敏度高、穩定性好和檢出限低等優點。
1 實驗部分
1.1 試劑與儀器
Zn(OH)2、NH3·H2O、H2SO4、HAc、NaAc、甲醇、甲基硅油購于上海潤捷化學試劑有限公司,2-乙基咪唑、環乙烷、石墨粉購于阿拉丁試劑有限公司,藥品純度均為分析純。
RST5000 電化學工作站(蘇州瑞思泰電子有限公司),DHG-9030A 電熱恒溫鼓風干燥箱(上海精宏實驗設備有限公司),ALC-1104 電子天平(德國賽多利斯股份公司),GL21M 高速離心機(長沙湘智離心機儀器有限公司),79-1 磁力加熱攪拌器(金壇市科析儀器有限公司)。
1.2 Zn-MAF-6 的制備
Zn-MAF-6 的合成[8]:將新制備的Zn(OH)2(2 mmol)溶于40 mL 濃氨水(25%)中,記為溶液A。將2-乙基咪唑(4 mmol)溶于30 mL 甲醇-環乙烷(6.66%,v/v)的預混溶液中,記為溶液B。將溶液A 快速加入溶液B中,室溫攪拌30 min,過濾收集白色沉淀,用甲醇洗滌,60 ℃下真空干燥。
1.3 Zn-MAF-6/CPE 的制備
Zn-MAF-6/CPE 的制備:稱取0.38 g 石墨粉、0.012 g Zn-MAF-6 和0.20 g 甲基硅油在瑪瑙研缽中充分混合均勻,將得到的碳糊緊實地填充到含銅導線的聚四氟乙烯管的電極孔中(直徑為3 mm),用稱量紙將電極表面打磨至光滑。純碳糊電極制作方法和上述方法類似。
1.4 Pb2+的檢測
電化學三電極體系:以碳糊修飾電極或碳糊電極為工作電極,Pt 絲電極為對電極,Ag/AgCl 為參比電極。在0.2 mol·L-1NaAc-HAc 緩沖液(pH=4.8)中,于-1.2 V 處攪拌富集200 s,靜置20 s,在-0.8~-0.4 V 電位范圍用差示脈沖伏安法進行陽極溶出,記錄溶出伏安曲線,每個樣品測量三次。每次測量后在空白溶液中掃描以活化工作電極。
2 結果與討論
2.1 材料表征
用XRD 表征Zn-MAF-6 的晶體結構,結果如圖1 所示。圖1 中曲線a 是文中合成Zn-MAF-6 的XRD衍射圖,曲線b 是標準品(購于西安齊岳生物科技有限公司)的XRD 衍射圖,由圖1 可知兩者特征衍射峰位置基本一致,且與文獻[8]報道Zn-MAF-6 的XRD 譜圖基本一致,表明成功合成了Zn-MAF-6。
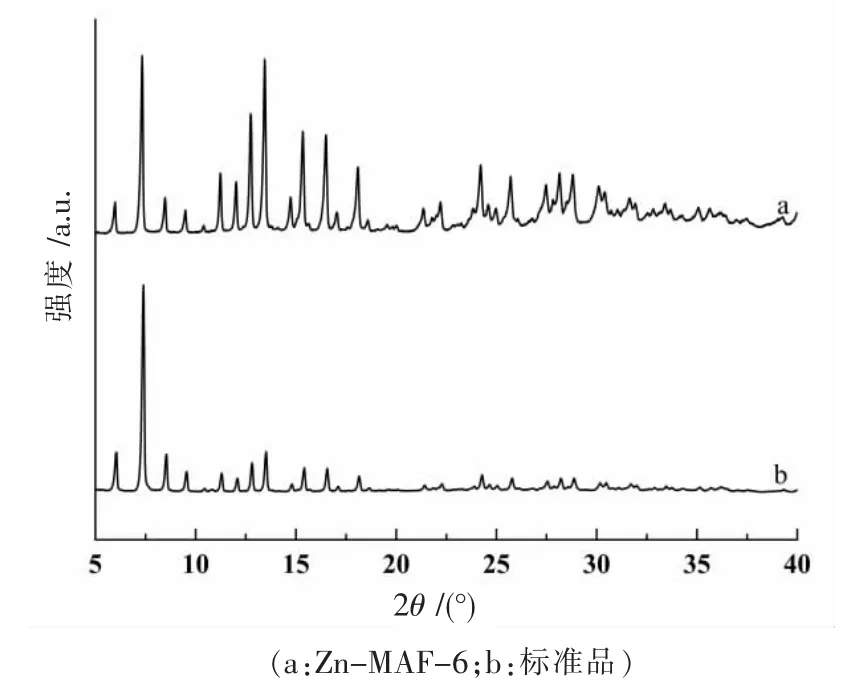
圖1 XRD 圖譜
圖2 為Zn-MAF-6 的傅立葉變換紅外光譜圖,圖2 中2 973 cm-1處的紅外吸收對應于咪唑環上烷基取代基的C-H 伸縮振動吸收峰,1 581 cm-1處的紅外吸收為咪唑環的骨架振動吸收峰,1 139 cm-1處的紅外吸收對應于咪唑環的對稱伸縮振動吸收峰,以上結果和文獻[9]報道一致。

圖2 Zn-MAF-6 的紅外光譜圖
圖3 為Zn-MAF-6 的微觀結構用掃描電子顯微鏡(SEM)表征,圖3A 為低倍率下的SEM 圖,圖3B 為高倍率下的SEM 圖。由圖3 可知,合成的Zn-MAF-6 為十二面體結構,粒徑分布均勻,約為0.8~1.0 μm。

圖3 Zn-MAF-6 的SEM 圖
2.2 Zn-MAF-6/CPE 的電化學性能
圖4A 為Zn-MAF-6/CPE 和CPE 在10 mL 1 mmol·L-1[Fe(CN)6]3-/4-溶液中(底液為0.1 mol·L-1KCl)的循環伏安響應。圖4B 為Zn-MAF-6/CPE 和CPE 在0.5 μmol·L-1Pb2+(緩沖底液為0.2 mol·L-1HAc-NaAc pH=4.8)中的溶出伏安圖。由圖4 可知,在1 mmol·L-1[Fe(CN)6]3-溶液中,Zn-MAF-6/CPE 的伏安響應電流比碳糊電極稍低,這是因為修飾劑Zn-MAF-6 的導電性不高,影響了電化學探針[Fe(CN)6]3-在Zn-MAF-6/CPE表面的電子傳輸。在0.5 μmol·L-1Pb2+溶液中,Zn-MAF-6/CPE 的溶出響應卻大大高于碳糊電極,約為碳糊電極的5 倍。Zn-MAF-6 是富含N 元素的金屬偶氮類框架材料,Zn-MAF-6/CPE 在含Pb2+溶液中負電位下富集時,除了碳糊電極上聚集的負電荷對Pb2+產生靜電引力外,N 原子上的孤對電子也會對Pb2+產生靜電引力,此外Zn-MAF-6 的特殊多孔結構為吸附Pb2+提供了更多的活性位點,基于以上原因Pb2+在修飾電極表面的富集效果增強,Pb2+在Zn-MAF-6/CPE 上的溶出峰電流大大增加。
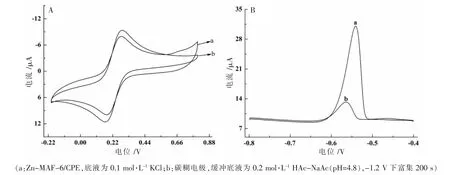
圖4 1 mmol·L-1 Fe(CN)63-/4-溶液的循環伏安圖(A)和0.5 μmol·L-1 Pb2+的溶出伏安曲線(B)
2.3 Zn-MAF-6/CPE 測定Pb2+
2.3.1 實驗條件優化
緩沖溶液pH 值是影響Zn-MAF-6/CPE 測定Pb2+的重要因素。pH 值過低,修飾劑Zn-MAF-6 中吸附Pb2+的活性位點可能會質子化而不利于Pb2+的吸附富集;pH 值較高時,Pb2+可能會發生水解。筆者選擇HAc-NaAc 緩沖溶液在pH=3.6~5.6 范圍內探究pH 值對Pb2+測定的影響(如圖5 所示)。由圖5 可知,Pb2+溶出峰電流在低pH 值溶液中隨著pH 值的增加而增大,當溶液的pH 值大于4.8 時,溶出峰電流值開始逐漸減小。主要是因為pH 值較低時,修飾劑Zn-MAF-6 中配體發生質子化,與Pb2+有靜電排斥作用,影響了Pb2+在電極表面的富集;隨著pH 值增加,溶液中OH-會使Pb2+水解。后續實驗選擇pH=4.8 的HAc-NaAc 為緩沖底液。
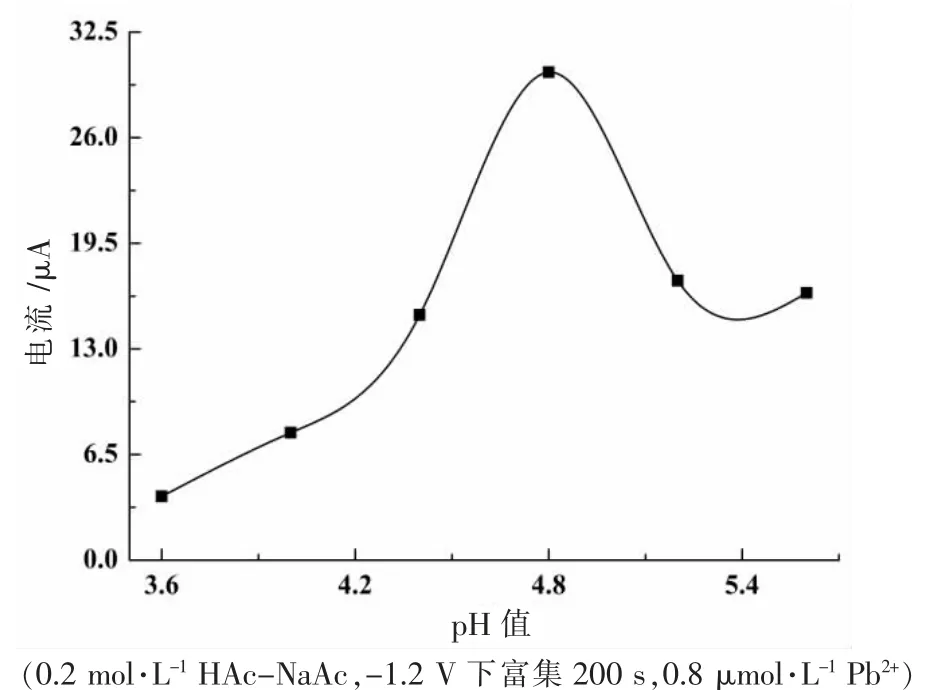
圖5 緩沖底液pH 值的影響
在溶出伏安分析中,富集電位和富集時間是影響測定靈敏度的重要參數。在0.8 μmol·L-1Pb2+溶液中控制富集時間100 s,探究富集電位對峰電流的影響(圖6A)。富集電位在-1.2~-0.9 V 范圍內,溶出峰電流隨著富集電位負移快速增大;當富集電位負于-1.2 V 時,溶出峰電流反而隨著富集電位負移而減小,可能是因為在很負的富集電位下,電極表面逐漸開始發生析氫反應,抑制了Pb2+在電極表面的富集。圖6B 是在0.8 μmol·L-1Pb2+溶液中控制富集電位為-1.2 V,富集時間對Pb2+溶出峰電流的影響,結果表明富集時間小于200 s 時,溶出峰電流隨著富集時間的增加快速增大,當富集時間大于200 s 后,Pb2+溶出峰電流的增大趨勢變緩。綜合考慮檢測靈敏度和檢測速度,筆者后續實驗選擇在-1.2 V 下富集200 s。

圖6 富集電位(A)和富集時間(B)的影響
2.3.2 線性范圍和檢測限
Zn-MAF-6/CPE 在不同濃度的Pb2+溶液中,于-1.2 V 處富集200 s 后溶出伏安曲線如圖7A 所示,由圖7可知Pb2+的溶出峰電流隨濃度的增加而線性增大,圖7B 為線性回歸曲線。

圖7 Zn-MAF-6/CPE 測定Pb2+的溶出伏安曲線(A)和線性曲線(B)
Zn-MAF-6/CPE 測定Pb2+的線性范圍是0.1~1.0 μmol·L-1,線性回歸方程Ip=63.05c-8.86(R2=0.99),檢測靈敏度為63.05 μA/(μmol·L-1),檢出限為2.35 nmol·L-1(S/N=3)。表1 列出了文章方法和文獻報道的修飾電極方法測定Pb2+的線性范圍和檢測限,表明文章方法在線性范圍和檢測限方面均有可比性。對0.5 μmol·L-1Pb2+的溶液進行10 次連續測定,溶出峰電流相對標準偏差(RSD)為2.37%,表明Zn-MAF-6/CPE 測定Pb2+具有較好的穩定性。

表1 修飾電極測定Pb2+的線性范圍和檢出限
2.3.3 干擾實驗
選擇常見的陽離子為干擾離子,用0.5 μmol·L-1Pb2+的溶液試驗干擾離子的影響,結果如圖8 所示。由圖8可知,100 倍的Cd2+、K+、Al3+、Fe3+、Zn2+和Co2+對Pb2+測定沒有明顯干擾(溶出峰電流超過±5%為有明顯干擾),表明Zn-MAF-6 修飾電極測定Pb2+有一定的抗干擾能力。
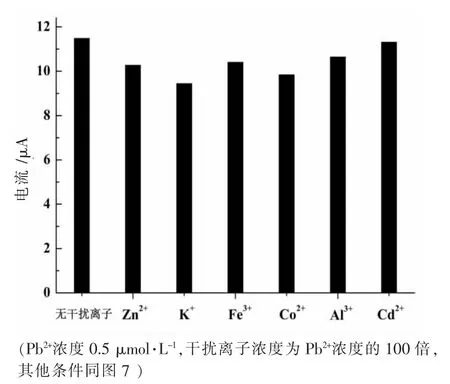
圖8 干擾離子對Zn-MAF-6/CPE 測定Pb2+的影響
2.4 實際樣品分析
取1 mL 河水,用45 μm 的水系濾膜進行過濾,加入9 mL 的0.2 mol·L-1NaAc-HAc(pH=4.8)中,插入三電極體系,記錄Pb2+的溶出伏安曲線,結果表明該水樣中未檢出Pb2+。在水樣中加入Pb2+標準溶液,進行加標回收實驗,結果列于表2 中。Pb2+的回收率為92.3%~103.5%,表明Zn-MAF-6/CPE 可用于實際樣品中Pb2+的檢測。
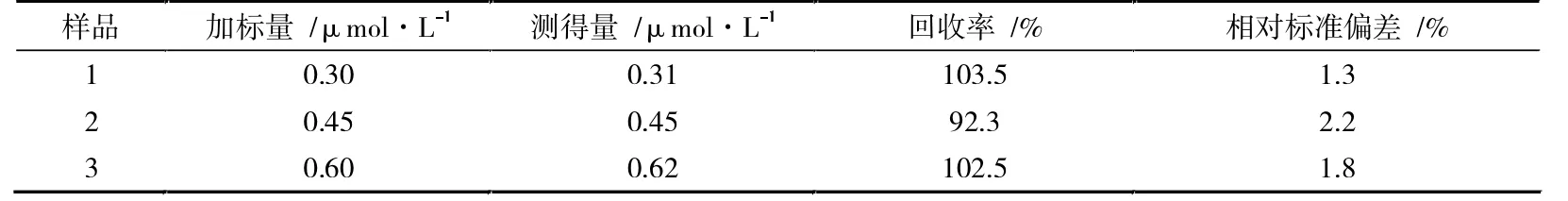
表2 加標回收實驗
3 結語
用快速沉淀法成功合成了金屬偶氮框架材料Zn-MAF-6,制備了Zn-MAF-6/CPE,基于陽極溶出伏安原理,構建了一種靈敏、快速、穩定的Pb2+電化學傳感器。在0.2 mol·L-1HAc-NaAc 緩沖底液(pH=4.8)中于-1.2 V 處富集200 s,溶出伏安峰電流和Pb2+濃度在0.1~1.0 μmol·L-1范圍內呈良好的線性關系,檢測靈敏度和檢出限分別為63.05 μA/(μmol·L-1)和2.35 nmol·L-1(S/N=3)。該修飾電極對環境樣品中常見陽離子具有良好的抗干擾能力,用于河水中的Pb2+測定時加標回收率理想,該Pb2+傳感器的構建為環境樣品中Pb2+的檢測提供了新的思路。

