冬凌草甲素與奧沙利鉑聯合應用抑制結腸癌肝轉移的實驗研究
楊 鵬,趙美蘭,楊宇慎,趙雪峰
(大連大學附屬新華醫院,遼寧 大連 116021)
肝轉移是結直腸癌死亡相關最主要的原因,其主要治療方案為輔助化療聯合靶向治療。然而,一方面只有40%~60%的患者對這些抗癌藥物有反應,另一方面即使對抗癌藥物有反應的患者也不可避免地進一步惡化,故其整體中位生存期通常不超過2~2.5 年[1]。導致抗癌藥物療效低下的最主要原因是抗癌藥物的耐藥性。因此,發現一種具有抗腫瘤作用、且可有效改善傳統抗癌藥物耐藥性的新藥物迫在眉睫。
冬凌草甲素(oridonin)是冬凌草的葉子中提取出的一種貝殼杉烯二萜類化合物,具有抗炎、神經保護、抗菌及較好的抗腫瘤活性作用[2-4]。近期發現,冬凌草甲素對前列腺和乳腺癌、非小細胞肺癌、急性白血病、多形性成膠質細胞瘤以及人類黑色素瘤等多種惡性腫瘤均有抑制作用[5-9],但關于是否能抑制轉移研究卻寥寥無幾。雖然Zheng 等[10]證實冬凌草甲素可通過誘導壞死性凋亡而增強5-FU 的細胞毒性,Xu 等[11]發現冬凌草甲素通過凋亡基因而增強香菇多糖對SMMC-7721人肝細胞瘤細胞的抗癌效果,但對冬凌草甲素聯合奧沙利鉑治療結腸癌肝轉移還未有報道。因此,本課題以裸鼠結腸癌肝轉移模型的建立方式,研究冬凌草甲素與奧沙利鉑聯合應用對裸鼠結腸癌肝轉移模型的轉移抑制。
1 材料和方法
1.1 材料 冬凌草甲素購自普思生物科技有限公司,與二甲亞砜配制成0.1 mol/L 儲存液備用;奧沙利鉑購自江蘇恒瑞股份有限公司;HT29 人結腸癌細胞株由大連大學附屬新華醫院中心實驗室傳代捐助;BALb/c 品系裸鼠24 只,6 周齡雌性,體質量18~20 g,由大連醫科大學實驗動物研究中心購買。
1.2 方法
1.2.1 細胞培養 HT29 人結腸癌細胞株接種于100 mm培養皿中,并在37 ℃、5% CO2,含10%牛血清的RPMI 1640培養液中傳代培養,每2~3 d換1次培養液。培養至80%~90%融合后,利用0.25%胰酶消化液消化,1 200 r/min 離心3 min,丟棄上清液,加無血清RPMI1640 培養液洗細胞2 次,顯微鏡下計數。制備成細胞濃度為5×107/mL 的混懸液,待行動物模型中備用。
1.2.2 動物模型設計 制模前1 周為穩定期,減少一切刺激;1 周后,利用HT29 人結腸癌細胞株建立穩定型裸鼠肝轉移模型[12]24 只;1 周后,按尾靜脈注入成分不同,隨機分成6 只冬凌草甲素單一應用組[100 mg/(kg·d),OD 組]、6 只奧沙利鉑單一應用組[5 mg/(kg·d),Oxa 組]、6 只冬凌草甲素與奧沙利鉑聯合應用組[OD-100 mg/(kg·d)plus Oxa-5 mg/(kg·d),OD 加Oxa 組]及6 只對照組(RPMI 1640 100 μL,Control 組);分組制模3 周后處死,并觀察各組情況。
1.2.3 實驗觀察指標 每天常規觀察記錄裸鼠狀態,結腸癌肝轉移模型4 周或分組制模(藥物干預模型)3周后,各組裸鼠進行脫頸處死。首先解剖觀察肝質量、血性腹水、膽汁淤積及肝轉移評分[13],其次觀察局部浸潤發生率、淋巴結轉移率及腹膜種植轉移率,同時觀察胸腔內、顱內有無轉移情況。所有肉眼可疑部位照相并取材,行病理學檢查。
1.2.4 統計學方法 利用SPSS 20.0 統計軟件包進行處理,2 組計量資料比較采用t檢驗,2 組計數資料比較均采用χ2檢驗。
2 結果
各組裸鼠結腸癌肝轉移模型成功率為100%(24/24)。與Control 組相比,OD 組、Oxa 組及OD加Oxa 組均可顯著降低或減少肝質量、血性腹水、膽汁淤積及肝轉移評分,而OD 加Oxa 組更能顯著抑制肝轉移形成,差異有統計學意義(P<0.05)。Control組局部浸潤發生率、淋巴結轉移率及腹膜種植轉移率有增高趨勢,但其差異無統計學意義(P>0.05)。見表1。
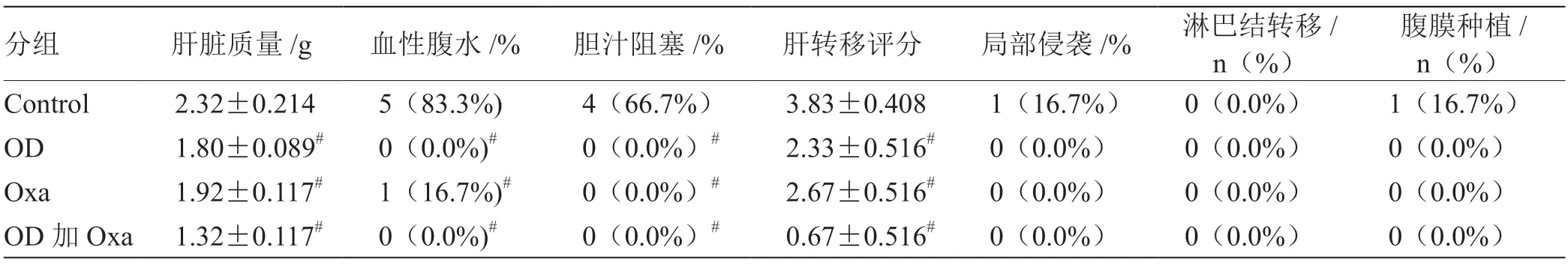
表1 分析各組裸鼠結腸癌肝轉移模型(n=6)
3 討論
奧沙利鉑是臨床治療結直腸癌肝轉移最常用的化療藥物,可顯著改善患者的總體生存期[14-15]。然而,奧沙利鉑耐藥卻是導致結直腸癌肝轉移患者預后不良以及化療失敗的主要因素。奧沙利鉑耐藥主要與增加藥物外流、改善基本切除修復功能以及增強谷胱甘肽和金屬蛋白酶的脫毒能力等幾個方面有關[16-17]。因此,可阻斷藥物外流、恢復癌細胞凋亡程序和損壞DNA修復活動的表皮生長因子絡氨酸激酶抑制劑西妥昔單抗和帕尼單抗被成功用于治療對奧沙利鉑耐藥的結直腸癌肝轉移患者,且西妥昔單抗已被美國食品和藥物管理局(FDA)批準用于治療進展期結腸癌[18]。但癌細胞耐藥性的出現往往涉及多個不同機制,而且這些耐藥機制還會隨著疾病和治療的進展不斷變化,所以僅作用于單一耐藥機制的傳統靶向藥物不足以完全逆轉癌細胞的耐藥性[19]。此外,西妥昔單抗雖已被批準用于臨床,但僅對野生型KRAS 結直腸癌肝轉移患者有效,且長期使用同樣會出現耐藥,故而臨床應用價值十分受限。因此,研發一種具有抗腫瘤活性、可作用于多個耐藥機制以增強奧沙利鉑敏感性的新型藥物對結直腸癌肝轉移治療將具有十分重要的臨床價值和意義。
與傳統抗癌藥物相比較,冬凌草甲素具有以下幾大優勢:1)冬凌草甲素可選擇性誘導腫瘤細胞分化和凋亡,而對正常細胞不造成任何負面影響。因此,冬凌草甲素在不損傷骨髓、肝及腎等人體重要臟器的同時,能有效的抑制和殺傷腫瘤細胞[20]。2)冬凌草甲素可作用于多個信號通路誘導癌細胞死亡。Liu 等[21]揭示冬凌草甲素可通過上調BMP-7 而激活p38MAPK信號通路,從而抑制結腸癌HCT116 細胞的增殖以及誘導癌細胞凋亡;Zheng 等[10]報道冬凌草甲素可通過激活JNK、P38 和ERK 而誘導腎癌786-O 細胞壞死性凋亡,因而增強5-FU 的細胞毒性作用;而且近期熊朝剛等[22]還證實冬凌草甲素可通過上調RIP1 和RIP3而誘導結腸癌HT29 細胞發生壞死和凋亡,從而增強5-FU 對結腸癌HT29 細胞的毒性作用。這些發現提示冬凌草甲素可作用于不同的信號通路來恢復癌細胞凋亡程序從而增強其對氟尿嘧啶的敏感性。因此,筆者推斷冬凌草甲素或許也能作用于多種不同的耐藥機制或信號通路來改善結直腸癌肝轉移癌細胞對奧沙利鉑的耐藥性;3)龍景培等[23]已經證實冬凌草甲素可調結Wnt/β-catenin 信號通路來上調細胞內E-cadherin 的表達、下調Vimentin 的表達,從而抑制結腸癌細胞的增殖、EMT 過程以及腫瘤侵襲和轉移。本研究首次發現冬凌草甲素或奧沙利鉑單藥皆可抑制結直腸癌肝轉移,且二者聯合藥物干預可大幅度增加轉移抑制效果。該結果證實冬凌草甲素不僅可抑制結直腸癌肝轉移,亦能增強癌細胞對奧沙利鉑的敏感性,改善癌細胞對奧沙利鉑的耐藥性。
盡管冬凌草甲素在惡性腫瘤治療方面優勢顯著,但效能低且半衰期短的藥學特性極大的限制了該藥的臨床應用。因此,許多策略正被研發來解決這一缺陷,結構修飾就是其中一種。近年來,許多學者在這方面取得了令人鼓舞的進展。Wang 等[24]研發的冬凌草甲素衍生物Geridonin 可通過增加細胞內ROS 而誘導胃癌MGC803 細胞凋亡,該衍生物的毒性作用明顯強于冬凌草甲素。近期Shen 等[25]合成的另一種冬凌草甲素衍生物compound C7 能顯著抑制HCT116 癌細胞的增殖,且其臨床效能是冬凌草甲素的43 倍。本實驗組結合現階段的實驗結果以及現有的相關理論,為了更好的將冬凌草甲素的優勢運用于結直腸癌肝轉移的治療,一方面會繼續進行動物實驗深入闡明冬凌草甲素與奧沙利鉑的協同作用機理及分子機制,另一方面將著手開展冬凌草甲素衍生物的相關研究。在后續的實驗中,若能于以上兩個方面取得重大突破,將會極大的推動冬凌草甲素與奧沙利鉑聯合治療在結直腸癌肝轉移治療中的應用。
綜上所述,本研究首次通過構建裸鼠結腸癌肝轉移模型,在in vivo 平臺上闡述了冬凌草甲素及其聯合應用對裸鼠結腸癌肝轉移模型的抑制效果。冬凌草甲素與奧沙利鉑聯合藥物干預可大幅度增加轉移抑制效果,至于具體的轉移機制有必要進行臨床試驗的量化指標來判定轉移抑制效果。

