CTZ慢性自發性癲癇模型海馬神經元中γ-氨基丁酸變化
孔淑貞,馮 敏,陳 剛
重慶工商大學 環境與資源學院/重慶高校天然藥物研究重點實驗室,重慶 400067
γ-氨基丁酸(Gamma-aminobutyricacid,GABA)是中樞神經系統中非常重要的一種抑制性神經遞質,GABA與受體結合后調節抑制性神經傳遞[1-2].在癲癇發作中,興奮性神經遞質系統與抑制性神經遞質系統平衡被打破,使腦內神經元興奮性增加,從而導致放電頻率增加、幅度增高以及同步化放電,造成癲癇疾病的發生[3].
崁烯氯噻嗪(Cyclothiazide,CTZ)不僅可以阻滯興奮性神經遞質谷氨酸AMPA受體的去敏感化作用[4-5],而且也會對抑制性神經遞質GABA的釋放和受體表達有減少作用[6],因此CTZ癲癇模型的雙機制特征使其優于其他癲癇動物模型[7].前期研究已經發現CTZ慢性癲癇模型中海馬結構GABA能神經元減少、GABA的合成酶GAD和轉運酶GAT都有明顯減少[8],但是對于海馬神經元中GABA表達情況仍不清楚.本研究通過側腦室注射CTZ建立慢性癲癇動物模型,研究CTZ慢性癲癇大鼠海馬神經元中GABA的表達情況,進一步研究慢性自發性癲癇模型的發生發展機制.
1 材料與方法
1.1 實驗動物
Sprague-Dawley大鼠,250~280 g,由騰鑫生物技術公司購入.標準動物房飼養,溫度23~26 ℃,12 h:12 h晝夜循環光照,自由飲食.適應環境1周后進行實驗.
1.2 CTZ慢性癲癇大鼠模型建立
1.2.1 側腦室內埋管
大鼠用3%戊巴比妥鈉麻醉后,剪掉頭皮和腦膜,雙氧水處理顱骨,以前囟為坐標原點,在前囟后0.3 mm,中縫旁1.3 mm處鉆孔,將套管埋置進左側腦室內(深4.0 mm),并用兩顆螺絲和牙托粉進行固定.埋管后恢復1周進行后續實驗.
1.2.2 側腦室注射
恢復1周后進行癲癇誘導及癲癇行為學觀察實驗.18只大鼠隨機分為兩組:CTZ癲癇模型組13只和二甲基亞砜(DMSO)對照組5只,分別通過微量注射器在側腦室內注射CTZ和DMSO.大鼠置于鼠籠內,自由活動,通過預埋置套管向側腦室內注射CTZ(0.25 μmol,5 μL),連續注射3 d,對照組大鼠側腦室內連續3 d注射DMSO 5 μL.
1.2.3 癲癇行為觀察
在給藥后,每天給實驗動物注射CTZ和DMSO后3 h觀察動物行為并記錄,按照Racine評分標準對癲癇發作程度將其行為分為0-V級:
0級:無任何異常行為,自然狀態;
Ⅰ級:咀嚼、眨眼、立須、耳動、流涎、面部抽搐;
Ⅱ級:點頭運動、濕狗樣抖動、頸部抽搐;
Ⅲ級:單側肢體抽搐;
Ⅳ級:雙側肢體抽搐的同時伴隨出現站立、全身僵直;
Ⅴ級:在Ⅳ的基礎上失去平衡,出現摔倒、身體完全強直.
大鼠的癲癇行為評分達到了Ⅳ級及以上,可認為是構建癲癇模型成功[9].成功的癲癇動物模型,進一步通過錄像記錄實驗動物注射CTZ或DMSO后6個月內慢性癲癇行為的發作情況,其情況按照上述Racine評分標準進行記錄分組.
1.3 組織學染色
在行為學實驗結束后,所有實驗動物在3%戊巴比妥鈉麻醉后,4 ℃生理鹽水快速灌注沖出血液,4%多聚甲醛灌注進行內固定,之后斷頭取腦組織.4%多聚甲醛后固定24 h,梯度酒精脫水后,石蠟包埋,進行石蠟切片,厚度為6 μm,每只大鼠間隔取4~6片進行后續染色.
1.3.1 Nissl染色
切片進入梯度酒精脫蠟后,蒸餾水潤洗5 min,0.1%硫瑾溶液染色10 min,蒸餾水快速潤洗幾秒鐘,95%鹽酸酒精分色2~10 min,梯度酒精脫水,二甲苯透明,中性樹膠封片.
1.3.2 免疫組化染色
二甲苯10 min,梯度酒精脫蠟,蒸餾水10 min,TBS緩沖液潤洗 5 min,3%雙氧水消除內源性過氧化物酶活性,0.125%的胰蛋白酶修復抗原活性,山羊血清封閉,加一抗anti-GABA(Abcam,濃度為1∶100)置4 ℃冰箱過夜.次日,加入辣根過氧化物酶標記的山羊抗兔二抗(SP-9001,北京中杉金橋生物技術公司)37 ℃水浴箱內孵育1 h,最后DAB顯色.在每兩個過程中間均使用TBS緩沖液潤洗5 min,各3次.梯度酒精脫水,二甲苯透明,中性樹膠封片.
1.3.3 圖片分析
每只大鼠取4~6片染色切片使用Nikon顯微鏡在200倍明場視野下拍照,對Nissl染色和免疫組化圖片中海馬CA1和CA3區中全部陽性神經元進行細胞計數和神經元胞體染色進行光密度分析,取每張切片平均值代表該大鼠海馬中陽性神經元的分布情況.
1.4 統計學分析

2 實驗結果
2.1 CTZ癲癇模型建立
5只DMSO對照組大鼠只有洗臉等正常行為,無異常行為出現.13只CTZ癲癇模型組大鼠在注射CTZ后全部出現Ⅳ級及以上行為,癲癇模型建立成功.之后6個月觀察期中,10只大鼠出現自發性癲癇行為,其中6只達到Ⅳ級及以上行為.根據Racine分級法,大鼠的癲癇行為評分達到Ⅳ級及以上,可認為是構建癲癇模型成功[9].因此在13只CTZ急性癲癇模型中,其中6只出現了Ⅳ級及以上癲癇行為的CTZ癲癇動物達到了慢性自發性癲癇模型標準,確定為慢性自發性癲癇動物模型,成功率為46%(圖1).本文使用6只出現自發性癲癇行為發作的CTZ癲癇大鼠和5只DMSO對照組大鼠進行后續組織學染色研究.
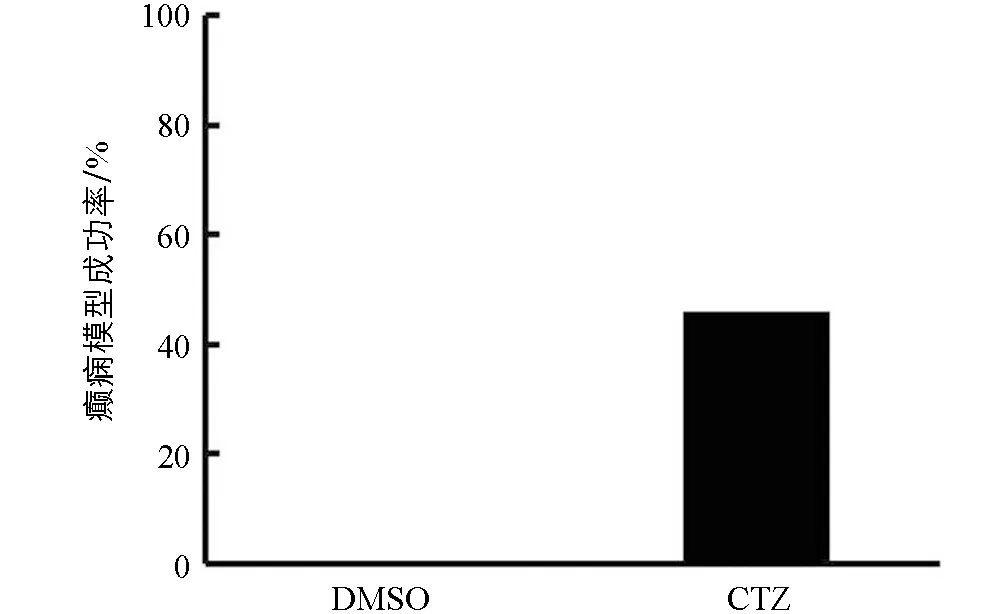
圖1 慢性期CTZ慢性癲癇動物模型成功率
2.2 CTZ慢性癲癇大鼠模型海馬中神經元無明顯變化
Nissl染色是神經元染色常用的一種方法,通過Nissl染色可以對神經元結構及神經元數目進行檢測[10].實驗結果顯示,海馬結構中DMSO對照組和CTZ慢性癲癇模型組CA1和CA3區錐體神經元被染成紫色(圖2).兩組神經元分布相似,CA1區錐體神經元3到4排,CA3區錐體神經元4到5排,排列整齊,僅少量神經元結構異常.對CA1區和CA3區Nissl染色神經元進行計數,DMSO對照組海馬CA1區和CA3區神經元數目分別為331.04±29.38和169.73±7.21,CTZ慢性癲癇模型組海馬CA1區和CA3區神經元數目分別為325.94±38.42和163.87±29.73,兩組神經元數目差異無統計學意義(圖3),CTZ慢性癲癇模型海馬CA1區和CA3區并無明顯神經元損傷和死亡.在既往研究中,KA致癇模型等模型動物海馬中會出現大量的神經元凋亡[11,12],但CTZ慢性癲癇模型盡管在慢性期出現了自發性癲癇發作,但海馬神經元并未出現明顯的損傷和死亡,因此癲癇疾病發生機制不僅和神經元損傷、死亡相關,還與其他機制有關.
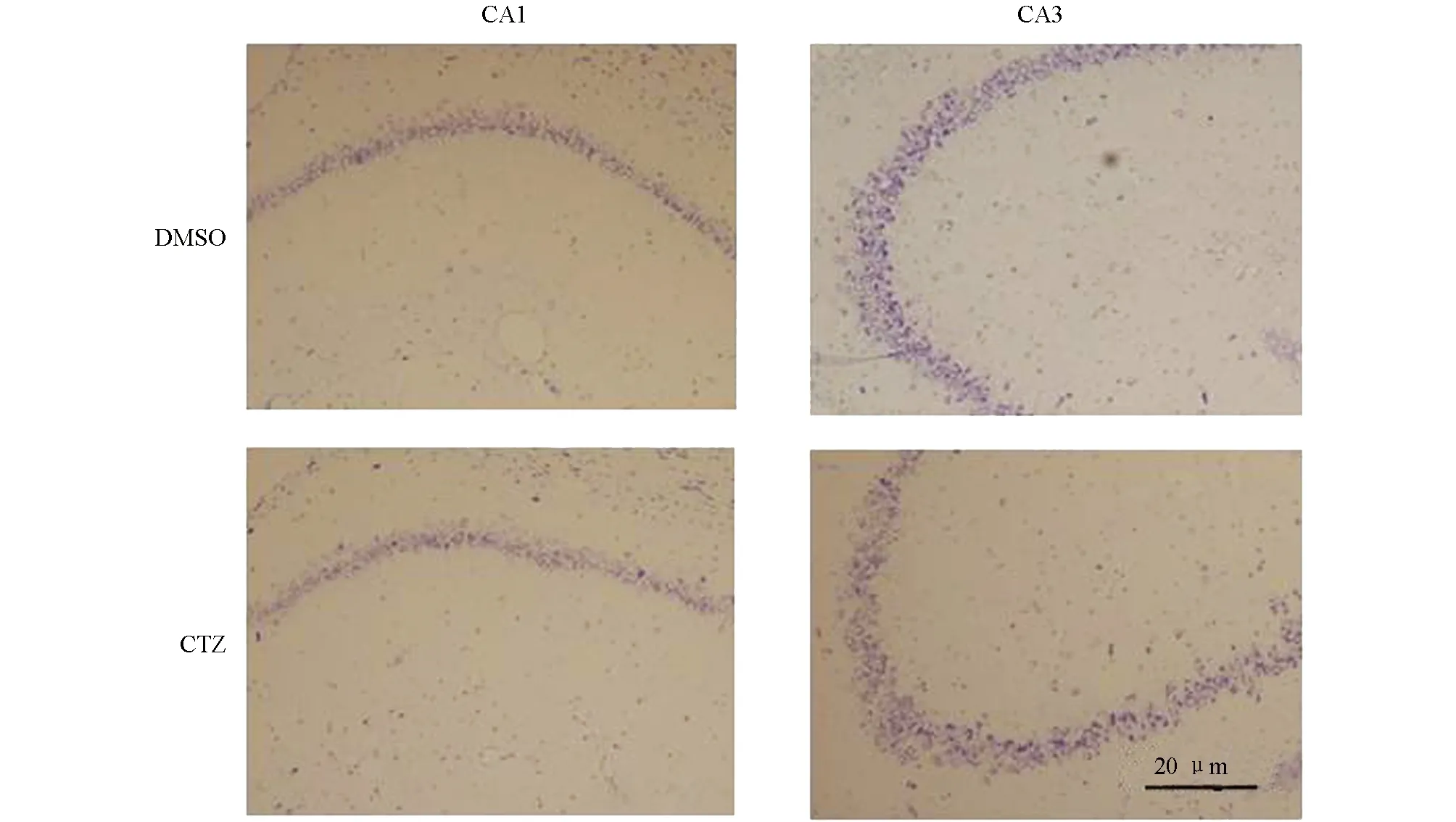
圖2 CTZ慢性癲癇模型海馬Nissl染色

圖3 CTZ慢性癲癇模型海馬神經元統計圖(Nissl染色)
2.3 CTZ慢性癲癇大鼠模型海馬神經元中GABA減少
GABA能神經元是海馬結構中非常重要的抑制性神經元,可以釋放抑制性神經遞質GABA調節海馬神經元興奮性的發生.GABA釋放到突觸間隙后,與突觸后受體結合介導抑制性調節,因此海馬神經元中GABA含量對于抑制性調節有著至關重要的作用[13].圖4免疫組化染色顯示,DMSO對照組大鼠海馬CA1和CA3區GABA陽性神經元被染成棕色,主要分布在海馬錐體細胞層,錐體細胞層各層中均有GABA陽性神經元分布.棕色的GABA免疫陽性顆粒主要分布在錐體神經元細胞漿中,說明在GABA能神經元內大量的GABA分泌儲存在胞漿中.在DMSO對照組大鼠海馬CA1和CA3區,GABA陽性染色除了分布在神經元細胞漿中之外,分子層突起內也有大量的GABA陽性染色,棕色染色的突起呈平行分布在分子層內.CTZ慢性癲癇大鼠模型海馬CA1和CA3區也有大量GABA免疫陽性神經元存在,GABA免疫陽性顆粒主要分布于神經元的胞漿內,但與DMSO對照組相比染色較淺,而且分子層內突起無棕色GABA免疫陽性顆粒分布,說明CTZ慢性癲癇模型海馬CA1和CA3區神經元胞漿和神經元突起內GABA含量下降.

圖4 CTZ慢性癲癇模型海馬GABA神經元免疫組化染色
對海馬CA1和CA3區GABA免疫陽性染色進行光密度分析(圖5),結果顯示,DMSO對照組大鼠海馬CA1和CA3區神經元胞體GABA免疫陽性光密度分別為661.40±17.65和625.07±7.39,說明在DMSO對照組大鼠海馬CA1和CA3區神經元胞體內有大量的GABA分布.對CTZ慢性癲癇模型大鼠海馬CA1和CA3區神經元胞體進行GABA免疫陽性光密度分析后結果分別為424.48±45.10和361.82±51.30,與DMSO對照組大鼠相比下降了35.82%和42.12%,兩組差異有統計學意義(p<0.05).通過光密度分析可以看出,CTZ慢性癲癇模型中海馬CA1和CA3區神經元胞體內GABA含量急劇下降.

圖5 CTZ慢性癲癇模型海馬GABA神經元免疫組化染色光密度統計圖
3 討論與結論
在中樞神經系統中,興奮性神經遞質系統和抑制性神經遞質系統處于平衡狀態,共同調節大腦的興奮性傳遞等活動.一旦興奮性神經遞質系統功能增強或者抑制性神經遞質系統功能下降,都會引起平衡打破,大腦內興奮性增強,引起癲癇的發生.在抑制性神經元中,20%~30%的抑制性神經元是GABA能神經元[14],其軸突末端可以通過谷氨酸脫羧酶將興奮性神經遞質谷氨酸脫羧形成抑制性神經遞質GABA[15].GABA釋放到突觸間隙后,突觸后受體結合增加突觸后神經元Cl-的通透性誘發抑制性突觸后電位,或者與G蛋白偶聯受體結合介導抑制性神經傳導作用[16].因此,當大腦內GABA含量減少或者受體表達下調,都可能造成興奮性神經遞質系統占優勢導致神經元放電增加,引起癲癇發生.
本研究結果顯示,CTZ慢性癲癇模型組海馬CA1區和CA3區Nissl染色神經元與DMSO對照組相比差異無統計學意義,說明CTZ慢性癲癇組神經元并未出現明顯的損傷或死亡等情況,因此CTZ慢性癲癇模型組癲癇行為發生并非是由海馬內神經元損傷或神經元丟失所致,很可能和神經元釋放神經遞質及受體的改變有關.通過免疫組化染色發現,CTZ慢性癲癇模型組大鼠海馬CA1和CA3區神經元胞體和樹突內GABA含量明顯下降,分別下降了35.82%和42.12%,因此會造成其介導的抑制功能大幅度下降,引起CTZ慢性癲癇模型慢性期明顯的癲癇行為反復性發作.
海馬神經元中GABA的減少可能與谷氨酸脫羧酶含量或功能下降有關.谷氨酸脫羧酶將興奮性神經遞質谷氨酸脫羧形成抑制神經遞質GABA.谷氨酸脫羧酶含量減少或者功能下降,造成其脫羧過程效率降低,引起GABA合成減少.既往研究中發現,CTZ慢性癲癇模型中GAD陽性神經元明顯減少,GAD含量降低[7].由于海馬CA1區和CA3區GAD含量減少,造成了CTZ慢性癲癇模型大鼠海馬內神經元GABA合成大幅度減少,與受體結合下降,造成突觸后抑制功能下降,興奮性神經遞質系統功能占優勢,海馬內神經元興奮性增加,造成慢性期CTZ慢性癲癇模型大鼠自發性、反復性癲癇行為發作.
本研究通過側腦室注射CTZ誘發癲癇行為發作,并觀察慢性期內大鼠出現自發性癲癇行為發作,建立慢性癲癇動物模型.采用Nissl染色和免疫組化染色方法對海馬CA1區和CA3區神經元數目和GABA表達情況進行了研究,發現CTZ慢性癲癇模型中GABA表達減少可能是造成自發性癲癇發作的重要原因之一.在治療癲癇的藥物研究中,有多種藥物是通過調節GABA遞質系統的作用而發揮作用,如苯二氮卓類和巴比妥類藥物通過延長氯離子通道開放時間增強GABA的抑制作用[17],地塞米松可以通過調節基因轉錄增加GABA合成[18],褪黑素對GABA有正向調節作用[19],丙戊酸鈉通過GABA通路上調抑制性神經元功能[20],通過增加神經元GABA合成或釋放,增加GABA與受體結合增強抑制性調節作用,減輕或阻止癲癇的發生,對癲癇疾病進行治療.因此CTZ癲癇模型中GABA遞質系統功能受損,尤其是GABA含量減少,對于促進GABA合成和釋放藥物的開發為治療癲癇提供了重要的理論依據.

