轉Bt基因玉米(瑞豐125、DBN9936、DBN9978)對亞洲玉米螟的抗蟲效果研究
孫丹丹 全玉東 王月琴 王振營 何康來


摘要 :評價轉Bt基因玉米對靶標生物亞洲玉米螟的殺蟲作用是轉基因玉米研發的重要一環。本文采用室內生測法對3種轉Bt基因抗蟲玉米‘瑞豐125(表達Cry1Ab/Cry2Aj殺蟲蛋白),‘DBN9936‘DBN9978(表達Cry1Ab殺蟲蛋白)對亞洲玉米螟敏感品系ACB-S及抗Cry1Ab品系ACB-AbR、抗Cry1Ac品系ACB-AcR、抗Cry1F品系ACB-FR、抗Cry1Ah品系ACB-AhR、抗Cry1Ie品系ACB-IeR的殺蟲活性進行測定,同時采用心葉期和抽絲期人工接蟲法進行田間抗蟲效果鑒定。結果表明,取食3種Bt玉米的ACB-S幼蟲, 3 d死亡率100%,而取食對照常規玉米3 d存活率100%。取食3種Bt玉米的5個抗性品系幼蟲除ACB-AbR和ACB-AcR有2%~6%的個體存活4~5 d, 6 d死亡率也達到了100%,其余品系均在3 d全部死亡,而取食對照玉米5~6 d的死亡率僅為4%~14%,差異顯著。田間心葉期食葉級別及穗期活蟲數、雌穗被害和莖稈被蛀等為害等級說明3種Bt玉米高抗亞洲玉米螟。明確了‘瑞豐125‘DBN9936和‘DBN9978對亞洲玉米螟有很高的殺蟲活性和田間防治效果。5個Bt蛋白抗性亞洲玉米螟品系幼蟲在常規玉米上顯示一定的適合度劣勢。
關鍵詞 :轉基因玉米; Bt殺蟲蛋白; 亞洲玉米螟; 寄主抗性
中圖分類號:
S 435.132
文獻標識碼: A
DOI: 10.16688/j.zwbh.2020008
Resistance of transgenic Bt maize (Ruifeng 125, DBN9936 & DBN9978) to
Asian corn borer
SUN Dandan, QUAN Yudong, WANG Yueqin, WANG Zhenying, HE Kanglai*
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection,Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract
Evaluation for resistance to the targets such as Asian corn borer (ACB), Ostrinia furnacalis, is an important step of research and development novel insect resistant transgenic Bt maize. In present research, three kinds of insect resistant transgenic Bt maize, i.e. ‘Ruifeng 125 expressing Cry1Ab/Cry2Aj protein, ‘DBN9936 and ‘DBN9978 expressing Cry1Ab protein, were evaluated in the laboratory and field. Laboratory bioassays were conducted by exposing neonates of ACB susceptible strain (ACB-S), Cry1Ab resistant strain (ACB-AbR), Cry1Ac resistant strain (ACB-AcR), Cry1F resistant strain (ACB-FR), Cry1Ah resistant strain (ACB-AhR), and Cry1Ie resistant strain (ACB-IeR) to fresh whorl leaves, respectively. Field trials were conducted by artificial infestation of ACB at whorl and silking stages. Mortalities were 100% within 3 days when ACB-S larvae fed on three Bt maize leaf tissues, whereas all larvae survived when they fed on the control of conventional maize leaf tissues. When ACB-AbR and ACB-AcR larvae fed on three Bt maize leaf tissues, 2%-6% of larvae could survival for 4-5 days, but not longer than six days. In contrast, there were 4%-14% of larval mortalities when these larvae fed on control within six days. Leaf feeding ratings from whorl stage infestation, larval survivals and ear and stalk bored and tunnels indicated that three Bt maize varieties were highly resistant to ACB. In conclusion, Bt maize ‘Ruifeng 125 ‘DBN9936 and ‘DBN9978 are highly toxic to ACB and could provide season-long protection against ACB. Laboratory selected Cry1Ab, Cry1Ac, Cry1Ah, Cry1F, and Cry1Ie resistant strains demonstrate certain fitness cost.
Key words
transgenic maize; Bt insecticidal protein; Ostrinia furnacalis; host plant resistance
轉Bt基因玉米因具有特定且高效的目標性狀而受到種植者的歡迎[13]。據國際農業生物技術應用服務組織(ISAAA)統計, 2018年全球已有14個國家和地區種植轉基因玉米5 890萬hm2,其中轉Bt基因抗蟲玉米達到550萬 hm2,耐除草劑玉米560萬 hm2,聚合抗蟲/耐除草劑玉米4 780萬hm2 [4]。我國玉米種植面積穩定在4 200萬 hm2[5],蟲害是影響玉米高產穩產以及優質的重要問題之一。因此,抗蟲始終是玉米品種改良的重要研究內容,亦是利用現代生物技術進行作物品種改良的首選目標性狀之一[6]。種植轉基因抗蟲作物可顯著減少化學殺蟲劑的使用,從而降低環境污染。同時因其特異性的殺蟲特點,對非靶標生物安全,可保護生物多樣性[23]。
蘇云金芽胞桿菌Bacillus thuringiensis,即Bt在芽胞形成的過程中產生的殺蟲蛋白晶體(insecticidal crystal protein,ICP)對鱗翅目、鞘翅目、雙翅目等多種害蟲具有特異的殺蟲作用,尤其是cry基因,因其編碼的Cry殺蟲蛋白生物活性強而被廣泛應用[6]。目前,全球應用最廣泛的抗蟲作物主要為跨國公司研發的表達Cry和Vip 類殺蟲蛋白的轉基因作物[4]。大面積持續種植轉基因玉米的同時,也會引發靶標害蟲產生抗性。在南非, 夜蛾科昆蟲Busseola fusca 對Bt玉米‘MON810 產生了抗性[7],在波多黎各和巴西,草地貪夜蛾Spodoptera frugiperda 對表達Bt Cry1F的玉米產生了抗性[89],在巴西,草地貪夜蛾對表達Bt Cry1Ab的玉米產生了抗性[10],在加拿大,歐洲玉米螟Ostrinia nubilalis對表達Bt Cry1F的玉米產生了抗性[11]。因此,商業化種植某一轉基因抗蟲玉米的同時,必須配套實施合理的抗性治理措施,以保障其長期的可持續利用。高劑量庇護所是目前應用最廣的能有效延緩靶標害蟲產生抗性的策略[1214]。然而,其有效性的條件之一就是“高劑量”,即轉基因抗蟲作物表達的目的Bt蛋白量能殺死靶標害蟲種群中全部抗性隱性純合(rr)和雜合(Sr)個體[15]。因此,抗蟲性評價是轉基因玉米研發與應用的重要環節。本文開展了3種國產轉基因玉米‘瑞豐125‘DBN9936‘DBN9978對靶標害蟲亞洲玉米螟的殺蟲效果評價,同時通過測定其對亞洲玉米螟不同Bt蛋白抗性品系的殺蟲活性,評估了其對靶標害蟲抗性治理的潛力。
1 材料和方法
1.1 供試亞洲玉米螟
亞洲玉米螟敏感品系(ACB-S)為在室內無瓊脂半人工飼料[16]上連續飼養種群,飼養過程中未接觸過Bt制劑或Bt蛋白。亞洲玉米螟Cry1Ab抗性品系ACB-AbR(RR>190)[17]、Cry1Ac抗性品系ACB-AcR(RR>3 000)[17]、Cry1F抗性品系ACB-FR(RR>1 000)[18]、Cry1Ah抗性品系ACB-AhR(RR>190)[19]、Cry1Ie抗性品系ACB-IeR(RR>850)[20]均以敏感品系為起始蟲源,在無瓊脂半人工飼料中加入一定量的Cry1Ab、Cry1Ac、Cry1F、Cry1Ah、Cry1Ie蛋白進行幼蟲全生育期汰選所得。所有幼蟲均在溫度(27±1)℃,相對濕度70%~80%,光周期L∥D=16 h∥8 h的條件下飼養。
1.2 供試玉米
試驗所用表達Cry1Ab/Cry2Aj殺蟲蛋白轉Bt基因抗蟲玉米‘瑞豐125,由浙江大學提供;表達Cry1Ab殺蟲蛋白轉Bt基因抗蟲玉米‘DBN9936和‘DBN9978,由北京大北農生物技術有限公司提供。同時各單位提供了相應的非轉基因受體對照,大北農提供了用于在田間試驗的‘DBN567和‘Nonghua101。室內生測試驗用苗種植在中國農業科學院植物保護研究所科研溫室,盆栽。田間試驗包括在海南三亞中國農業科學院棉花研究所大茅基地對‘瑞豐125和‘DBN9936的接蟲鑒定,以及在河北玉田對‘DBN9978的接蟲鑒定。
1.3 Bt玉米抗螟性離體組織生測
室內生測在玉米生長至7~8葉期時進行。從溫室取新鮮植株,將未展開的幼嫩心葉剪成2~3 cm2大小,放在24孔培養板中,每板1個處理,每個處理重復2次。每孔接1頭待測試亞洲玉米螟敏感或抗性品系初孵幼蟲(孵化時間<12 h),放置在溫度(27±1)℃、光周期L∥D=16 h∥8 h,相對濕度70%~80%的人工氣候培養箱中。每天調查一次幼蟲存活情況,根據葉片被取食消耗情況更換同一植株的新葉片,直至Bt玉米組幼蟲全部死亡。最后稱量并記錄對照組存活幼蟲體重。
1.4 田間接蟲鑒定
田間鑒定分心葉期接蟲和穗期接蟲,對應自然發生的心葉期世代和穗期世代。心葉期接蟲在玉米植株生長至6葉期,每株接亞洲玉米螟(ACB-S)2日齡幼蟲20~30頭,1周后再次接蟲。穗期接蟲在玉米抽絲散粉期,每株接亞洲玉米螟2日齡幼蟲20~30頭。接蟲2周后,調查為害級別。心葉期調查記錄食葉級別,穗期調查記錄活蟲數、雌穗(不包括花絲)受害/隧道長度(cm),同時剖查莖稈,記錄單株蟲孔數、隧道長度和活蟲數等計算被害級別[21]。試驗小區為隨機區組排列,每個品種每次重復接蟲40株以上,重復3次。
1.5 數據分析
亞洲玉米螟幼蟲取食不同玉米品種心葉后的存活率、田間心葉期接蟲后不同品種的食葉級別及穗期接蟲后的被害級別的差異分別進行單因素方差分析。處理間差異顯著時,平均數采用LSD測驗。死亡率百分數進行反正弦轉換。采用SAS Proc ANOVA過程進行分析。
2 結果與分析
2.1 Bt玉米對ACB-S品系的殺蟲效果
ACB-S幼蟲取食3種Bt玉米心葉2 d后,其死亡率達到89.6%以上,顯著高于取食非轉基因對照玉米心葉CK(F3,4=53.51, P=0.001)(圖1),3 d后幼蟲全部死亡。而取食非轉基因對照玉米心葉3 d的幼蟲存活率仍為100%。說明轉Bt基因玉米‘瑞豐125‘DBN9936和‘DBN9978對ACB-S有很高的殺蟲效果。
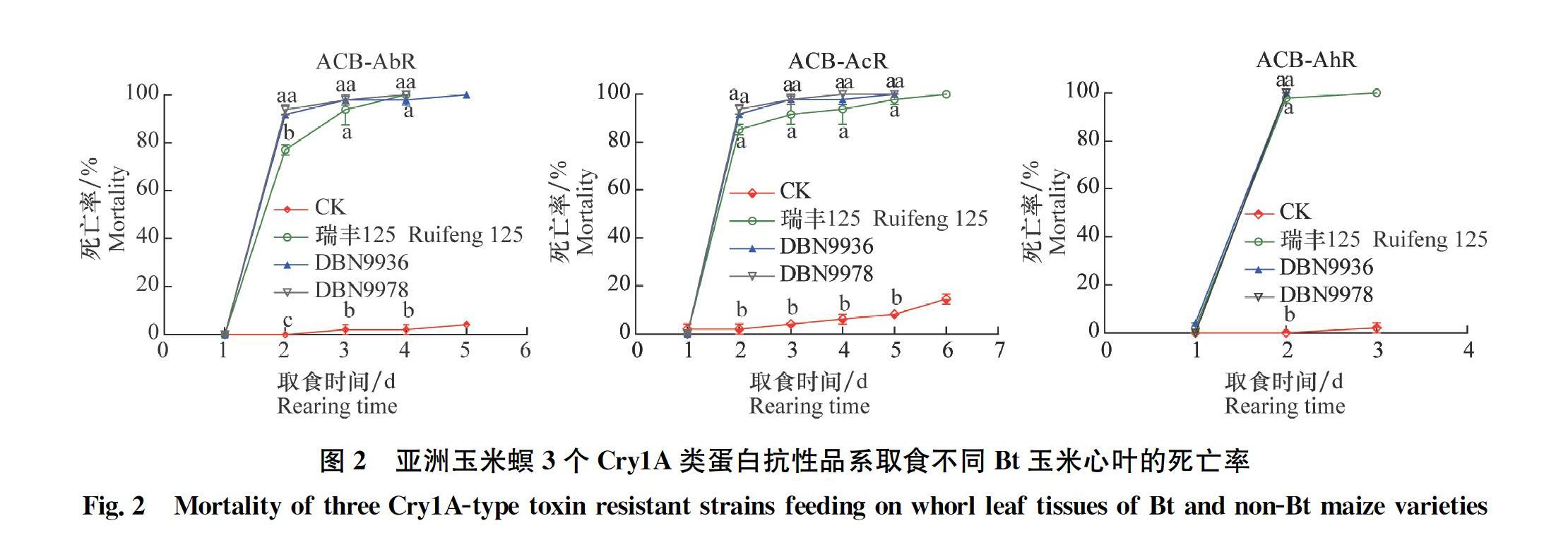
2.2 Bt玉米對亞洲玉米螟Cry1A類殺蟲蛋白抗性品系的殺蟲效果
亞洲玉米螟3個Cry1A類蛋白抗性品系ACB-AbR,ACB-AcR,ACB-AhR初孵幼蟲分別取食3種Bt玉米心葉2 d 后大量死亡,死亡率達79%以上,隨取食時間增加,死亡率繼續升高, 3~5 d后全部死亡。而取食非轉基因玉米心葉的幼蟲在1 d即有出現少量死亡,死亡率約2%,且隨時間延長緩慢增加,6 d后的最高死亡率為14%,顯著低于Bt玉米處理(圖2)。同時,不同抗性品系取食3種Bt玉米心葉2~5 d時的死亡率有顯著差異(ACB-AbR:2 d,F3,4=614.58, P<0.000 1; 3 d, F3,4=27.95, P=0.003 8;4 d, F3,4=97.65, P=0.000 3; ACB-AcR: 2 d, F3,4=101.34, P=0.003; 3 d, F3,4=54.18, P=0.001 1; 4 d F3,4=33.86, P=0002 7; 5 d, F3,4=147.19, P=0.000 2; ACB-AhR: 2 d, F3,4=224.18, P<0.000 1),因此,不同處理幼蟲全部死亡的時間也有一定差異,即幼蟲全部死亡時間為ACB-AhR在2~3 d,ACB-AbR在4~5 d,ACB-AcR在4~6 d。這些結果說明3種Bt玉米對實驗室汰選的亞洲玉米螟3個Cry1A類殺蟲蛋白抗性品系具有很高的殺蟲活性。
2.3 Bt玉米對ACB-FR和ACB-IeR品系的殺蟲效果
亞洲玉米螟ACB-FR和ACB-IeR品系初孵幼蟲分別取食3種Bt玉米心葉,2~3 d全部死亡,而取食非轉基因玉米的初孵幼蟲3 d后的死亡率約2%,差異顯著(ACB-FR: 2 d, F3,4=62.04, P=0.000 8; ACB-IeR: 2 d, F3,4=108.98, P=0.000 3)說明3種Bt玉米對亞洲玉米螟ACB-FR和ACB-IeR品系具有很好的殺蟲效果(圖3)。
2.4 Bt玉米田間抗蟲性
心葉期接蟲鑒定結果表明,Bt玉米與常規玉米對照及當地常規玉米品種‘Nonghua101相比,被害級別差異顯著(表1)。Bt玉米葉片僅有針孔狀為害狀,平均食葉級別≤1.3,即高抗亞洲玉米螟。而常規玉米對照葉片被取食嚴重,平均食葉級別≥8.5,即高感。
穗期接蟲鑒定結果表明,Bt玉米與常規玉米對照及當地常規玉米品種‘Nonghua101相比,存活蟲數、被害級別差異顯著(表1)。Bt玉米個別植株上有1頭發育不良的低齡幼蟲,雌穗僅少數花絲被害,籽粒、穗軸等都沒有被害,平均被害級別為1.6,即高抗。而常規玉米對照除花絲嚴重被害外,籽粒、穗軸等都嚴重被取食,莖稈被蛀,平均被害級別達到7.9以上,即高感。
3 討論
高劑量表達目標殺蟲蛋白的轉Bt基因抗蟲玉米能夠全生育期抵抗歐洲玉米螟和亞洲玉米螟等害蟲的為害[2224]。與使用化學殺蟲劑一樣,大面積長期種植轉Bt基因抗蟲玉米將不可避免地引起靶標害蟲對目標殺蟲蛋白產生抗性[2526]。靶標害蟲易產生抗性的主要原因之一是轉Bt基因抗蟲玉米表達的目標Bt殺蟲蛋白量低。有報道,由于表達Cry1Ab殺蟲蛋白的轉基因抗蟲玉米‘MON810對草地貪夜蛾表現中等殺蟲效果,導致田間很快產生抗性[89];表達Cry1F轉基因抗蟲玉米防治Striacosta albicosta[27]及表達Cry3Bb1和mCry3A轉基因抗蟲玉米防治玉米根葉甲Diabrotica virgifera virgifera[28]殺蟲效果沒有達到高劑量,田間很快產生了抗性。本研究結果明確了表達Cry1Ab的3種轉Bt基因抗蟲玉米‘瑞豐125‘DBN9936和‘DBN9978對亞洲玉米螟具有高效殺蟲活性,田間抗蟲性水平達到高抗,殺蟲效果達到98%以上。這對于今后商業化種植這些品種時,制定實施高劑量庇護所抗性治理策略,以延緩抗性產生,保障產品長期可持續利用提供了重要的科學依據。
本研究表明,實驗室汰選的亞洲玉米螟Cry1Ab抗性品系ACB-AbR對3種表達Cry1Ab殺蟲蛋白的Bt玉米有一定的抗性,表現在比敏感品系生存時間長1~3 d,然而最終存活時間沒有超過7 d。一方面說明Bt玉米的抗蟲性狀屬功能性顯性;另一方面玉米本身的內在抗蟲性物質可能與Bt殺蟲蛋白互作提高了殺蟲效果。這一現象在小菜蛾、歐洲玉米螟等都有報道[2930]。
交互抗性,即由于害蟲對某一種脅迫因子(如某一種Bt殺蟲蛋白)的汰選產生抗性的同時,對其他脅迫因子(其他Bt殺蟲蛋白)也產生了抗性。有報道,對Cry1Ac殺蟲蛋白產生抗性的煙芽夜蛾Heliothis virescens (F.)對Cry1Aa, Cry1Ab, Cry1F, Cry1B, Cry1C和Cry1A亦產生了交互抗性[31],對Cry1Ab產生抗性的歐洲玉米螟,對Cry1Ac有高水平的交互抗性,對Cry1F有低水平的交互抗性[32]。前期研究表明,室內用Cry1Ac, Cry1Ah, Cry1F殺蟲蛋白汰選的亞洲玉米螟抗性品系,對Cry1Ab蛋白存在一定的交互抗性[1719],Cry1Ie殺蟲蛋白汰選的亞洲玉米螟抗性品系, 對Cry1Ab蛋白沒有交互抗性[20]。本研究結果顯示,ACB-AcR品系取食3種Bt玉米心葉的生存力顯著增加,比敏感品系生存時間增加1~4 d,顯著長于ACB-Ah, ACB-FR, ACB-Ie品系。說明ACB-AcR品系對3種Bt玉米具有一定交互抗性。
靶標害蟲對Bt殺蟲蛋白產生抗性是其適應脅迫(選擇)的結果。抗性品系(基因型)與敏感品系往往在形態、生物學特征和生理生化反應演化出顯著差異。暴露于Bt殺蟲蛋白脅迫下,抗性品系適合度通常高于敏感品系。去除脅迫,則抗性品系的適合度會顯示一定的劣勢。如對Cry1Ac殺蟲蛋白產生抗性的棉鈴蟲Helicoverpa armigera在常規棉花和不添加Cry1Ac蛋白的飼料上幼蟲的發育歷期延長,凈增殖率降低[3]。本研究結果表明,與敏感品系相比,抗性品系在常規玉米對照上的存活率有一定的下降,且下降幅度與抗性倍數高低相關。說明抗性品系適合度下降,即表現出適合度劣勢。此外適合度劣勢還表現在幼蟲體重下降(圖4),體重降低幅度與抗性倍數成正相關。在實施高劑量庇護所抗性治理策略條件下,適合度劣勢有利于抗性治理,因為抗性個體在庇護所的存活率降低。
參考文獻
[1] MILNE A E, BELL J R, HUTCHISON W D, et al. The effect of farmers decisions on pest control with Bt crops: A billion dollar game of strategy [J/OL]. PLoS Computational Biology, 2015, 11(12): e1004483. DOI: 10.1371/journal.pcbi.1004483.
[2] HUTCHISON W D, BURKNESS E C, MITCHELL P D, et al. Areawide suppression of European corn borer with Bt maize reaps savings to non-Bt maize growers [J]. Science, 2010, 330(6001): 222225.
[3] TABASHNIK B E. Communal benefits of transgenic corn [J]. Science, 2010, 330(6001): 189190.
[4] ISAAA. Global status of commercialized biotech/GM crops in 2018: Biotech crops continue to help meet the challenges of increased population and climate change [M]. NY: The International Service for the Acquisition of Agri-biotech Applications. 2018: 75.
[5] 國家統計局. 中國統計年鑒[M]. 北京: 國家統計出版社, 2019.
[6] 黎裕,王天宇. 玉米轉基因技術研發與應用現狀及展望[J]. 玉米科學, 2018, 26(2): 115.
[7] VAN RENSBURG J B J. First report of field resistance by the stem borer, Busseola fusca (Fuller) to Bt-transgenic maize [J]. South African Journal of Plant and Soil, 2007, 24(3): 147151.
[8] STORER N P, BABCOCK J M, SCHLENZ M, et al. Discovery and characterization of field resistance to Bt maize: Spodoptera frugiperda (Lepidoptera: Noctuidae) in Puerto Rico [J]. Journal of Economic Entomology, 2010, 103(4): 10311038.
[9] FARIAS J R, ANDOW D A, HORIKOSHI R J, et al. Field-evolved resistance to Cry1F maize by Spodoptera frugiperda (Lepidoptera: Noctuidae) in Brazil [J]. Crop Protection, 2014, 64: 150158.
[10]OMOTO C, BERNARDI O, SALMERON E, et al. Field-evolved resistance to Cry1Ab maize by Spodoptera frugiperda in Brazil [J]. Pest Management Science, 2015, 72(9): 17271736.
[11]SCHAAFSMA A, FARHAN Y, SMITH J. The first case of field failure of Bt corn to control European corn borer Ostrinia nubilalis (Lepidoptera: Crambidae) discovered in Nova Scotia, Canada [C]∥27th IWGO Conference Abstract. 2019, Engelberg, Switzerland.
[12]GOULD F. Sustainability of transgenic insecticidal cultivars: integrating pest genetics and ecology [J]. Annual Review of Entomology, 1998, 43: 701726.
[13]TABASHNIK B E, GASSMANN A J, CROWDER D W. Insect resistance to Bt-crops: evidence versus theory [J]. Nature Biotechnology, 2008, 26(2): 199202.
[14]SANAHUJA G, BANAKAR R, TWYMAN R. Bacillus thuringiensis: a century of research, development and commercial applications [J]. Plant Biotechnology Journal, 2011, 9(3): 283300.
[15]ALSTAD D N, ANDOW D A. Managing the evolution of insect resistance to transgenic plants [J]. Science, 1995, 268(5219): 18941896.
[16]宋彥英, 周大榮, 何康來. 亞洲玉米螟無瓊脂半人工飼料的研究與應用[J]. 植物保護學報, 1999, 26(4): 324328.
[17]ZHANG Tiantao, HE Mingxia, GATEHOUSE A, et al. Inheritance patterns, dominance and cross-resistance of Cry1Ab-and Cry1Ac-selected Ostrinia furnacalis (Guenée) [J]. Toxins, 2014, 6(9): 26942707.
[18]WANG Yueqin, WANG Yidong, WANG Zhenying, et al. Genetic basis of Cry1F-resistance in a laboratory selected Asian corn borer strain and its cross-resistance to other Bacillus thuringiensis toxins [J/OL]. PLoS ONE, 2016,11(8): e0161189. DOI: 10.1371/journal.pone.0161189.
[19]SHABBIR M Z, QUAN Yudong, WANG Zhenying, et al. Characterization of the Cry1Ah resistance in Asian corn borer and its cross-resistance to other Bacillus thuringiensis toxins [J/OL]. Scientific Reports, 2018, 8: 234. DOI: 10.1038/s41598-017-18586-2.
[20]WANG Yueqin, YANG Jing, QUAN Yudong, et al. Characterization of Asian corn borer resistance to Bt toxin Cry1Ie [J/OL]. Toxins, 2017, 9(6): 186. DOI: 10.3390/toxins9060186.
[21]何康來, 王振營, 周大榮, 等. 玉米抗螟性鑒定方法與評價標準[J]. 沈陽農業大學學報, 2000, 31(5): 5155.
[22]ARCHER T L, SCHUSTER G, PATRICK C, et al. Whorl and stalk damage by European and Southwestern corn borers to four events of Bacillus thuringiensis transgenic maize [J]. Crop Protection, 2000, 19(3): 181190.
[23]ARCHER T L, PATRICK C, SCHUSTER G, et al. Ear and shank damage by corn borers and corn earworms to four events of Bacillus thuringiensis transgenic maize [J]. Crop Protection, 2001, 20(2): 139144.
[24]HE Kanglai, WANG Zhenying, ZHOU Darong, et al. Evaluation of transgenic Bt corn for resistance to the Asian corn borer (Lepidoptera: Pyralidae) [J]. Journal of Economic Entomology, 2003, 96(3): 935940.
[25]MCGAUGHEY W H. Insect resistance to the biological insecticide Bacillus thuringiensis [J]. Science, 1985, 229(4709): 193195.
[26]TABASHNIK B E. Evolution of resistance to Bacillus thuringiensis [J]. Annual Review of Entomology, 1994, 39: 4779.
[27]SMITH J L, LEPPING M D, RULE D M, et al. Evidence for field-evolved resistance of Striacosta albicosta (Lepidoptera: Noctuidae) to Cry1F Bacillus thuringiensis protein and transgenic corn hybrids in Ontario, Canada [J]. Journal of Economic Entomology, 2017, 110(5): 22172228.
[28]GASSMANN A J, PETZOLD-MAXWELL J L, KEWESHAN R S, et al. Field-evolved resistance to Bt maize by western corn rootworm [J/OL]. PLoS ONE, 2011, 6(7): e22629. DOI: 10.1371/journal.pone.022629.
[29]TABASHNIK B E, CARRIERE Y, DENNEHY T J, et al. Insect resistance to transgenic Bt crops: lessons from the laboratory and field [J]. Journal of Economic Entomology, 2003, 96(4): 10311038.
[30]HUANG Fangneng, BUSCHMAN L L, HIGGINS R A, et al. Survival of Kansas Dipel-resistant European corn borer (Lepidoptera: Crambidae) on Bt and non-Bt corn hybirds [J]. Journal of Economic Entomology, 2002, 95(3): 614621.
[31]GOULD F, ANDERSON A, REYNOLDS R, et al. Selection and genetic analysis of a Heliothis virescens (Lepidoptera: Noctuidae) strain with high levels of resistance to Bacillus thuringiensis toxins [J]. Journal of Economic Entomology, 1995, 88(6): 15451559.
[32]SIQUEIRA H A A, MOELLENBECK D, SPENCER T, et al. Cross-resistance of Cry1Ab-selected Ostrinia nubilalis (Lepidoptera: Crambidae) to Bacillus thuringiensis δ-endotoxins [J]. Journal of Economic Entomology, 2004, 97(3): 10491057.
[33]LIANG Gemei, WU Kongming, YU Hongkun, et al. Changes of inheritance mode and fitness in Helicoverpa armigera (Hübner) (Lepidoptera: Noctuidae) along with its resistance evolution to Cry1Ac toxin [J]. Journal of Invertebrate Pathology, 2008, 97(2): 142149.
(責任編輯:田 喆)

