富馬酸貝達喹啉片治療耐多藥肺結核的療效觀察
任娜 胡善雷 劉金瑾 陳裕
耐多藥肺結核(multi-drug resistant tuberculo-sis,MDR-TB)一直是全球結核病控制工作的重點和難點[1]。WHO于2018年發布的全球結核病報告顯示,2017年全球新發MDR-TB患者46萬例,其中19萬例死于MDR-TB,2015年納入治療的MDR-TB患者占總死亡率的15%[2]。而我國作為MDR-TB高負擔國家之一,每年新發MDR-TB患者約5.7萬例,全球基金MDR-TB控制項目地區納入治療的MDR-TB患者轉歸中,死亡率占8.42%[3]。富馬酸貝達喹啉片屬新型二芳基喹啉類抗分枝桿菌藥物,其主要通過抑制結核分枝桿菌ATP合成酶質子泵的活性來影響三磷酸腺苷(adenosine-triphosphate,ATP)合成而發揮抗菌、殺菌作用[4]。體外研究證實其對結核分枝桿菌敏感菌株及耐藥菌株具同等的殺菌活性,對休眠菌也能發揮良好的滅菌作用[5]。臨床試驗也證實富馬酸貝達喹啉片對人體安全性、耐受性良好[6]。富馬酸貝達喹啉片在我國于2016年被批準上市,但現階段國內關于富馬酸貝達喹啉片臨床研究相對少見。鑒于此,本研究采集資料著重分析富馬酸貝達喹啉片治療耐多藥肺結核的療效,以期為MDR-TB的臨床治療提供試驗依據,具體報道如下。
資料與方法
一、研究對象
研究對象為本院自2017年12月~2019年6月收治的MDR-TB患者。納入標準:①符合MDR-TB診斷標準[7];②年齡≥18周歲;③試驗開始時留取痰液送檢證實為MDR-TB;④符合富馬酸貝達喹啉片適應證,無富馬酸貝達喹啉片相關禁忌證[8];⑤無高風險的心臟合并癥病史,未出現過導致QT間期延長的風險因素;⑥知曉研究內容,并自愿簽署知情同意書。排除標準:①既往對富馬酸貝達喹啉片有嚴重過敏反應或嚴重不良反應的受試者;②需藥物治療的心律失常者或QT間期延長>450 ms;③免疫系統缺陷者、血液系統疾病者;④合并心、腦、肝、腎等重要器官功能障礙者;⑤過敏體質;⑥合并肺外結核者;⑦HⅣ陽性或病毒性肝炎。按納入與排除標準,選取60例作為本次研究對象,其中男36例,女24例,年齡18~69歲。按隨機數字表法均分觀察組與對照組,每組30例。研究通過醫院倫理委員會審核。
二、實驗方法
對照組患者均嚴格參照結核菌培養及藥敏實驗接受規范抗結核治療,治療方案參照中國防癆協會《耐藥結核病化學治療指南(2015)》中制定的多耐藥結合化療方案,總療程24個月,其中強化期6個月,強化治療方案為6Cm(Am)-Lfx(Mfx)-Pto(PAS,E)-Cs(PAS,E)-Z;鞏固期18個月,鞏固期治療方案為18Lfx(Mfx)-Pto(PAS,E)-Cs(PAS,E);若強化期結束時痰菌仍未轉陰則將強化期延長至8個月,并相應縮短鞏固期。觀察組在對照組基礎上聯合富馬酸貝達喹啉片(Tibotec公司,批號362247/362248);在抗結核治療開始后2周,以400mg/次、1次/d劑量,接受富馬酸貝達喹啉片;在隨后22周將劑量調整為200mg/次,3次/周,兩次用藥至少間隔48h,治療24周后停止使用富馬酸貝達喹啉片;富馬酸貝達喹啉片需與食物同服,囑患者清淡飲食。兩組均治療24周,并按研究要求接受定期跟蹤隨訪。
三、觀察指標
1 基本情況
查閱電子病歷,統計兩組一般治療,包括性別、年齡、病程、初治/復治肺結核比例、受累肺野數、合并空洞及空洞受累肺野、合并癥及耐藥類型等。
2 兩組痰培養轉陰、涂片轉陰情況及轉陰時間
分別于治療后4周、8周、12周、24周時接受痰涂片及痰結核菌培養,若痰涂片或痰結核菌培養陰性則在次月再次接受痰涂片或痰結核菌培養,連續兩個月行痰涂片或痰結核菌培養陰性且不再復陽,則可定義為陰轉;同時統計痰涂片或痰結核菌培養轉陰時間。
3 病灶空洞、閉合情況
分別于治療前、治療24周后應用X線片、CT評價肺部空洞、病灶吸收情況,參照治療前空洞,將治療后空洞變化情況分以下4種:閉合(空洞消失)、縮小(空洞縮小50%及以上)、無變化(空洞縮小或增大比例不足50%)、增大(空洞增大≥50%);吸收情況分以下4種:顯著吸收(病灶吸收≥50%)、吸收(病型吸收<50%)、不變(病灶無明顯變化)、惡化(病灶增大或播散)。
4 治療轉歸
參照《耐藥結核病化學治療指南(2015)》將轉歸分治愈(痰菌培養及痰涂片轉陰,病灶顯著吸收、空洞消失)、完成治療(完成治療周期,痰菌培養及痰涂片轉陰,病灶有吸收、空洞縮小,但未達治愈標準)、失敗(痰菌培養及痰涂片陽性,病灶不變或增大、播撒,空洞無變化或增大)三個等級,并統計治療期間死亡、失訪情況。
5 不良反應
兩組治療后第2周、12周、24周時定期接受肝腎功能、血常規、心電圖等檢查,嚴密監測不良反應,統計低血鉀、高尿酸血癥、胃腸道不良反應、QT間期延長等發生率,統計不良反應及嚴重不良事件(severe adverse event,SAE)發生情況。
四、統計學方法
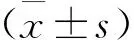
結 果
一、兩組患者基本情況
兩組性別、年齡、病程、初治/復治肺結核比例、受累肺野數、合并空洞及空洞受累肺野、合并癥及耐藥類型比較差異無統計學意義(P>0.05)(見表1)。

表1 兩組患者基本情況例(%)]
二、 痰培養轉陰、涂片轉陰情況及轉陰時間分析
觀察組痰培養轉陰率、涂片轉陰率均顯著高于對照組(P<0.05),且觀察組痰菌培養轉陰時間、涂片轉陰時間均較對照組短(P<0.05)(見表2)。

表2 痰培養轉陰、涂片轉陰情況及轉陰時間分析例(%)]
三、 病灶情況分析
觀察組病灶空洞閉合率(63.33%)、顯著吸收率(50.00%)高于對照組(36.67%、23.33%),差異有統計學意義(χ2=4.808、4.593,P=0.028、0.032)(見表3)。

表3 病灶情況分析[例(%)]
四、 治療轉歸分析
兩組治療期間未見失訪、死亡等脫落病例,但觀察組治愈率顯著高于對照組(P<0.05)(見表4)。

表4 治療轉歸分析[例(%)]
五、不良反應分析
兩組均未見SAE發生,不良反應主要以低鉀血癥(血清鉀分別為3.2mmol/L、3.4mmol/L)、高尿酸血癥、白細胞減少、肺部感染、QT間期延長、胃腸道反應常見,但均為輕度,患者自述可耐受,經對癥治療后均好轉,順利完成治療周期,兩組不良反應發生率比較差異無統計學意義(P<0.05)(見表5)。

表5 不良反應分析[例(%)]
討 論
我國是世界結核病高負擔國家之一,MDR-TB患者約占全球總數的25%[9]。MDR-TB的低治愈率、高病死率也使其成文威脅人類生命健康的巨大威脅。受異煙肼、利福平耐藥的影響,MDR-TB多使用二級抗結核藥物治療,此類藥物不僅治療效果相對更差、不良反應多,且需強化治療6~8個月,部分患者總療程長達24個月[10]。但隨著二線注射藥物、氟喹諾酮類藥物在MDR-TB中的大量應用,更嚴重的耐藥形式也隨之出現,可供此類患者選擇的藥物范圍也愈漸變窄,甚至無藥可用[11]。因此,基于當前MDR-TB全球流行現狀,急需安全性良好,且不受對當前抗結核藥物已經耐藥的結核分枝桿菌菌株交叉耐藥性影響的新型抗結核藥物。富馬酸貝達喹啉片可特異性結合至分枝桿菌的ATP合成酶,耗竭ATP而發揮新型抗結核機制[11-12]。而在體外條件下,富馬酸貝達喹啉片可強效抑制藥物敏感性及耐藥性結核分枝桿菌分離株,對非復制結核桿菌也能發揮殺菌作用[13]。2012年12月富馬酸貝達喹啉片經美國FDA審批上市,一項多中心、開放標簽、單臂試驗(TMC207-C209;NCT00910871)的報道也證實了貝他喹的安全性和有效性[14]。而在我國則于2016年經中國國家食藥監總局批準可作為成人結核病聯合治療的一部分,但受新藥安全性影響,尤其是富馬酸貝達喹啉片半衰期長,可能引起QT間期延長等不良反應,因此富馬酸貝達喹啉片在國內的臨床應用仍需大量研究持續補充及完善。
本研究就顯示,基于兩組性別、年齡、病程、初治/復治肺結核比例、受累肺野數、合并空洞及空洞受累肺野、合并癥及耐藥類型均衡可比的基礎上,觀察組痰培養轉陰率、涂片轉陰率均顯著高于對照組,且痰菌培養轉陰時間、涂片轉陰時間均較對照組短。提示在規范抗結核治療基礎上聯合富馬酸貝達喹啉片可進一步提升MDR-TB轉陰率,并縮短痰菌培養轉陰時間、涂片轉陰時間。且觀察組病灶空洞閉合率、顯著吸收率高于對照組,病灶吸收不變比例,顯著低于對照組;提示聯合富馬酸貝達喹啉片在改善病灶上也同樣存在顯著優勢。而在治療轉歸上,觀察組治愈率顯著高于對照組,治愈率與TMC207-C208[15]第二階段研究的78.8(52/66)接近,這也進一步印證了富馬酸貝達喹啉片聯合常規抗結核方案治療MDR-TB的臨床優勢。另Cohen等[16]報道,富馬酸貝達喹啉片可導致轉氨酶升高及QT間期延長發生,其中嚴重的QT延長也是富馬酸貝達喹啉片中斷治療的原因之一。而本研究中未見轉氨酶升高病例,QT間期延長發生率為13.33%,但經重復心電圖確定QTc<500 ms,未中斷治療。且兩組不良反應總發生率差異也無統計學意義。由此可見,富馬酸貝達喹啉片的應用雖存在一定QTc延長、轉氨酶升高等風險,但并未顯著增加治療不良反應風險。一向來自美國的中期分析隊列研究Guglielmetti等[17]研究也指出,富馬酸貝達喹啉片雖具有普遍的QT間期延長現象,但患者總體耐受性良好。
綜上所述,富馬酸貝達喹啉片治療耐多藥肺結核療效確切,且與常規抗結核方案比較,雖有一定QT間期延長發生風險,并未顯著增加安全性風險。但本研究也存在一定局限性,研究樣本量僅滿足最低統計學要求,樣本量較小,受樣本量小影響,未能進一步對治療失敗患者的相關情況進行分析,以期在下階段采集更豐富樣本量后探究經富馬酸貝達喹啉片治療耐多藥肺結核后治療失敗的影響因素,以期為本病的臨床治療提供更豐富、全面的參考依據。

