君遷子葉楊梅苷誘導HepG2細胞凋亡及其作用機制
田艷花,吳 磊,杜會枝,楊兆艷,張立偉,
(1.山西大學分子科學研究所,中醫藥現代研究中心,山西 太原 030006;2.山西藥科職業學院食品工程系,山西 太原 030031;3.山西農業大學生命科學學院,山西 太谷 030801)
在正常情況下,細胞的生長、代謝、增殖和分化均受機體有序調控,但當細胞發生癌變時則不受機體控制,導致其惡性增殖分化,嚴重影響機體正常生理和代謝功能,最終導致機體死亡。肝癌是一種常見的惡性腫瘤,其所致死亡率位居所有惡性腫瘤的第二位[1]。目前治療肝癌的主要手段包括手術、放療和化療。手術雖可局部切除腫瘤,但不能根除腫瘤細胞,疾病復發的概率非常高[2];放、化療對局部腫瘤有效,對轉移性病灶難以發揮有效的治療作用,同時會對患者正常細胞和組織造成不可逆傷害,產生諸多的不良反應和副作用[3]。因此,從天然產物中尋找高效、毒副作用小的預防和治療肝癌的活性成分成為當今研究的熱點之一。
君遷子(Diospyros lotusL.)屬于柿科,又名牛奶棗、黑棗和軟棗等,在我國山東、遼寧、河南、河北、陜西及西南等地廣泛種植。其葉中富含VC、胡蘿卜素、黃酮類、酚類、谷山醇類等活性成分[4],其中楊梅苷是君遷子葉中最主要的活性成分之一[5],其基本結構如圖1所示。楊梅苷因特殊的結構而具有較強的抗氧化、抗炎及抗焦慮等功能[6]。Kandalkar等[7]研究發現從大戟葉中分離得到的楊梅苷能有效清除1,1-二苯基-2-三硝基苯肼自由基和羥自由基。Chen Wei等[8]研究發現楊梅苷可防止過氧亞硝酸鹽誘導的DNA損傷和星形膠質細胞毒性。孫桂波等[9]研究發現楊梅苷可通過增強抗氧化酶活性、穩定線粒體膜電位、抑制Caspase級聯反應和磷酸化細胞外調節蛋白激酶來保護H2O2誘導的血管內皮細胞氧化應急損傷。Domitrovi?等[10]研究發現楊梅苷可提升CCl4誘導的肝損傷小鼠血清天冬氨酸轉氨酶和丙氨酸轉氨酶的活性,提升肝臟谷胱甘肽和細胞色素P450 2E1的表達水平,抑制肝臟中環氧合酶2和腫瘤壞死因子-α的過度表達,促進CCl4中毒后的肝組織再生,從而起到保肝作用。徐容容等[11]研究發現楊梅苷能顯著促進人前列腺癌PC-3細胞凋亡,進而對PC-3細胞增殖具有較強的抑制作用。目前已有研究發現楊梅苷的苷元楊梅酮具有促進HepG2細胞凋亡的功效,如Zhang Xiaohong等[12]研究發現楊梅酮可以破壞線粒體膜電位,誘導凋亡前蛋白Bax向線粒體移位,下調抗凋亡因子Bcl-2的表達,并促進細胞色素c從線粒體釋放到胞漿中,加速HepG2細胞凋亡。Zhang Xiaohong等[13]研究發現楊梅酮具有抑制HepG2細胞增殖、降低HepG2細胞周期蛋白B/Cdc2復合物活性的作用,并能將HepG2細胞周期阻滯在G2/M期,同時加速細胞凋亡。Cao Jianping等[14]研究發現楊梅酮作為天然黃酮類化合物可通過促進HepG2細胞自噬、誘導細胞周期阻滯和加速HepG2細胞凋亡,從而抑制腫瘤的發生。綜上所述,楊梅苷的苷元楊梅酮具有抗腫瘤活性,但目前楊梅苷對人肝癌HepG2細胞的抗腫瘤活性及其作用機制尚不清晰。因此,本研究以君遷子葉為原料,通過分離純化獲得高純度的楊梅苷單體,采用噻唑藍(methyl thiazolyl tetrazolium,MTT)法測定不同濃度楊梅苷在不同處理時間下對HepG2細胞存活率的影響,并通過激光共聚焦顯微鏡結合Hoechst 33342染色觀察經楊梅苷處理后的HepG2細胞的形態變化;此外,利用流式細胞分析儀檢測楊梅苷對HepG2細胞凋亡、周期阻滯、胞內活性氧(reactive oxygen species,ROS)水平及單丹璜酰戊二胺(monodansylcadaverine,MDC)平均熒光強度的影響;最后通過Western blot檢測不同濃度楊梅苷對HepG2細胞凋亡和自噬相關蛋白表達量的影響,以期明確楊梅苷抗肝癌活性及其作用機制。
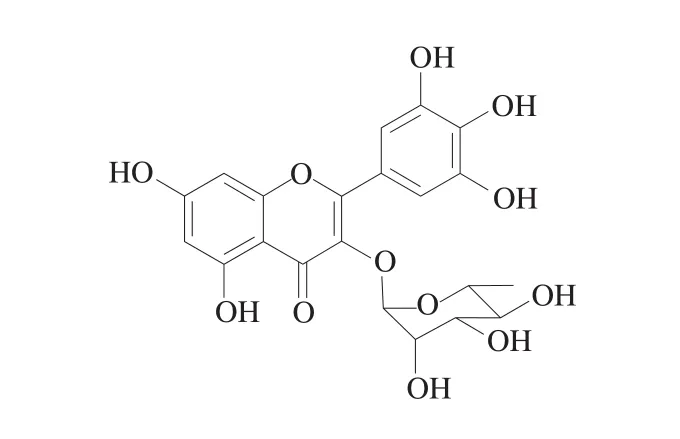
圖1 楊梅苷的化學結構式Fig.1 Chemical structural formula of myricitrin
1 材料與方法
1.1 材料與試劑
楊梅苷(純度≥95%)由實驗室自制(君遷子葉熱水回流提取,提取液經醇沉、D101大孔樹脂柱初分離得到活性組分,活性組分通過Sephadex LH-20柱分離得到化合物1,通過質譜及核磁共振鑒定為楊梅苷,采用高效液相色譜儀測定其純度為95.18%);人肝癌細胞(HepG2細胞)和人正常肝細胞(L-02細胞) 北京協和細胞庫。
杜氏改良Eagle培養基(Dulbecco's modified Eagle medium,DMEM)、二甲基亞砜(dimethyl sulfoxide,DMSO)和雙抗(青霉素/鏈霉素) 日本同仁公司;胰蛋白酶消化液 美國HyClone公司;胎牛血清(fetal bovine serum,FBS) 美國Sigma公司;磷酸鹽緩沖液(phosphate buffered saline,PBS)、BCA蛋白濃度測定試劑盒和RIPA細胞裂解液 北京佛博生物科技有限公司;ROS檢測試劑盒 南京建成生物工程研究所;MDC 上海懋康生物科技有限公司;Annexin V-FITC/PI細胞凋亡和周期檢測試劑盒 上海前塵生物科技有限公司;Bcl-2、Bax、細胞色素c、Apaf-1、Caspase-3/9、Beclin 1、Atg5、LC3-I、LC3-II和β-actin抗體 美國CST公司;其余試劑均為分析純。
1.2 儀器與設備
CO2恒溫培養箱、EVOS M7000倒置顯微鏡 賽默飛世爾科技(中國)有限公司;SW-CJ-2FD超凈臺上海涵今儀器儀表有限公司;TG18K-II型高速冷凍離心機 上海趙迪生物科技有限公司;ZE5流式細胞儀美國BIO-RAD公司;FV3000激光共聚焦顯微鏡美國Thorlabs公司;JC-1086C Pro全自動酶標分析儀青島聚創環保儀器有限公司。
1.3 方法
1.3.1 細胞培養和樣品制備
將HepG2和L-02細胞接種于DMEM培養基(加體積分數10% FBS和體積分數1%雙抗)中,然后將其置于37 ℃、5% CO2恒溫培養箱中進行培養。當細胞鋪滿培養皿底70%~80%時,將細胞進行傳代,采用對數期細胞進行后續實驗。采用DMEM培養基溶解楊梅苷,并加入助溶劑DMSO(終體積分數小于0.05%),配制成1 mol/L的楊梅苷樣品溶液,無菌膜過濾備用。
1.3.2 細胞存活率測定
采用MTT法測定HepG2和L-02細胞的存活率。按照5×103個/孔的細胞密度將上述兩種細胞分別接種于96 孔板中,每孔200 μL,在37 ℃、5% CO2下培養24 h,待細胞完全貼壁后,棄去上清液,然后加入楊梅苷樣品溶液使楊梅苷終濃度分別為10、50、100、200 μmol/L(楊梅苷實驗組);同時設對照組(不含楊梅苷),對照組含有與實驗組等體積的完全培養基,每個濃度設置6 個復孔。在37 ℃、5% CO2條件下分別培養24、48、72 h后,棄去上清液,每孔加入20 μL MTT(5 mg/mL),培養4 h,棄上清液,最后每孔加入150 μL DMSO,振蕩15 min,使藍色結晶溶解,置于酶標儀中,在490 nm波長處測定其吸光度,并計算細胞存活率為50%時楊梅苷的濃度即半數抑制濃度(50% inhibiting concentration,IC50)。根據下式計算HepG2和L-02細胞存活率[15]。
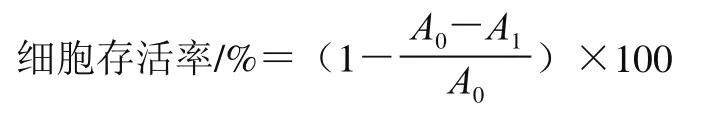
式中:A0為對照組的平均吸光度;A1為楊梅苷實驗組的平均吸光度。
1.3.3 HepG2細胞內ROS水平的測定
利用2',7'-二氯熒光黃雙乙酸鹽(2',7'-dichlorodih ydrofluorescein diacetate,DCFH-DA)熒光探針,并通過流式細胞分析儀檢測不同濃度楊梅苷對HepG2細胞內ROS的影響。取對數期HepG2細胞(1×105個/孔)接種于6 孔板中,2 mL/孔,培養24 h,待細胞貼壁后,按照1.3.2節方法加入楊梅苷并設立對照組,每孔設3 個復孔,培養48 h后,每孔加入終濃度5 μmol/L的DCFH-DA熒光探針,避光反應20 min,吸去熒光探針,細胞用PBS洗滌2 次,隨后利用胰蛋白酶將其消化,離心棄去上清液,PBS重懸,利用流式細胞儀測定每孔樣品的熒光強度。
1.3.4 Hoechst 33342染色法觀察細胞形態
取對數期HepG2細胞(1×105個/孔)接種在蓋玻片6 孔板中,2 mL/孔,在37 ℃、5% CO2下培養24 h,待細胞貼壁后,按照1.3.2節的方法加入楊梅苷并設立對照組,培養48 h后,吸去培養基,用預冷的PBS洗滌3 次,每孔加入1 mL體積分數4%多聚甲醛固定1 h,棄去固定液,用預冷的PBS洗滌3 次,然后加入終質量濃度為5 mg/L的Hoechst 33342染液,37 ℃避光染色15 min,取出蓋玻片,用濾紙吸干蓋玻片底部,將其置于激光共聚焦顯微鏡(激發和發射波長分別為340 nm和488 nm)下觀察并拍照。
1.3.5 HepG2細胞凋亡率及周期檢測
對數期HepG2細胞(1×105個/孔)接種于6 孔板中,培養24 h,待細胞貼壁后,按照1.3.2節的方法加入楊梅苷并設立對照組,培養48 h,收集細胞,采用PBS洗滌2 次。分別取1×105個HepG2細胞,每份樣品加入5 μL Annexin V染液和10 μL碘化丙啶染液,在4 ℃條件下避光染色30 min,通過流式細胞分析儀檢測HepG2細胞凋亡率。
用同樣的方式收集細胞,分別取1×105個HepG2細胞,在4 ℃條件下,采用1 mL體積分數70%乙醇溶液固定,培養12 h,然后將其以1 000 r/min離心5 min,除去固定液,用預冷的PBS洗滌3 次后,加入100 μL RNA酶(100 μg/mL),在37 ℃下消化30 min,加入100 μL碘化丙啶染色液(50 μg/mL),在4 ℃條件下避光染色30 min,最后通過流式細胞分析儀檢測HepG2細胞周期分布。
1.3.6 MDC熒光檢測HepG2細胞自噬
按照1.3.5節操作步驟將細胞培養24 h,待細胞貼壁后,棄去上清液,然后加入楊梅苷樣品溶液使楊梅苷終濃度分別為10、50、100、200 μmol/L,干預48 h后,吸去含楊梅苷的上清液,用Wash Buffer洗滌2 次,然后加入10 μL 50 μmol/L MDC染色液,在4 ℃條件下,避光孵育30 min,收集細胞,用預冷的PBS洗滌2 次,將所得的樣品置于流式細胞分析儀中檢測每個樣品細胞的平均熒光強度。
1.3.7 Western blot檢測HepG2細胞凋亡和自噬相關蛋白的表達量
采用Western blot法分析不同濃度楊梅苷對HepG2細胞凋亡和自噬相關蛋白表達量的影響。將對數期的HepG2細胞接種于直徑60 mm細胞培養皿(2.5×105個/皿),在37 ℃、5% CO2下培養24 h,按照1.3.2節的方法加入楊梅苷并設置對照組,培養48 h后,加入100 μL RIPA細胞裂解液提取細胞總蛋白,利用BCA蛋白濃度測定試劑盒測定總蛋白濃度。測定蛋白濃度后,吸取20 μL蛋白樣品上樣于質量分數5%~10%的十二烷基硫酸鈉-聚丙烯酰胺凝膠,進行電泳分離,冰浴下將其轉移至聚偏氟乙烯膜上,放入質量分數5%脫脂奶粉封閉液中,25 ℃搖床孵育1 h,加入對應的一抗后4 ℃孵育12 h。次日換為辣根過氧化物酶(horseradish peroxidase,HRP)標記的二抗孵育1 h,采用電致化學發光(electrochemiluminescence,ECL)顯影,然后通過凝膠成像檢測Bcl-2、Bax、Apaf-1、細胞色素c、Caspase-3/9、Beclin 1、Atg5、LC3-I、LC3-II和β-actin蛋白的表達情況。結果采用Image Lab軟件對相應蛋白表達水平進行定量分析。
1.4 數據處理與分析
每組實驗重復3 次,結果用平均值±標準差表示;采用Statistix 8.0軟件對每組實驗數據進行方差分析;采用SAS 8.0軟件,并利用Duncan法對結果進行差異顯著性分析;采用Origin 9.0軟件繪圖。
2 結果與分析
2.1 不同濃度楊梅苷對L-02和HepG2細胞存活率的影響
利用不同濃度的楊梅苷分別處理L-02和HepG2細胞24、48 h和72 h,其對L-02和HepG2細胞存活率的影響如圖2所示。
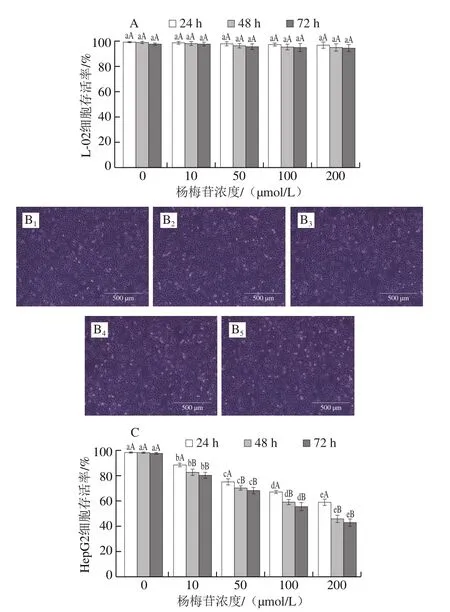
圖2 楊梅苷對L-02細胞和HepG2細胞存活率的影響Fig.2 Effect of myricitrin on the survival rates of L-02 cells and HepG2 cells
由圖2A可知,用10~200 μmol/L的楊梅苷處理正常肝細胞(L-02細胞)24、48 h和72 h,L-02細胞存活率均無顯著變化(P>0.05),表明楊梅苷在10~200 μmol/L的濃度范圍內對正常肝細胞(L-02)無損害作用。通過倒置顯微鏡進一步觀察L-02細胞形態,發現10~200 μmol/L的楊梅苷處理L-02細胞后,細胞的形態和數量與對照組相比均未發生明顯變化(圖2B),進一步證明楊梅苷在濃度為10~200 μmol/L下對正常肝細胞無毒。進一步研究在該濃度(10~200 μmol/L)范圍內楊梅苷對人肝癌細胞(HepG2細胞)存活率的影響,由圖2C可知,在處理時間相同的情況下,不同濃度的楊梅苷對HepG2細胞存活率影響顯著不同(P<0.05),隨楊梅苷濃度的增加,HepG2細胞存活率呈顯著降低趨勢(P<0.05),且呈濃度依賴關系。另一方面,相同濃度的楊梅苷分別處理HepG2細胞24、48、72 h后,HepG2細胞存活率顯著不同(P<0.05),處理24 h的HepG2細胞存活率顯著高于48 h和72 h(P<0.05),處理48 h和72 h的HepG2細胞存活率無顯著差異(P>0.05)。通過回歸擬合分析得到楊梅苷處理HepG2細胞24、48、72 h后的IC50分別為344.99、176.41、142.81 μmol/L,結果表明同濃度的楊梅苷處理細胞時間越長,IC50越小,對HepG2細胞的殺傷能力越強。MTT實驗結果顯示楊梅苷對人肝癌HepG2細胞的生長有顯著的抑制作用,其抑制作用與楊梅苷濃度和作用時間呈正相關。
2.2 不同濃度楊梅苷對HepG2細胞內ROS水平的影響
在正常情況下,機體內ROS的產生和清除處于動態平衡,適量ROS能提高巨噬細胞的吞噬能力,并且增強機體的免疫能力[16]。但當細胞受到外界應激原刺激時,胞內產生大量的ROS,過量的ROS對細胞膜、蛋白質和核酸造成氧化損傷,最終導致細胞凋亡[17]。為進一步探究楊梅苷是否能引起HepG2細胞內ROS水平的變化,本研究利用DCFH-DA熒光探針檢測不同濃度楊梅苷對HepG2細胞內ROS水平的影響,其平均熒光強度可直觀反映胞內ROS水平,結果如圖3所示。不同濃度楊梅苷(10~200 μmol/L)處理HepG2細胞,其胞內ROS水平顯著高于對照組(P<0.05),且楊梅苷濃度越大,HepG2細胞內ROS水平越高。表明楊梅苷能顯著提高HepG2細胞內ROS水平,進而誘發細胞凋亡。
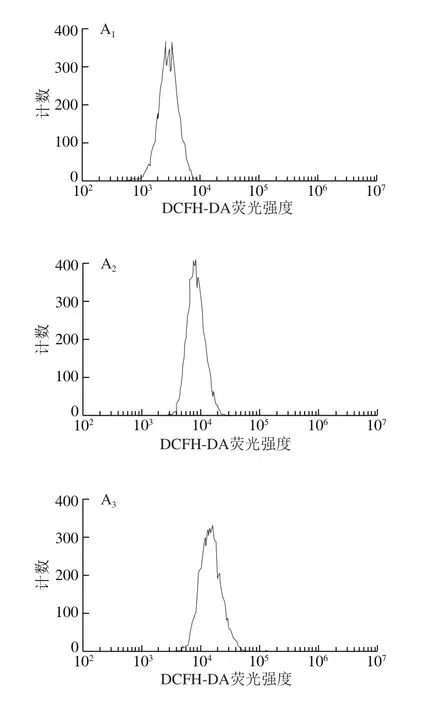

圖3 不同濃度楊梅苷對HepG2細胞內ROS水平的影響Fig.3 Effect of myricitrin at different concentrations on ROS levels in HepG2 cells
2.3 不同濃度楊梅苷對HepG2細胞形態的影響
由2.2節結果可知,楊梅苷能顯著提高HepG2細胞內ROS水平,大量研究表明過量的ROS會誘導細胞凋亡[18-19]。為進一步驗證楊梅苷是否能夠誘導HepG2細胞凋亡,本實驗采用Hoechst 33342染色法對HepG2細胞進行染色,利用激光共聚焦顯微鏡觀察染色后的HepG2細胞形態,結果如圖4所示。與對照組相比,楊梅苷(10~200 μmol/L)干預后的HepG2細胞數量明顯減少,不規則細胞數增多,細胞核的藍色熒光強度明顯增強。表明楊梅苷可通過誘導HepG2細胞凋亡而抑制其生長,從而達到抗肝癌的效果。

圖4 激光共聚焦顯微鏡下觀察不同濃度楊梅苷對HepG2細胞形態的影響(100×)Fig.4 Effect of myricitrin at different concentrations on HepG2 cell morphology observed by laser confocal microscope (100 ×)
2.4 不同濃度楊梅苷對HepG2細胞凋亡率的影響
目前大量研究已經證明楊梅苷具有抗氧化和清除自由基的能力[20],對癌細胞的增殖具有顯著的抑制作用,并能加速癌細胞的凋亡[21]。因此,本研究在MTT和Hoechst 33342實驗的基礎上,采用流式細胞分析儀進一步探究不同濃度楊梅苷對HepG2細胞凋亡率的影響,結果如圖5所示。隨楊梅苷濃度增加,HepG2細胞凋亡率顯著增加(P<0.05),且呈濃度依賴效應。當楊梅苷濃度為10、50、100、200 μmol/L時,HepG2細胞凋亡率分別為(15.14±1.05)%、(25.74±1.38)%、(35.16±2.04)%和(55.75±1.99)%,與對照組相比,凋亡率分別增加12.60%、23.20%、32.62%和53.21%。表明楊梅苷可抑制HepG2細胞增殖,加速細胞凋亡,且濃度越大,促凋亡效果越顯著。
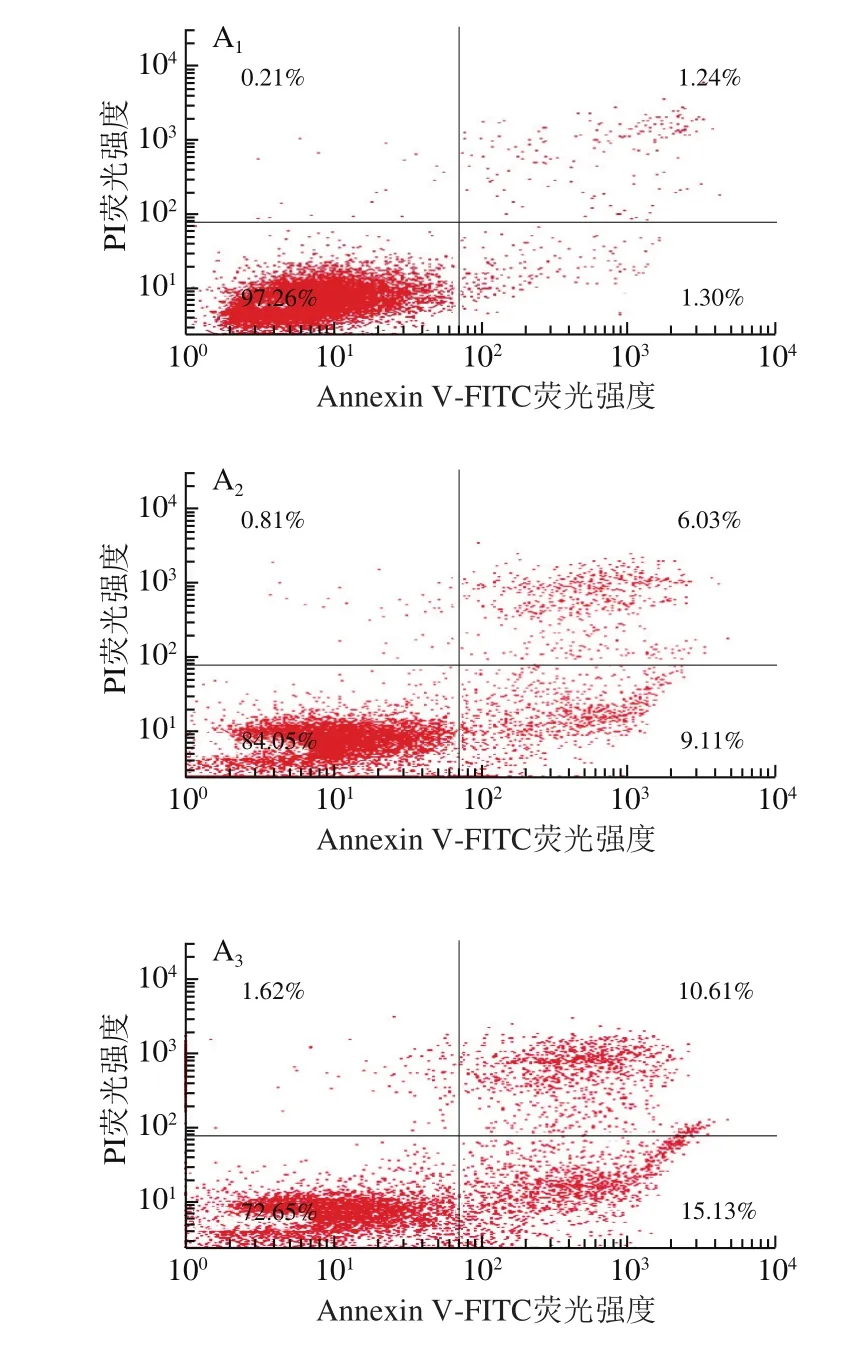
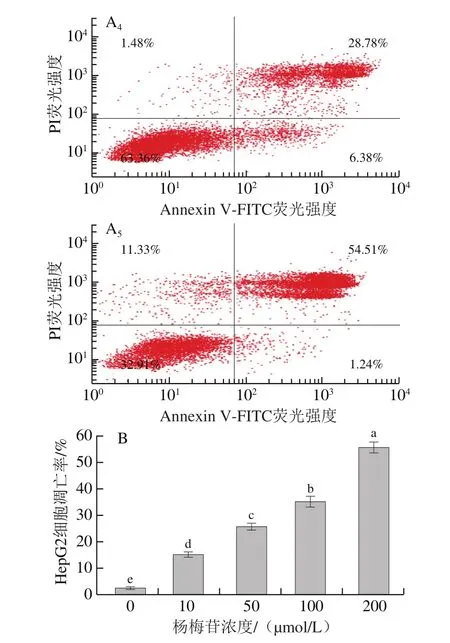
圖5 不同濃度楊梅苷對HepG2細胞凋亡的影響Fig.5 Effect of myricitrin at different concentrations on apoptosis in HepG2 cells
2.5 不同濃度楊梅苷對HepG2細胞周期的調控

為探究楊梅苷對HepG2細胞的生長抑制是否與細胞周期阻滯有關,本研究考察了不同濃度楊梅苷對HepG2細胞周期分布規律的影響,結果如圖6所示。當楊梅苷濃度在10~200 μmol/L時,隨楊梅苷濃度增加G0/G1期的細胞比例顯著降低(P<0.05),而G2/M期的細胞比例顯著增加(P<0.05),且呈濃度依賴性。當楊梅苷濃度為50 μmol/L和100 μmol/L時,S期細胞比例無顯著差異(P>0.05),而高濃度(200 μmol/L)楊梅苷處理的HepG2細胞,其S期細胞比例均顯著高于對照組和低濃度楊梅苷處理組(P<0.05)。實驗結果表明楊梅苷對HepG2細胞周期有調控作用,可將細胞周期阻滯在G2/M期,高劑量的楊梅苷還可使HepG2細胞阻滯于S期,從而抑制HepG2細胞的增殖。
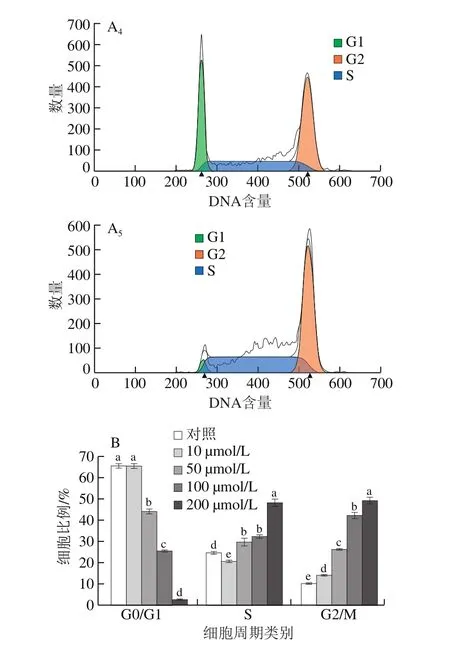
圖6 不同濃度楊梅苷對HepG2細胞周期分布的影響Fig.6 Effect of myricitrin at different concentrations on cell cycle distribution in HepG2 cells
2.6 不同濃度楊梅苷對HepG2細胞自噬的影響
2.4節和2.5節結果表明楊梅苷可通過誘導HepG2細胞凋亡,調控細胞周期,起到抑制HepG2細胞增殖的作用。在此基礎上,本研究進一步探究楊梅苷可否通過誘導HepG2細胞自噬從而抑制其增殖。自噬體和溶酶體均為酸性液泡,MDC作為嗜酸性的染色劑,能與細胞中酸性液泡發生特異性結合而產生熒光,熒光強度的大小能直觀反映藥物對細胞自噬作用的強弱[22-23]。本研究采用MDC染色法檢測不同濃度楊梅苷對HepG2細胞內平均熒光強度的影響,其結果如圖7所示。與對照組相比,樣品組HepG2細胞中MDC平均熒光強度隨楊梅苷濃度的增加顯著增強(P<0.05),當楊梅苷濃度為10、50、100、200 μmol/L時,HepG2細胞中MDC平均熒光強度較對照組分別提高了0.26、0.43、0.74、1.20 倍。表明楊梅苷可誘導HepG2細胞自噬,從而抑制HepG2細胞增殖。

圖7 不同濃度楊梅苷對HepG2細胞自噬的影響Fig.7 Effect of myricitrin at different concentrations on autophagy in HepG2 cells
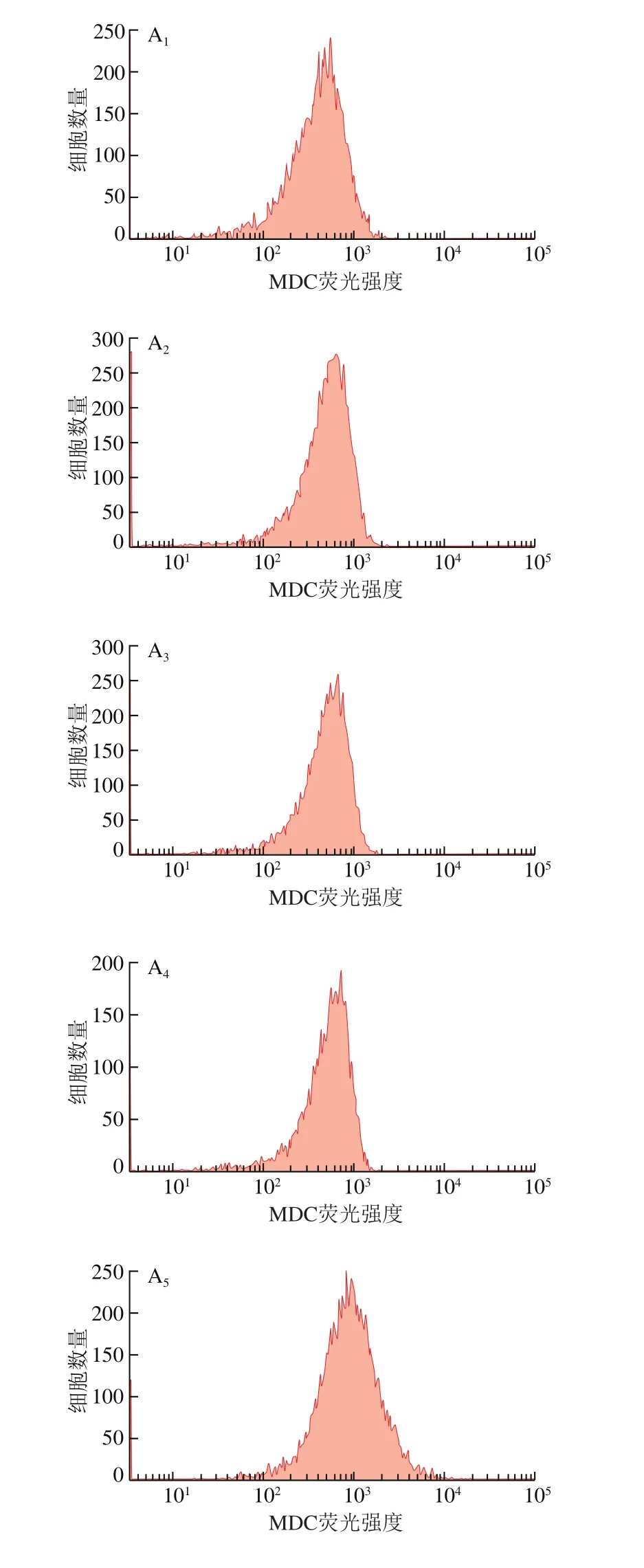
2.7 不同濃度楊梅苷對HepG2細胞凋亡相關蛋白表達的影響
在真核生物中,線粒體作為能量和代謝的中心,為細胞的生命活動提供必要的基礎能量,同時也作為細胞凋亡的控制中心,在各種信號通路中起著關鍵性作用[24-25]。線粒體通路中的Bcl-2家族在細胞凋亡中發揮“主開關”作用。Bax的作用與之相反,通過改變細胞膜電位促進細胞色素c釋放和凋亡酶激活因子(Apaf-1)表達量增加,促使細胞色素c和Apaf-1形成多聚體,激活Caspase家族和自噬效應蛋白(Beclin 1),導致細胞發生凋亡[26-27]。為進一步探究楊梅苷對HepG2細胞抗腫瘤作用的分子機制,采用Western blot檢測不同濃度楊梅苷對凋亡相關蛋白表達量,結果如圖8所示。與對照組相比,楊梅苷實驗組中Bax、細胞色素c、Caspase-9和Caspase-3相對表達量均顯著上調(P<0.05),50、100、200 μmol/L楊梅苷實驗組中Apaf-1相對表達量均顯著上調(P<0.05);楊梅苷實驗組Bcl-2相對表達量顯著下調(P<0.05),且呈濃度依賴性。以上結果表明楊梅苷能激活線粒體介導的凋亡通路,上調促凋亡相關蛋白表達水平,下調抑制凋亡的相關蛋白表達水平,進而抑制HepG2細胞增殖,加速細胞凋亡,起到抗肝癌的作用。

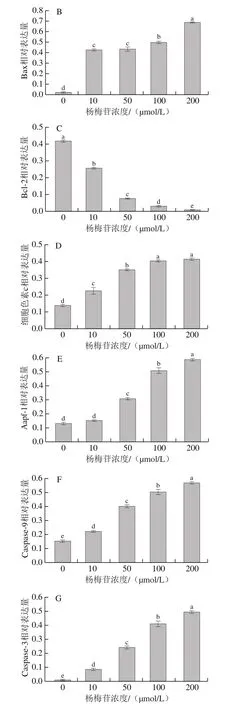
圖8 不同濃度楊梅苷對HepG2細胞凋亡相關蛋白相對表達量的影響Fig.8 Effect of myricitrin at different concentrations on the relative expression levels of apoptosis-related proteins in HepG2 cells
2.8 不同濃度楊梅苷對HepG2細胞自噬相關蛋白表達量的影響
細胞自噬被過多激活,則會引發細胞II型程序性死亡[28]。細胞自噬平衡被打破與腫瘤的發生發展密切相關,細胞自噬過程涉及多個關鍵因子,Beclin 1是一個重要的抑癌蛋白,在細胞自噬啟動過程中起著關鍵的調節作用,同時能下調Bcl-2蛋白表達,上調促凋亡蛋白Bax表達,最終加速腫瘤細胞凋亡[29]。Atg5是一種常見的自噬相關蛋白,能促進自噬發生和細胞色素c釋放,激活Caspase級聯反應,使腫瘤細胞發生凋亡[30]。LC3-I和LC3-II是自噬體經典的標志蛋白,在自噬發生過程中,LC3-I轉化為LC3-II[31]。本研究進一步采用Western blot檢測楊梅苷處理的HepG2細胞自噬相關蛋白表達量,其結果如圖9所示。與對照組相比,不同濃度楊梅苷(10~200 μmol/L)處理的HepG2細胞的Beclin 1、Atg5和LC3-II相對表達量顯著上調(P<0.05),而LC3-I相對表達量顯著下調(P<0.05)。除楊梅苷濃度為10 μmol/L和50 μmol/L時Atg5相對表達量無顯著差異(P>0.05)外,其余細胞自噬相關蛋白表達量均與楊梅苷濃度呈正相關。以上結果進一步證實楊梅苷可促進HepG2細胞自噬,從而抑制HepG2細胞增殖,達到抗肝癌的作用。

圖9 不同濃度楊梅苷對HepG2細胞自噬相關蛋白相對表達量的影響Fig.9 Effect of myricitrin at different concentrations on the relative expression levels of autophagy-related proteins
通過上述結果可知,當HepG2細胞受到楊梅苷干預后,細胞內ROS水平提升,誘導HepG2細胞形態發生變化,Hoechst 33342染色結果證實楊梅苷處理后HepG2細胞核具有較強的藍色熒光,流式細胞儀檢測結果顯示楊梅苷均能顯著提高HepG2細胞的凋亡率和胞內MDC平均熒光強度,并將HepG2細胞周期阻滯在G2/M期,從而抑制HepG2細胞增殖;Western blot結果表明楊梅苷能上調Bax、細胞色素c、Apaf-1、Caspase-9、Caspase-3、Beclin 1、Atg5和LC3-II的相對表達量,下調Bcl-2和LC3-I的相對表達量,表明楊梅苷的抗肝癌機制與激活線粒體介導的凋亡通路、細胞周期阻滯和提升胞內ROS水平和促進細胞自噬有關。楊梅苷誘導HepG2細胞凋亡和自噬的途徑如圖10所示。
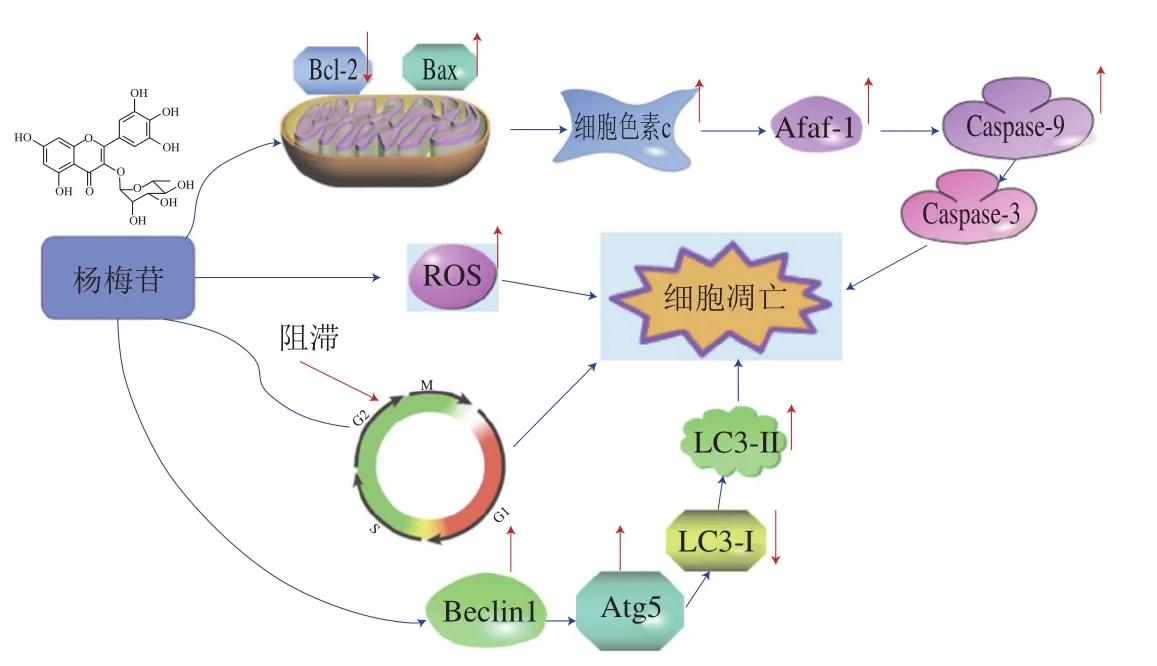
圖10 楊梅苷誘導HepG2細胞凋亡和自噬的相關途徑Fig.10 Apoptosis and autophagy induced by myricitrin in HepG2 cells
3 結 論
本研究結果表明楊梅苷可通過激活線粒體介導的細胞凋亡通路、阻滯細胞周期、提升胞內ROS水平并促進細胞自噬來誘導人肝癌HepG2細胞凋亡,降低其存活率,從而起到抗肝癌作用。研究結果可為楊梅苷作為天然抗肝癌藥物的開發提供理論參考。

