PI3K/AKT通路與TRPC6通道在Ang Ⅱ誘導足細胞損傷中的相互作用
王先鶴,吳 慢,鄧 芳,2,高 慧
眾所周知,足細胞是腎小球濾過膜的重要組成部分,其結構的損傷和功能的改變都會影響腎小球濾過膜的通透性。腎素-血管緊張素系統(renin-angiotensin system, RAS)在維持腎臟生理功能及腎臟疾病的發生、發展過程中發揮著重要作用,血管緊張素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)是RAS的主要效應分子,在足細胞損傷以及蛋白尿的發生過程中發揮主要作用。足細胞表達的瞬時受體電位陽離子通道蛋白6(transient receptor potential cation channel protein 6, TRPC6)是一種非選擇性陽離子通道,屬于足細胞裂孔膜蛋白的一種。磷脂酰肌醇-3-激酶/蛋白激酶B(phosphatidylinositol-3-kinase/protein kinase B, PI3K/AKT)信號通路是足細胞肌動蛋白細胞骨架動力學的重要調節劑,該信號通路的激活,是維持足細胞功能完整性的重要組成部分。該研究旨在進一步探討PI3K/AKT信號通路與TRPC6通道在Ang Ⅱ誘導的腎小球足細胞損傷中的相互作用,為腎小球疾病的診治和用藥新靶點的研究提供新的思路及依據。
1 材料與方法
1.1 實驗材料
小鼠足細胞MPC5細胞株購自北京北納創聯生物技術研究院;DMEM低糖培養基購自美國HyClone公司;胎牛血清(FBS)購自以色列BI公司;Ang Ⅱ購自美國Sigma公司;氯沙坦(貨號:ab120997)、PI3K/AKT通路抑制劑(貨號:LY294002)、TRPC6通道阻滯劑(貨號:SKF96365)、兔抗磷酸化蛋白激酶B(phosphorylated protein kinase B,p-AKT)抗體購自英國Abcam公司;兔抗AKT、TRPC6抗體購自美國CST公司;兔抗β-actin單克隆抗體、辣根過氧化物酶標記的羊抗兔IgG購自武漢三鷹生物技術有限公司;增強化學發光(ECL)試劑盒購自上海Tanon公司;反轉錄試劑盒、實時熒光定量PCR 試劑盒購自日本 Takara公司;實時熒光PCR引物購自生工生物工程(上海)股份有限公司);Hoechst 33258染色試劑盒購自上海貝博生物科技有限公司。1.2 方法
1
.2
.1
足細胞的培養 將MPC5足細胞置于含1%的青鏈霉素、10%胎牛血清的DEME低糖培養基中,于37 ℃、5%CO培養箱中進行培養,每2 d換液1次,待培養瓶中細胞增殖至80%左右時接種到6孔板或12孔板中,使每孔細胞數量達到80%后用于進一步實驗。1
.2
.2
實驗分組 根據實驗目的將足細胞進行分組:① 空白對照組,空白處理。② Ang Ⅱ組:加入Ang Ⅱ,使其濃度保持在1 μmol/L。③ Ang Ⅱ+氯沙坦組:加入Ang Ⅱ和氯沙坦,使其濃度均保持在1 μmol/L。④ 氯沙坦組:加入氯沙坦,使其濃度保持在1 μmol/L。⑤ Ang Ⅱ+LY294002組:加入Ang Ⅱ和LY294002,使其濃度分別保持在1 μmol/L和10 μmol/L。⑥ LY294002組: 加入LY294002,使其濃度保持在10 μmol/L。⑦ Ang Ⅱ+SKF96365組:加入Ang Ⅱ和SKF96365,使其濃度分別保持在1 μmol/L和40 μmol/L。⑧ SKF96365組:加入SKF96365,使其濃度保持在40 μmol/L。將上述分組細胞置于培養箱繼續培養24 h后進行試驗。1
.2
.3
qRT-
PCR反應 采用TRIzol Reagent試劑(1 ml/孔)提取各組足細胞中的總RNA,并以提取的RNA樣本為模板反轉錄為cDNA。采用SYBR Green法對cDNA樣品進行實時熒光定量PCR。反應條件為:95 ℃預變性10 min后進入循環;95 ℃、10 s,60 ℃、30 s,擴增40個循環;每組設3個復孔,采用2法分析相對表達量。反應引物合成序列為:β-actin,(F) 5′-CATCCTCATGAAGATCCTGACC-3′,(R)5′-CACAGCTTCTCTTTGATGTCAC-3′;TRPC6,(F)5′-CTTCC TGGCTCTCATATACTGG-3′,(R)5′-TGTGCTACAAACTTCATGAACG-3′。1
.2
.4
Western blot實驗 采用Western blot測定足細胞中AKT、p-AKT、TRPC6蛋白質表達的變化。將細胞培養板置于冰上,PBS清洗后,收集細胞并且提取足細胞總蛋白,BCA法測定各組蛋白的濃度,按照蛋白定量的結果上樣,經過10% SDS-PAGE凝膠電泳,恒定電流轉至NC膜上,然后放入5%脫脂牛奶室溫封閉2 h,經TBST洗膜,放入一抗AKT(1 ∶1 000)、p-AKT(1 ∶1 000)、TRPC6(1 ∶1 000)中4 ℃孵育過夜,TBST洗膜,室溫下孵育羊抗兔二抗(1 ∶5 000)2 h,再次TBST洗膜后,加入ECL顯影液進行顯色曝光,通過化學發光檢測系統曝光記錄圖片并分析條帶灰度值。以β-actin為內參照。1
.2
.5
Hoechst 33258染色法 采用Hoechst 33258染色法檢測足細胞凋亡情況。將足細胞接種于放有玻片的12孔板中,待細胞接種24 h后,去除培養液,用PBS洗滌3遍。室溫下用4%多聚甲醛固定細胞5 min,PBS洗滌3次。隨后加入適量Hoechst 33258染色液覆蓋玻片,置于37 ℃孵箱孵育20 min后,吸除Hoechst 33258染色液,用PBS洗滌3次。最后進行封片,在熒光顯微鏡下觀察。當細胞發生凋亡時,在熒光顯微鏡下觀察會看到凋亡細胞的細胞核呈致密濃染,或呈碎塊狀致密濃染。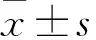
2 結果
2.1 Ang Ⅱ及SKF96365加藥處理后對足細胞TRPC6蛋白及PI3K/AKT通路的影響
通過qRT-PCR檢測各組細胞TRPC6 mRNA表達量,結果顯示:與空白對照組相比,Ang Ⅱ組的TRPC6 mRNA表達增多(F
=25.460,P
<0.01);與Ang Ⅱ組相比,Ang Ⅱ+SKF96365組的TRPC6 mRNA表達減少(F
=16.431,P
<0.01),差異有統計學意義,見圖1。Western blot測定各組細胞TRPC6、AKT、p-AKT蛋白表達量,結果顯示:與空白對照組相比,Ang Ⅱ組的TRPC6蛋白表達增多(F
=18.750,P
<0.05);與Ang Ⅱ組相比,Ang Ⅱ+SKF96365組TRPC6的蛋白表達減少(F
=13.596,P
<0.01),差異有統計學意義。各組細胞AKT的表達差異無統計學意義。與空白對照組相比,Ang Ⅱ組AKT的磷酸化水平降低(F
=15.610,P
<0.01);與Ang Ⅱ組相比,Ang Ⅱ+SKF96365組AKT的磷酸化水平升高(F
=33.839,P
<0.05),差異均有統計學意義,見圖2。
圖1 各組足細胞TRPC6 mRNA表達量

圖2 各組足細胞AKT、p-AKT、TRPC6蛋白表達量
2.2 Ang Ⅱ及LY294002加藥處理后對足細胞
TRPC6蛋白及PI3K/AKT通路的影響
通過qRT-PCR檢測各組細胞TRPC6 mRNA表達量,結果顯示:與空白對照組相比,Ang Ⅱ組的TRPC6 mRNA表達增多(F
=27.011,P
<0.01),差異有統計學意義;與Ang Ⅱ組相比較,Ang Ⅱ+LY294002組TRPC6 mRNA表達差異無統計學意義。見圖3。Western blot測定各組細胞TRPC6、AKT、p-AKT蛋白表達量,結果顯示:與空白對照組相比,Ang Ⅱ組的TRPC6蛋白表達增加(F
=6.699,P
<0.05),差異有統計學意義;與Ang Ⅱ組相比較,Ang Ⅱ+LY294002組TRPC6蛋白表達差異無統計學意義。各組細胞AKT的表達差異無統計學意義。與空白對照組相比,Ang Ⅱ組AKT的磷酸化水平降低(F
=16.371,P
<0.05);與Ang Ⅱ組相比,Ang Ⅱ+LY294002組AKT的磷酸化水平降低(F
=33.839,P
<0.05),差異有統計學意義。見圖4。
圖3 各組足細胞TRPC6 mRNA表達量

圖4 各組足細胞AKT、p-AKT、TRPC6蛋白表達量
2.3 Ang Ⅱ及氯沙坦加藥處理后對足細胞TRPC6蛋白及PI3K/AKT通路的影響
通過qRT-PCR檢測各組細胞TRPC6 mRNA表達量,結果顯示:與空白對照組相比,Ang Ⅱ組TRPC6 mRNA表達增多(F
=7.116,P
<0.05);與Ang Ⅱ組相比,Ang Ⅱ+氯沙坦組TRPC6 mRNA表達減少(F
=18.713,P
<0.05),差異有統計學意義。見圖5。Western blot測定各組細胞TRPC6、AKT、p-AKT蛋白表達量,結果顯示:與空白對照組相比,Ang Ⅱ組的TRPC6蛋白表達增多(F
=18.001,P
<0.01);與Ang Ⅱ組相比,Ang Ⅱ+氯沙坦組的TRPC6蛋白表達減少(F
=43.204,P
<0.01),差異均有統計學意義。各組細胞AKT的表達差異無統計學意義。與空白對照組相比,Ang Ⅱ組AKT的磷酸化水平降低(F
=23.570,P
<0.01);與Ang Ⅱ組相比,Ang Ⅱ+氯沙坦組AKT的磷酸化水平升高(F
=25.975,P
<0.01),差異有統計學意義。見圖6。
圖5 各組足細胞TRPC6 mRNA表達

圖6 各組足細胞AKT、p-AKT、TRPC6蛋白表達
2.4 Ang Ⅱ及SKF96365、LY294002、氯沙坦加藥處理后對足細胞凋亡的影響
通過Hoechst 33258染色法進行檢測各組細胞凋亡情況,圖中細胞核呈致密濃染或呈碎塊狀致密濃染的細胞為凋亡細胞,統計各組細胞凋亡率,結果顯示:與空白對照組相比,Ang Ⅱ組的細胞凋亡增多(F
=496.2,P
<0.05);與Ang Ⅱ組相比,Ang Ⅱ+ SKF96365組的細胞凋亡減少(F
=506.3,P
<0.05),差異均有統計學意義。與Ang Ⅱ組相比,Ang Ⅱ+LY294002組的細胞凋亡增多(F
=1 261.063,P
<0.05),差異均有統計學意義。與Ang Ⅱ組相比,Ang Ⅱ+氯沙坦組的細胞凋亡減少(F
=560.184,P
<0.05),差異均有統計學意義。見圖7。
圖7 各組足細胞的凋亡情況 Hoechst 33258染色 ×400
3 討論
腎小球濾過屏障由內皮細胞、基底膜和足細胞構成,足細胞的結構與功能的正常對于腎小球濾過作用非常重要。在腎臟損傷的疾病當中,腎小球的損傷最為突出,而足細胞的損傷又是腎小球損傷的中心環節,因此研究腎小球足細胞的損傷機制顯得尤為重要。有研究表明過敏性紫癜性腎炎患兒發病過程中存在足細胞損傷與脫落,且疾病活動期足細胞脫落明顯增加。作為RAS的主要效應分子之一,Ang Ⅱ在正常的腎臟穩態維持中起著重要的作用。Ang Ⅱ的異常分泌與腎臟疾病的發展有關。研究報道,Ang Ⅱ可促進足細胞損傷。李濤 等研究表明過敏性紫癜性腎炎患兒尿中血管緊張素原水平顯著增高,提示腎內RAS可能參與了過敏性紫癜性腎炎的發病。以上研究表明Ang Ⅱ水平的升高會損傷足細胞,本研究結果也支持此觀點。
TRPC6通道蛋白被證實屬于足細胞裂孔膜蛋白之一并指出Ang Ⅱ通過作用于TRPC6通道蛋白參與足細胞細胞骨架的重構。有研究指出,TRPC6與Podocin、Nephrin、ACTN4及CD2AP等多種足細胞裂孔膜蛋白相互作用,共同維系腎小球足細胞的結構及功能。再結合本研究,推測Ang Ⅱ主要通過Ang Ⅱ受體1激活TRPC6通道蛋白的表達,改變足細胞結構,從而導致足細胞凋亡。
研究表明,PI3K/AKT信號通路與腎臟疾病有關,PI3K/AKT信號通路的激活可以抑制腎細胞凋亡并阻止間質纖維化的形成。AKT被PI3K激活,而PI3K /AKT信號通路在抗足細胞凋亡中起著至關重要的作用。本實驗結果顯示,加入Ang Ⅱ處理后,AKT磷酸化水平降低且細胞凋亡率增加,與Wang et al研究結果相一致。結果說明,TRPC6通道蛋白與PI3K/AKT信號通路在Ang Ⅱ致足細胞的凋亡過程中均發揮重要作用。
本實驗采用TRPC6通道阻滯劑SKF96365阻斷TRPC6通道蛋白的活化,研究TRPC6通道對于PI3K/AKT信號通路的影響;采用PI3K/AKT 通路抑制劑LY294002阻斷PI3K/AKT信號通路的激活,研究PI3K/AKT 信號通路對TRPC6通道的影響。研究結果顯示,Ang Ⅱ+ SKF96365組與Ang Ⅱ相比較,TRPC6 mRNA和蛋白的表達減少,而AKT的磷酸化水平卻相對增加,并且細胞凋亡相對減少;這說明采用TRPC6通道阻滯劑阻斷TRPC6通道蛋白可以增加PI3K/AKT信號通路的激活,從而減少細胞凋亡。從Ang Ⅱ+ LY294002組與Ang Ⅱ相比較可以看出,加入LY294002處理后,足細胞TRPC6 mRNA和蛋白的變化差異無統計學意義,但細胞凋亡依然增多,說明抑制PI3K/AKT信號通路的激活可以導致足細胞凋亡增加,但PI3K/AKT信號通路的變化對TRPC6通道蛋白未見影響。以上結果表明,Ang Ⅱ可能通過激活TRPC6通道進而抑制PI3K/AKT通路的激活而導致足細胞損傷。并且,本實驗通過采用氯沙坦阻斷Ang Ⅱ受體1,結果顯示AKT 磷酸化水平升高,TRPC6的表達下降,而足細胞凋亡相對減少,進一步說明了Ang Ⅱ激活TRPC6通道進而抑制PI3K/AKT通路的激活而導致足細胞損傷的過程中主要是通過與Ang Ⅱ受體1的結合而發揮作用。而對于在Ang Ⅱ通過活化TRPC6通道調控PI3K/AKT信號通路影響足細胞凋亡的過程中其下游具體有哪些因素的參與,有待后續的研究進行探討。
綜上所述,Ang Ⅱ激活TRPC6通道導致足細胞損傷的過程中,可能是通過進一步抑制PI3K/AKT通路激活實現的。阻斷TRPC6通道的活化,有利于PI3K/AKT信號通路的激活,進而減少足細胞凋亡從而起到保護足細胞的調控作用。

