蘋果酸酶2乙酰化調控腦膠質瘤細胞增殖的機制
張 成,牛朝詩,梅加明,司文霞,魏祥品
腦膠質瘤是中樞神經系統最常見的原發性腫瘤,約占顱內腫瘤的半數以上,惡性程度高,易復發,對放化療不敏感,治療困難。近幾年來,人們對腫瘤細胞代謝的認識逐漸加深,靶向腫瘤細胞代謝成為一種有前景的治療策略。
蘋果酸酶2(malic enzyme 2,ME2)是蘋果酸酶家族的一員,定位于線粒體中。作為調控線粒體氧化還原穩態的代謝酶,ME2在包括腦膠質瘤在內的許多腫瘤中高表達,然而其作用機制并不清楚。研究指出乙酰化修飾在調控腫瘤細胞代謝中發揮關鍵作用,該研究旨在闡明ME2乙酰化修飾的分子機制及其在惡性腦膠質瘤增殖中的功能,為進一步的體內研究提供支撐。
1 材料與方法
1.1 材料
1
.1
.1
質粒 pCDNA3.1-HA質粒、pCDNA3.1-Flag質粒、shRNA空載體質粒pLKO.1和慢病毒包裝系統質粒pMD2.G、pSPAX由本實驗室保存。1
.1
.2
細胞 人腦星形膠質母細胞瘤細胞系U87MG和人腎上皮細胞系293T購自中國科學院上海細胞庫。1
.1
.3
主要試劑 胎牛血清(FBS)及DMEM培養基購自美國Hyclone公司;鼠抗人Flag、HA、actin抗體購自武漢ABclonal公司;去乙酰化酶Sirtuin3(deacetylate Sirtuins 3,SIRT3)(#2627)、ME2(#12399)、pan-AcK(#9441)購自美國cell signaling technology公司;L
-蘋果酸、Flag 磁株(M2)購自美國sigma公司;轉染試劑lipo2000購自美國Thermo Fisher公司;活性氧(reactive oxygen species,ROS)檢測試劑盒(#S0033)、CCK-8試劑盒(#C0038)和RIPA細胞裂解液(#P0013D)購自于上海碧云天公司。SIRT3 siRNA序列:5′-AAGUCUGGAAUGCCACUGGTT-3′,由上海吉瑪公司合成。 ME2 shRNA靶序列為5′-GCACGGCTGAAGAAGCATATA-3′,連接于pLKO.1-puro 載體上。1.2 方法
1
.2
.1
細胞培養 U87MG細胞置于37 ℃、5%CO恒溫培養箱中培養;90%DMEM培養基加入10%FBS配制成完全培養基。1
.2
.2
免疫沉淀 本研究主要涉及到的蛋白表達質粒包括ME2野生型(WT)和ME2突變體(K156Q和K156R)。293T細胞轉染相應質粒48 h后,加入RIPA細胞裂解液(含蛋白酶抑制劑),30 min后,12 000 r/min離心20 min,取上清液加入15 μl Flag beads,于4 ℃孵育過夜。再將beads用裂解液清洗3次(2 000 r/min離心2 min),最后吸盡上清液,加入40~60 μl 1×上樣緩沖液,置于95 ℃煮10 min,離心后,樣本可用于檢測ME2的乙酰化修飾或蛋白相互作用,或將樣本凍存于-80 ℃。1
.2
.3
Western blot 將蛋白樣品上樣后,80 V電泳30 min,轉至120 V電泳至結束。濕轉法將蛋白轉至PVDF膜上,將膜置于5%脫脂牛奶,室溫封閉1 h。加入一抗,4 ℃孵育過夜,TBST洗膜3次。加入二抗,室溫孵育1 h。TBST洗膜3次。最后,通過ECL化學發光顯影,并用凝膠成像系統拍照。1
.2
.4
慢病毒包裝和感染 在10 cm培養皿中鋪293T細胞,待密度80%左右時共轉染1 μg pMD2.G、3 μg pSPAX和4 μg目的質粒,進行包裝病毒。8 h后換液,36~48 h后收含有病毒的細胞上清液,離心后感染U87MG細胞。感染48 h后,更換含有2 μg/ml 嘌呤霉素抗性的培養基,篩選穩定過表達或者敲低的細胞系。1
.2
.5
ME2酶活檢測 293T細胞轉染對應的質粒,將WT或K156R突變體分別與pCDNA3.1-Flag空載體或HA-SIRT3質粒共轉染。48 h后,將細胞裂解,用Flag磁珠純化ME2蛋白。將蛋白與180 μl酶活反應液(33 mmol/L KHPO,3.3 mmol/L MgCl,167 μmol/L NAD,167 μmol/LL
-蘋果酸)混合。隨即用酶標儀讀取340 nm下的吸光度值,每30 s測1次,持續30 min。計算每秒生成NADH的摩爾數(μmol NADH/s)即為ME2相對活性。1
.2
.6
ROS水平檢測 293T細胞轉染對應的質粒,control組轉染pCDNA3.1-Flag空載體質粒,ME2組轉染Flag-ME2質粒,ME2+SIRT3組轉染Flag-ME2和HA-SIRT3質粒。48 h后,將細胞消化收集,重懸于PBS中,加入終濃度20 μmol/L的熒光探針DCFH-DA,37 ℃孵育20 min,每隔3~5 min顛倒混勻。反應結束后,用PBS清洗3次,計數,將酶標儀設置488 nm激發波長,525 nm發射波長,讀取細胞熒光值,計算ROS相對水平。具體操作參考上海碧云天公司細胞ROS檢測試劑盒說明書。1
.2
.7
NADH測定 U87MG細胞內NADH含量通過NAD(P)H-Glo Detection System (Promega G9072)試劑盒測定。實驗方法同1.2.5細胞裂解后離心分離上清液,將上清液與酶活反應液混合,隨即用酶標儀讀取340 nm下的吸光度值,以每毫克蛋白對應測得的NADH量(nmoL/mg蛋白)反映胞內的NADH水平。1
.2
.8
U87MG細胞增殖 將處理后的U87MG細胞野生型或者K156Q突變型消化重懸后,按照2 000個/100 μl加入96孔板,同時設置無細胞空白對照組,分別于第1、2、3、4、5天的時間點,每孔加入10 μl CCK-8溶液,于37 ℃避光孵育2 h后,用酶標儀讀取450 nm的吸光度值(OD)。以時間為橫坐標,相對OD值為縱坐標,繪制細胞增殖曲線。具體操作參考CCK-8檢測試劑盒說明書。例4:原文:Liam Hennessy:What on earth makes you think I know who killed your daughter?
1
.2
.9
裸鼠成瘤 購買4~6周齡的雌性BALB/c-nu/nu裸鼠,將U87MG細胞野生型或者K156Q突變型消化處理后,制成1.0×10個/ml細胞懸液,每只裸鼠注射劑量為0.1 ml,接種于裸鼠左側腹部皮下建立裸鼠荷瘤模型。觀察并測量記錄成瘤情況,直到第22天實驗結束時停止。第22天時,斷頸處死裸鼠,剝離腫瘤塊,拍照、稱重。1
.2
.10
臨床樣本檢測 取實驗室凍存的臨床腦膠質瘤樣本,將癌和癌旁組織(病變部位旁2 cm之外的組織區域)分別研磨,裂解提取蛋白,用ME2的抗體進行免疫沉淀,純化ME2蛋白,再通過Western blot檢測ME2的乙酰化修飾。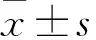
2 結果
2.1 K156乙酰化對ME2催化活性的影響
通過檢索質譜數據庫并比較各物種ME2蛋白序列的保守性,猜測K156位可能是ME2的乙酰化位點,見圖1A。將K156位點突變成模擬乙酰化的Q和模擬去乙酰化的R,然后用泛乙酰化抗體檢測修飾水平的變化,結果如圖1B所示:K156R和K156Q突變體的乙酰化水平與野生型相比降低。因為乙酰化修飾往往參與調控代謝酶活性,于是本研究檢測了WT與K156R的活性,結果顯示K156R突變對酶的活性無顯著影響,而K156Q突變體活性降低,差異有統計學意義(t
=17.94,P
<0.001),見圖1C。
圖1 ME2乙酰化位點的鑒定及其對酶活的影響
2.2 SIRT3去乙酰化ME2
ME2定位在線粒體中,作為線粒體主要的去乙酰化酶,SIRT3與ME2相互作用(圖2A)。同時,外源過表達SIRT3會降低ME2的乙酰化修飾水平(圖2B),而敲低SIRT3則提高ME2乙酰化修飾(圖2C)。
圖2 SIRT3與ME2的相互作用及對ME2乙酰化的影響
2.3 SIRT3對ME2催化活性及細胞內ROS水平的影響
為了研究SIRT3調控的ME2乙酰化在細胞內的生理功能,將SIRT3與ME2共轉染,結果顯示,相較于Control組,過表達SIRT3提高了WT的活性(t
=11.33,P
<0.01),而對K156R活性沒有影響(圖3A),表明K156乙酰化負調控ME2活性。此外,因為ME2催化反應生成的NADH是細胞重要的還原力,相較于WT細胞內ROS和NADH水平,過表達ME2降低了細胞內的ROS水平(t
=9.98,P
<0.01),提高了NADH水平(t
=4.31,P
<0.01);而同時過表達ME2和SIRT3則進一步降低ROS(t
=15.15,P
<0.01),提高胞內NADH含量(t
=10.13,P
<0.01),差異有統計學意義(圖3B、C)。
圖3 SIRT3對ME2活性和細胞ROS及NADH水平的影響
2.4 ME2乙酰化修飾對惡性腦膠質瘤細胞增殖的影響
為了研究SIRT3調控的ME2乙酰化對U87MG細胞增殖的影響,在U87MG細胞中,通過包裝病毒感染,敲低內源ME2之后,再外源表達WT和模擬乙酰化突變體K156Q(圖4A)。回轉WT的細胞增殖速率高于K156Q突變體(圖4B);通過裸鼠成瘤實驗,皮下接種的K156Q U87MG細胞成瘤大小和質量小于野生型細胞(t
=7.238,P
<0.001)(圖4C)。此外,通過對惡性腦膠質瘤的臨床樣本檢測顯示癌組織中的ME2乙酰化低于癌旁組織(圖4D)。
圖4 ME2乙酰化對U87MG細胞增殖的影響
3 討論
腦膠質瘤是最常見的原發性腦腫瘤,約70%的成人腦腫瘤都是膠質瘤。在常規的外科手術以及放化療干預下,患者的5年生存率仍然很低。近十幾年以來,針對致癌信號通路中關鍵分子如EGFR、VEGF、ERK等的靶向藥物在腫瘤的治療中取得很大進展。然而,在惡性腦膠質瘤尤其是多形性膠質母細胞瘤(GBM)患者中,這些靶向藥物有效時間短,細胞易出現耐藥性,治療效果有限。越來越多的證據表明腫瘤細胞通過代謝重編程以滿足對高能量的需求,協調細胞合成代謝和能量生成,維持細胞的快速增殖。深入研究關鍵代謝酶在腫瘤發生發展中的作用將為開發靶向藥物提供新的視角。
ME2催化的反應將三羧酸循環中的蘋果酸轉化成丙酮酸,同時產生的NADH,是細胞內重要的還原力和能量來源。ME2的高表達如何影響腫瘤進展的機制還不清楚。有報道指出ME2可以激活AKT通路,促進細胞增殖。此外,在K562細胞中敲低ME2會促進細胞凋亡,抑制增殖和成瘤。同樣,在U2OS和HCT116細胞水平上,沉默ME2可抑制細胞增殖。總的來說,越來越多的證據支持ME2作為一個致癌因子,促進腫瘤發生發展。值得注意的是,已有報道初步篩選出針對ME2的小分子作為抗癌藥物。
乙酰化作為一種重要的翻譯后修飾,在細胞核中通過動態調控染色體的緊密度影響多種基因的轉錄,而在細胞質中大部分的代謝酶都存在乙酰化修飾,調控其酶活及穩定性等。本研究表明SIRT3去乙酰化ME2(圖2),提高其活性,幫助細胞生成NADH,更好地清除ROS(圖3),維持細胞的氧化還原穩態。作為線粒體內最主要的去乙酰化酶,SIRT3在維持線粒體穩態,調控衰老、免疫、神經系統等方面發揮重要作用。而SIRT3在腫瘤中的功能一直不是很清楚,促癌和抑癌的功能皆有報道,該研究也從ME2的角度暗示SIRT3是一個促癌因子。
綜上所述,該研究從乙酰化修飾的角度闡述了代謝酶ME2通過影響細胞NADH水平及ROS的清除,從而調控U87MG增殖的分子機制,有助于從代謝的視角深入認識腦膠質瘤的發生發展。該研究也從一定程度上說明通過上調SIRT3,降低ME2活性,能達到抑制腦膠質瘤細胞增殖的目的。此外,在動物模型和臨床標本上的研究也進一步驗證了ME2的乙酰化修飾抑制增殖的功能。后續的研究可圍繞ME2 K156位點的乙酰化修飾制備特異性抗體,對更多的臨床樣本進行檢測,研究該位點的修飾與惡性腦膠質瘤患者發展進程及預后的關系,為惡性腦膠質瘤患者的診斷和治療提供更多的思路。

