HBP21 抑制胰島素誘導的PI3K/AKT信號通路機制
朱海珍,王鑫濤,許艷,田仁云,鄧日林,王靜靜,陳生穩,李慧逸
(1.湖南大學 生物學院,湖南 長沙 410082;2.湖南大學 病原生物學與免疫學研究所,湖南 長沙 410082;3.湖南大學化學生物傳感與計量學國家重點實驗室,湖南長沙 410082)
肝細胞癌(hepatocellular carcinoma,HCC)是全球第六大常見惡性腫瘤,位居全球癌癥相關死亡的第四位,一般認為肝癌的發生與慢性乙型和丙型肝炎病毒感染、酗酒或飲食中接觸黃曲霉毒素有關[1-2].像許多其他癌癥一樣,肝細胞表型逐漸演變為發育不良的肝細胞,最后演變為肝癌,并積累了遺傳和表觀遺傳改變.盡管人們已經對HCC 的發病機制進行了較深入的研究,但涉及HCC 發病的詳細分子機制仍有待進一步研究.
胰島素(insulin)與其受體(IR)的結合在哺乳動物細胞中啟動了一系列復雜的生物學效應[3],胰島素結合并激活IRβ 亞單位酪氨酸激酶,使IR 底物蛋白磷酸化.IRS1 和IRS2 這兩個主要底物與磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B(AKT)通路和Ras-絲裂原活化蛋白激酶(MAPK)通路有關,PI3K/AKT通路負責胰島素的大部分代謝活動,Ras-MAPK 通路與PI3K 通路協同控制細胞增殖[4-5].IR 可以磷酸化至少6 種已知的底物蛋白,它們能夠與5 種主要形式的PI3K 調節亞基相互作用[6-7].PI3K 被IR 磷酸化激活后,將磷脂酰肌醇二磷酸(PIP2)磷酸化生產磷脂酰肌醇三磷酸(PIP3),活化后的PIP3 進而激活丙酮酸脫氫酶激酶同工酶1(PDK1),激活后的PDK1發揮蛋白激酶功能,進而激活已知的AKT 的3種亞型[8-10].
PI3K/AKT 信號通路參與控制細胞生長和增殖,并在不同的癌癥類型中表現出結構性激活,PI3K 活性受多種癌基因和生長因子受體的刺激,PI3K 信號通路的活化被認為是癌癥的標志[11-12].最近對人類癌癥基因組的研究結果顯示,在廣泛的人類癌癥中,PI3K 通路的許多成分經常成為種系或體細胞突變的靶點,這些靶點已成為癌癥干預治療最有吸引力的靶點之一[13-14].
熱休克蛋白HSP70 結合蛋白21(Hsp70 binding protein 21,HBP21)又叫TTC36,是TPR 基序家族的新成員,是熱休克蛋白70(HSP70)的分子伴侶,研究發現特別是在熱和化療藥物治療等不利條件下,HBP21 可以促進細胞凋亡.HBP21 作為HSP70 的伴侶,可以抑制HSP70 與Bax 的相互作用,增加Bax 蛋白從胞漿到線粒體的轉位,進而增加細胞色素c 的釋放,最終誘導細胞凋亡[15-16].研究表明,HSP70 的上調可以抵抗各種不利條件,并抑制癌細胞的凋亡,促進PI3K/AKT 通路的活化[17].到目前為止,HBP21是否參與調節PI3K/AKT 信號通路尚不清楚.
本文研究了肝細胞癌中低表達的HBP21 與肝細胞癌中異常激活的PI3K/AKT 信號通路之間的關系,發現HBP21 參與調控胰島素誘導的PI3K/AKT信號通路,此發現或許為未來靶向PI3K/AKT 信號通路,治療癌癥提供新的理論依據.
1 材料與方法
1.1 細胞系及細胞培養
Huh7 細胞購自American Type Culture Collection;HEK293T 細胞購買于武漢博士德公司.Huh7細胞和HEK293T 細胞在含有10% 胎牛血清、L-谷氨酰胺、非必需氨基酸、青霉素和鏈霉素的杜爾貝科改良鷹培養基(dulbecco’s modified eagle medium,DMEM)中增殖.所有細胞系在含5%體積CO2加濕細胞培養箱中保持37 ℃進行培養.肝癌組織樣品從湖南省腫瘤醫院獲取.
1.2 實驗試劑
DMEM 培養基底液(美國Gibco 公司),LY294002(10 μmol/mL)抑制劑(美國CST 公司),Insulin(100 mIU/mL)(美國CST 公司),MG132(美國Sigma 公司),DMSO(美國Sigma 公司),10×PBS(實驗室配置),胰蛋白酶(Invitrogen 公司),免疫沉淀磁珠protein A G(德國Merck 公司),2×Laemmli Buffer(Bio-Rad 公司),β-巰基乙醇(Bio-Rad 公司),Trizol試劑(Invitrogen 公司),RT-PCR 試劑盒(Invitrogen公司),SYBR Green 定量試劑盒(Taraka 公司),全細胞裂解液RIPA Buffer(Thermo 公司),蛋白酶抑制劑和磷酸酶抑制劑(德國Merck 公司),mTOR/p-mTOR抗體(美國Santa 公司),AKT/p-AKT 抗體(美國CST公司),HBP21(英國Abcam 公司),PTEN 抗體(美國CST 公司),IRβ/p-IRβ(美國CST 公司),β-actin/Flag/V5(美國Sigma 公司),goat-anti-Mouse/goatanti-Rabbit(美國Sigma 公司),質粒提取試劑盒(上海生工),膠回收試劑盒(上海生工).
1.3 實驗儀器及材料
CO2恒溫細胞培養箱,細胞培養皿(美國Corning),細胞計數板(Bio-Rad 公司),移液管,細菌培養箱,37 ℃恒溫水浴鍋,37 ℃恒溫搖床7500 熒光定量儀器,聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),濾紙,Eppendorf PCR 儀器,Eppendorf 移液槍,化學發光成像儀(Bio-Rad 公司),qRT-PCR 八聯管,4 ℃低溫高速離心機,電泳槽(Bio-Rad 公司).
1.4 實驗方法
1.4.1 HBP21 和AKT 質粒的構建與鑒定
從美國國家生物信息中心(National Center for Biotechnology Information Search database,NCBI)找到相關基因的蛋白質編碼區(Sequence coding for aminoacids in protein,CDS),利用Primer 5.0 軟件設計基因的前后引物.提取Huh7 細胞的總RNA,通過逆轉錄試劑盒將提取的總RNA 逆轉錄成cDNA,按照設定好的程序通過聚合酶鏈式反應(PCR)儀器擴增目的基因.通過瓊脂糖凝膠電泳實驗驗證目的基因的特異性,并對凝膠中的特異性條帶進行膠回收實驗.對膠回收得到的目的基因與載體(P3xFlag-CMV-vector 或PcDNA3.1a-V5-vector)進行雙酶切實驗,將酶切后的目的基因與載體通過T4 DNA 連接酶進行連接得到完整的質粒.采用感受態細胞(DH5α)對質粒進行轉化實驗,挑取生長在含有抗生素培養皿上的單個細菌菌落進行擴大培養,通過質粒提取試劑盒將擴大培養的菌落進行DNA 提取,對核酸進行酶切與鑒定實驗,并提取DNA 送入公司測序.質粒HA-K48 和HA-K63 由北京大學蔣正凡教授提供.HBP21 和AKT 的前引物和后引物序列見表1.
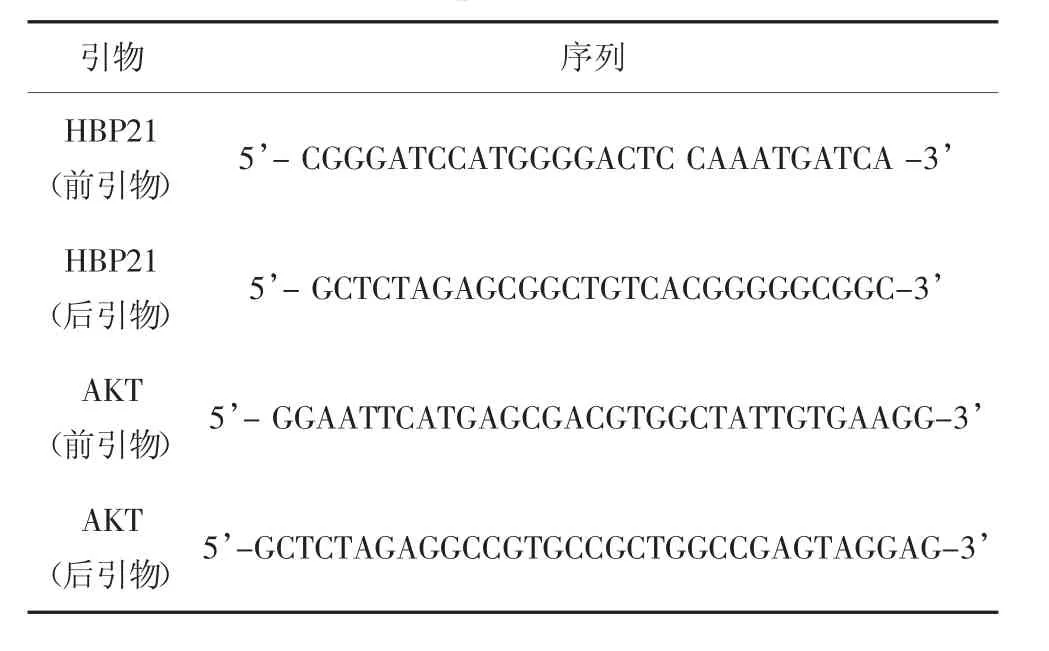
表1 PCR 引物Tab.1 Primer sequences for PCR reaction
1.4.2 實時熒光定量PCR(qRT-PCR)
利用TRizol 裂解細胞,按照試劑盒流程提取細胞RNA,通過RT-PCR 試劑盒將提取的RNA 逆轉錄成cDNA,參照SYBR Green 試劑盒說明書對cDNA 樣品進行稀釋.每個八連管中加入2 μL cDNA 模板、上下游引物各0.2 μL、5 μL SYBR 試劑、2.6 μL去離子水,每個樣品做3 組重復實驗,最后將裝有樣品的八連管放入儀器內進行定量實驗.定量PCR 引物序列見表2.

表2 定量PCR 引物序列Tab.2 Primer sequences for qRT-PCR reaction
1.4.3 蛋白免疫印跡實驗
處理細胞之前,先用1×PBS 清洗細胞2~3 遍,清洗完細胞之后,使用含有蛋白酶抑制劑和磷酸酶抑制劑的全細胞裂解液對細胞進行裂解,細胞裂解在冰上操作,裂解細胞時間為5 min.裂解完成之后,利用特有的細胞刮子將細胞從細胞培養皿中刮下,使用移液槍將裂解液全部轉入1.5 mL EP 管中,冰上靜置20 min.將全細胞裂解液放入提前降溫到4 ℃的離心機中,13 200 r/min,離心15 min.將蛋白樣品與上樣緩沖液(2×Laemmli Buffer)同比例混勻,放入金屬浴中,100 ℃煮5 min,使蛋白發生變性.利用聚丙烯酰胺凝膠(SDS-PEG)進行蛋白跑膠實驗,不同目的蛋白選用不同的抗體進行孵育,最后利用化學發光成像儀對樣品進行曝光處理.
1.4.4 泛素化實驗
在HEK293T 細胞中轉染質粒pV5-vector、pV5-HBP21、pFlag-AKT1、pHA-ub 或 者pHA-K48O 和pHA-K 63O 42 h 之后,再用MG132(25 μmol/mL)處理6 h,然后通過蛋白免疫印跡實驗分析相關蛋白.
1.4.5 數據分析
采用學生t 檢驗(Student's t-test)對定量數據進行分析,對照組和實驗組之間的顯著性差異程度可以用P 值表示,其中P 值小于0.05 被認為具有統計學意義.P 值小于0.05,用“*”號表示;P 值小于0.01,用“**”號表示;P 值小于0.001,用“***”表示.所有的“*”號在圖柱中表示實驗組和對照組之間有顯著性差異.
2 結果
2.1 HBP21 在肝癌組織中低表達
有研究表明,HBP21 在癌組織中呈低表達狀態,HBP21 作為HSP70 的伴侶,可以抑制HSP70 與Bax的相互作用,增加Bax 蛋白從細胞質到線粒體的轉位,進而增加細胞色素c 的釋放,最終誘導細胞凋亡[18].為了檢測HBP21 在肝癌組織中的表達情況,本文收集了9 例原發性肝癌與癌旁組織,借助qRTPCR 技術檢測樣本組織中HBP21 基因的mRNA 表達水平,發現在肝癌組織中HBP21 的mRNA 水平明顯低于其對應的癌旁組織(雖然第5 和第6 組的定量數據存在一定的誤差,但仍具有統計學意義,癌組織中HBP21 的mRNA 水平明顯低于相對應的癌旁組織),這說明HBP21 在肝癌細胞中缺失表達,定量結果如圖1(a)所示.HSP70 的上調可以抵抗各種不利條件,通過促進PI3K/AKT 通路的活化抑制癌細胞發生凋亡[18].有研究報道PI3K/AKT 信號通路在癌癥中經常處于異常激活的狀態[2],因此,推測在肝癌中低表達的HBP21 和HSP70 一樣參與調控PI3K/AKT信號通路.胰島素作為一種生長因子與其受體結合能夠激活許多信號分子,其中PI3K/AKT 信號通路作為其下游重要的信號通路能夠在胰島素的作用下發生顯著性活化[6].為研究HBP21 與胰島素誘導的PI3K/AKT 信號通路之間是否存在聯系,用胰島素處理Huh7 細胞,檢測HBP21 的mRNA 水平和蛋白水平,隨著處理時間的延長,HBP21 的mRNA 水平呈下降趨勢,尤其是在處理30 min 后,現象更為明顯,結果如圖1(b)所示.用胰島素分別處理Huh7 細胞,隨著處理時間的延長,HBP21 的蛋白水平逐漸降低,尤其是胰島素處理細胞30 min 后,HBP21 的蛋白水平下調趨勢更為明顯,結果如圖1(c)所示.綜上所述,肝癌組織中低表達的HBP21 可能與胰島素誘導的PI3K/AKT 信號通路之間存在聯系.
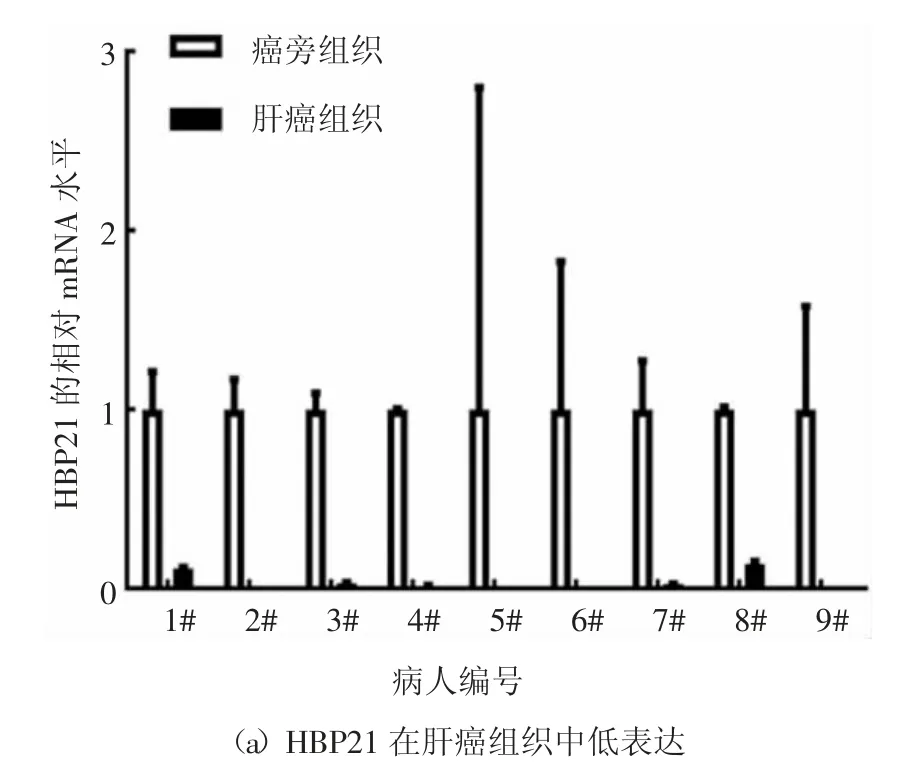
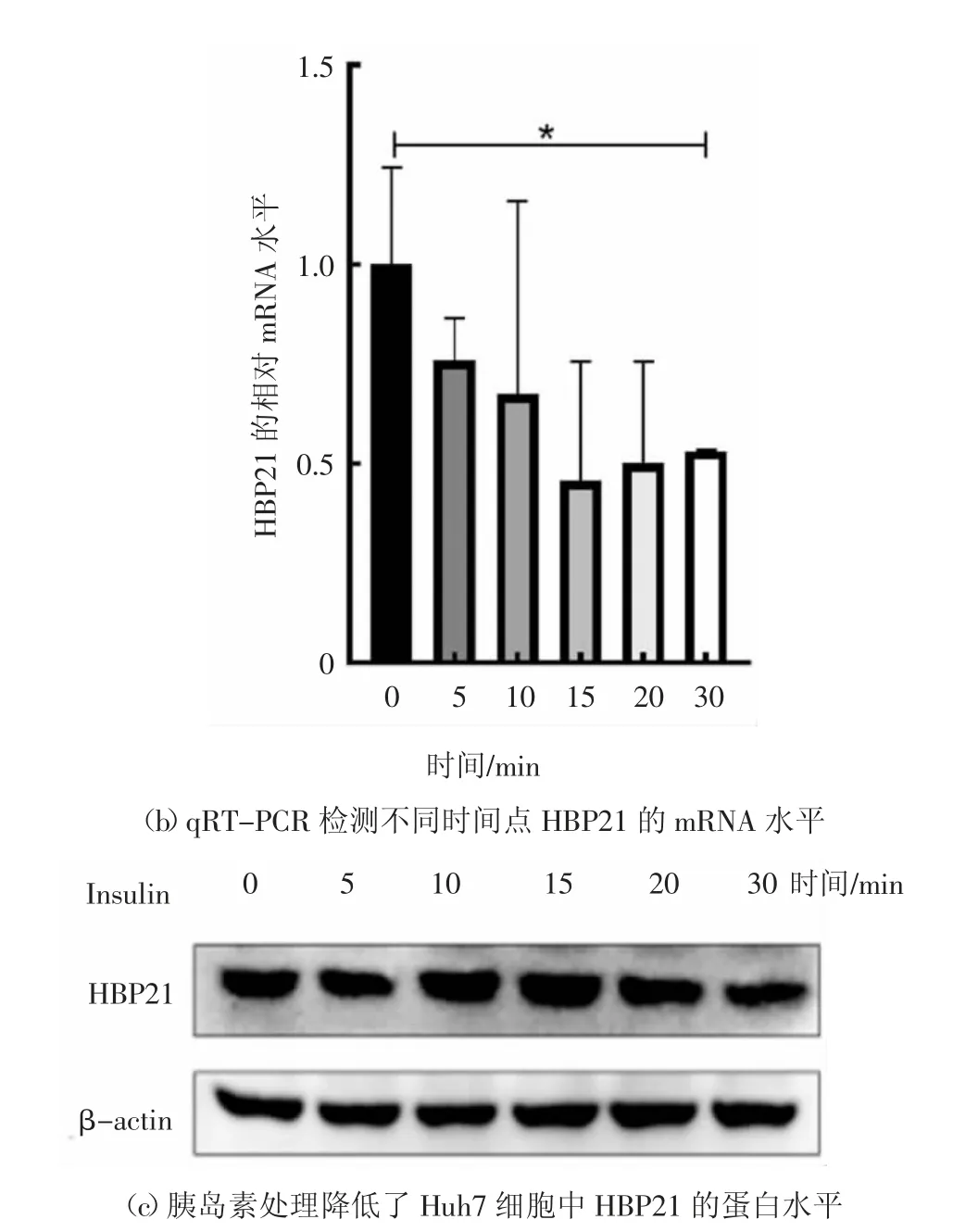
圖1 肝癌組織中HBP21 表達量低于癌旁組織Fig.1 HBP21 expression in liver cancer tissues is lower than that in adjacent tissues
2.2 HBP21 抑制胰島素誘導的AKT 和mTOR 的活化
研究表明,在20%~60%的人類HCC 中激活了5個主要途徑,包括PI3K/AKT、Myc、Wnt/β-catenin、Hedgehog 和Met 途徑[2].胰島素能激活PI3K/AKT 信號通路,胰島素及其受體在腫瘤發生發展中的作用得到了臨床證據的支持,有研究表明,即使低劑量的胰島素就可促進癌細胞生長[19-20].
為了研究HBP21 是否調控腫瘤細胞內的PI3K/AKT 信號通路,首先構建HBP21 質粒,然后在肝癌細胞Huh7 內過表達HBP21 質粒,在胰島素的作用下,研究HBP21 對PI3K/AKT 信號通路的影響.在Huh7 細胞中轉染HBP21 質粒48 h 后,采用不同時間點用Insulin(100 mIU/mL)處理Huh7 細胞,實驗發現,隨著胰島素處理時間的延長,AKT Ser473 位點的磷酸化逐漸增加,但是轉染了HBP21 質粒的實驗組與對照組相比,胰島素誘導的AKT 的磷酸化明顯被抑制,尤其在處理30 min 后抑制更加明顯,實驗結果見圖2(a).這一實驗結果表明,HBP21 抑制了胰島素誘導的AKT 磷酸化.為了研究HBP21 是否影響AKT 下游mTOR 的活化,同樣地,在Huh7 細胞中過表達HBP21 質粒,然后用Insulin(100 mIU/mL)處理細胞,處理時間分別為0 min、15 min、30 min,實驗發現,隨著胰島素處理時間的延長,mTOR 磷酸化在逐漸增加,但是轉染了HBP21 質粒的實驗組與對照組相比,胰島素誘導的AKT 下游的mTOR 磷酸化明顯被抑制,尤其在處理30 min 后抑制更加明顯,實驗結果見圖2(b).這一實驗結果表明,HBP21 可抑制AKT 下游的mTOR 磷酸化.綜合以上結果,說明HBP21 參與調控胰島素誘導的PI3K/AKT 信號通路的活化.
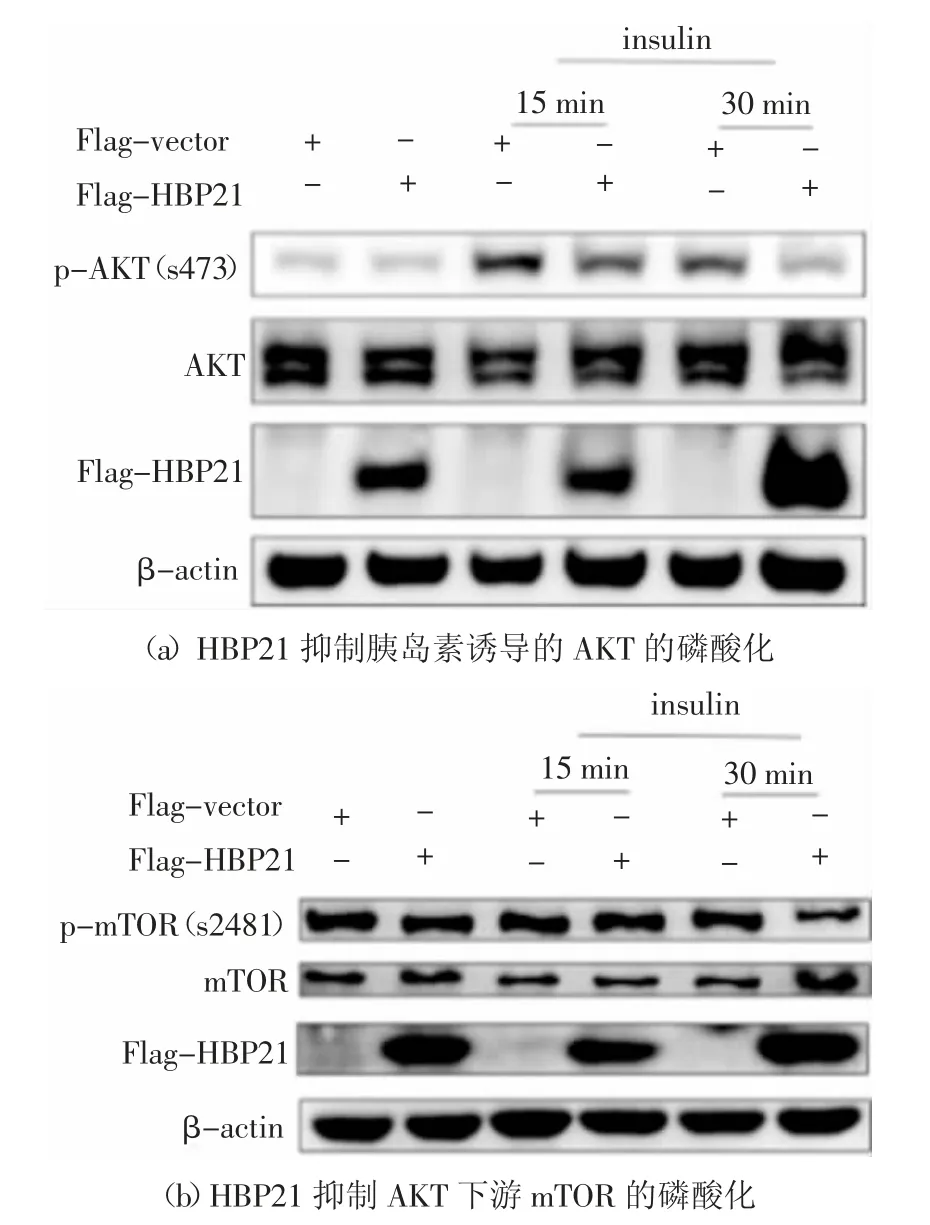
圖2 HBP21 抑制胰島素誘導的AKT 和mTOR 的磷酸化Fig.2 HBP21 inhibits insulin-induced phosphorylation of AKT and mTOR
2.3 HBP21 不影響PTEN 的蛋白水平及AKT 的泛素化
PTEN 作為一種重要的抑癌基因,它可以抑制PI3K/AKT 信號通路的活性,PTEN 發揮它的作用是通過其磷酸酶活性將磷脂酰肌醇-3,4,5-三磷酸(PIP3)變成磷脂酰肌醇-4,5-二磷酸(PIP2),因此不能使下游AKT 發生磷酸化從而抑制AKT 的活化[21-22].為了探究HBP21 是否通過影響PTEN 進而影響AKT 的磷酸化,我們在Huh7 細胞中過表達HBP21 質粒,然后用胰島素處理細胞,通過蛋白免疫印跡實驗發現HBP21 對PTEN 的蛋白水平并沒有直接的影響,實驗結果見圖3(a).已知AKT 磷酸化的充分條件首先是要其發生K63 位的泛素化激活,而K48 位是泛素化降解[23].為了驗證HBP21 對AKT磷酸化影響的具體機制,首先研究了HBP21 對AKT 的泛素化的影響.在HEK293T 細胞中轉染質粒V5-vector、V5-HBP21、Flag-AKT1、HA-ub、HAK48O 和HA-K63O 42 h,再用MG132(25 μmol/mL)處理6 h 后收集蛋白,通過實驗發現,HBP21 對AKT的K48 及K63 位泛素化都沒有明顯的影響,實驗結果見圖3(b),這說明HBP21 對AKT 磷酸化的影響并非是對其泛素化的影響.綜合以上結果說明,HBP21 并非是通過影響AKT 的泛素化以及PTEN的蛋白水平來抑制AKT 的活化.
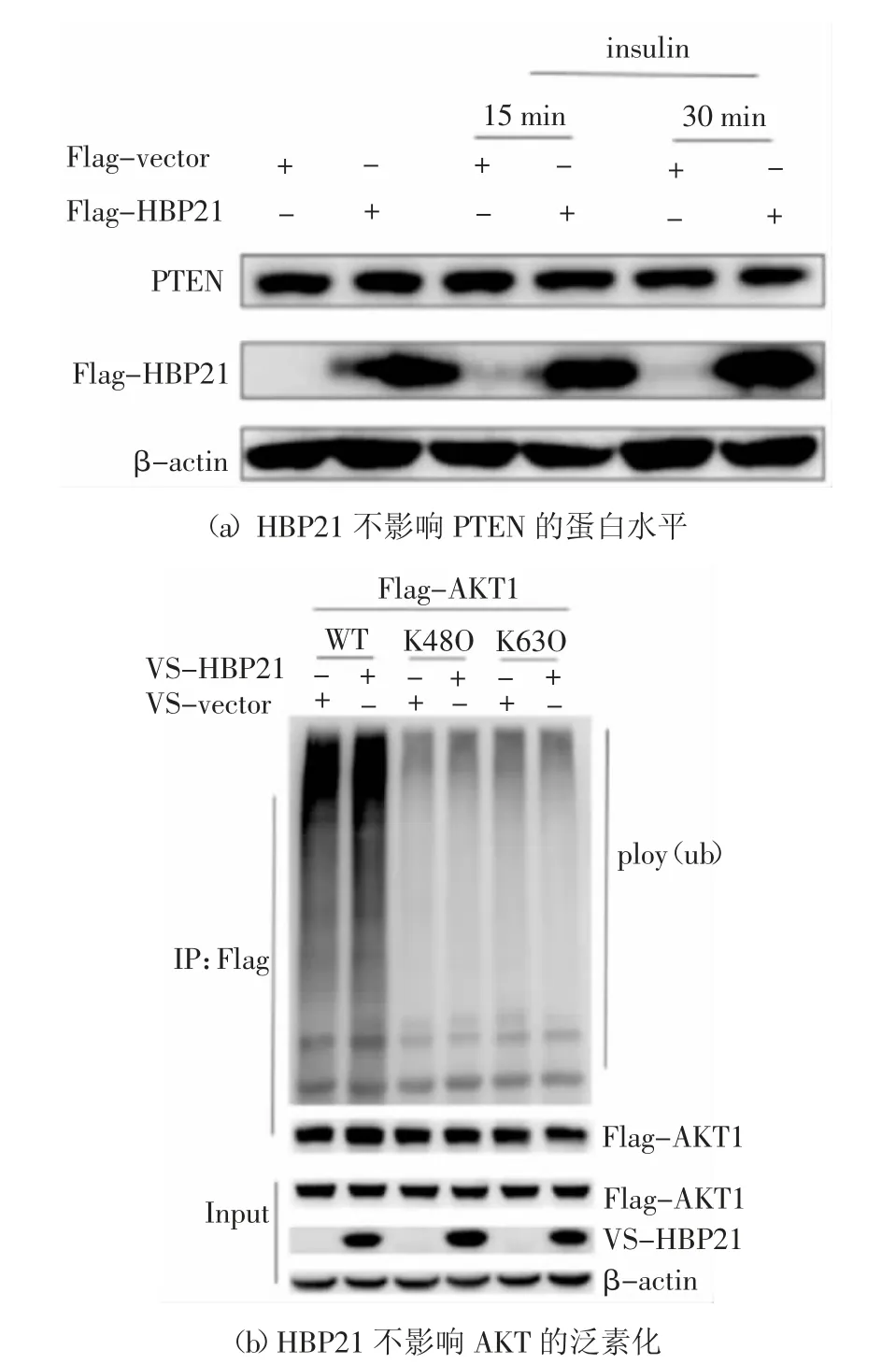
圖3 HBP21 不影響PTEN 的蛋白水平和AKT 的泛素化Fig.3 HBP21 does not affect the protein level of PTEN and the ubiquitination of AKT
2.4 HBP21 作用于PI3K/AKT 信號通路
PI3K 是一種激酶,當它被胰島素誘導激活后,可進一步激活下游的AKT 及mTOR.LY294002 是PI3K 的高選擇性抑制劑,明顯抑制PI3K 激酶的酶活,使其不能發揮激酶功能[24].使用抑制劑處理Huh7細胞,首先在Huh7 細胞內轉染HBP21 質粒44 h,然后用PI3K 的抑制劑LY294002(10 μmol/mL)再處理細胞4 h,最后用胰島素處理細胞30 min.根據蛋白結果圖發現,在胰島素處理細胞30 min 后,AKT 的磷酸化水平有明顯升高,并且抑制劑能夠明顯抑制胰島素誘導的AKT 和mTOR 的磷酸化,實驗結果見圖4(a).在無胰島素誘導下,HBP21 也可明顯抑制AKT 的磷酸化,而且抑制劑增強了HBP21 對AKT 磷酸化的抑制作用,實驗結果見圖4(b).綜合以上實驗結果,發現HBP21 作用于胰島素誘導的PI3K/AKT信號通路,抑制AKT 的磷酸化,因此,推測HBP21 對AKT 的影響可能是作用于PI3K 的上游分子.
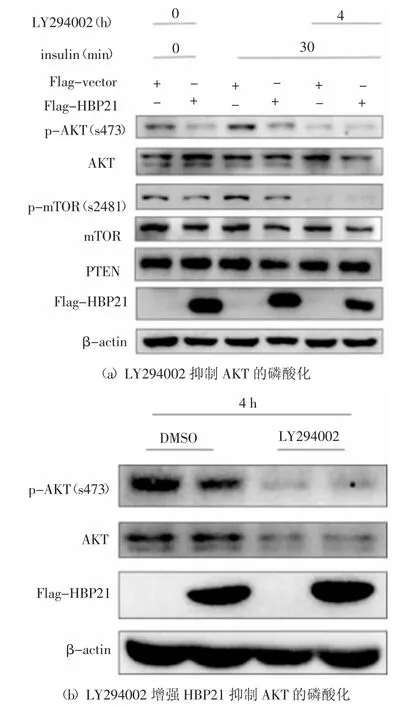
圖4 HBP21 作用于PI3K/AKT 信號通路Fig.4 HBP21 acts on PI3K/AKT signaling pathway
2.5 HBP21 抑制胰島素受體IRβ 的磷酸化
胰島素與其受體(IR)的結合在哺乳動物細胞中啟動了一系列復雜的生物學效應.胰島素結合并激活IRβ 亞單位酪氨酸激酶,使IR 底物蛋白磷酸化[25].IRS1 和IRS2 這兩個主要底物與PI3K-AKT 通路有關,并且PI3K-AKT 通路負責胰島素的大部分代謝活動[4-5].通過前面的實驗結果發現HBP21 抑制胰島素誘導PI3K/AKT 通路中的AKT 磷酸化,推測HBP21 可能是通過作用于AKT 的上游分子影響AKT 磷酸化的影響,因此,主要研究HBP21 對該信號通路上游分子IRS1/2 和IRβ 的影響.在Huh7 細胞中轉染HBP21 質粒48 h 后,再以胰島素處理細胞30 min,收集細胞RNA,檢測IRS1/2 的mRNA 水平.通過對熒光定量PCR 數據進行分析,在胰島素處理細胞30 min 后,發現HBP21 對IRS1 和IRS2 的mRNA 水平并沒有影響,實驗結果見圖5(a)和(b).HBP21 質粒在Huh7 細胞中的過表達效果得到驗證,見圖5(c),這一結果表明HBP21 可能不是通過作用于IRS1 和IRS2 的mRNA 水平影響AKT 的磷酸化.
由上述分析可知,推測HBP21 可能影響了胰島素受體IRβ 亞基的活性.為了研究HBP21 是否影響AKT 上游IRβ 的活化,在Huh7 細胞中過表達HBP21 質粒,然后用胰島素分別處理0 min、15 min、30 min,實驗發現,隨著胰島素處理時間的延長,IRβ磷酸化在逐漸增加,但是轉染了HBP21 質粒的實驗組與對照組相比,胰島素誘導的AKT 上游的IRβ 磷酸化明顯被抑制,尤其是處理30 min 后抑制更加明顯,相應地,HBP21 同樣抑制了AKT 的磷酸化,實驗結果見圖5(d).綜合以上實驗結果,可以得出結論,HBP21 通過抑制胰島素受體(IRβ)磷酸化,進而影響其下游AKT 磷酸化.
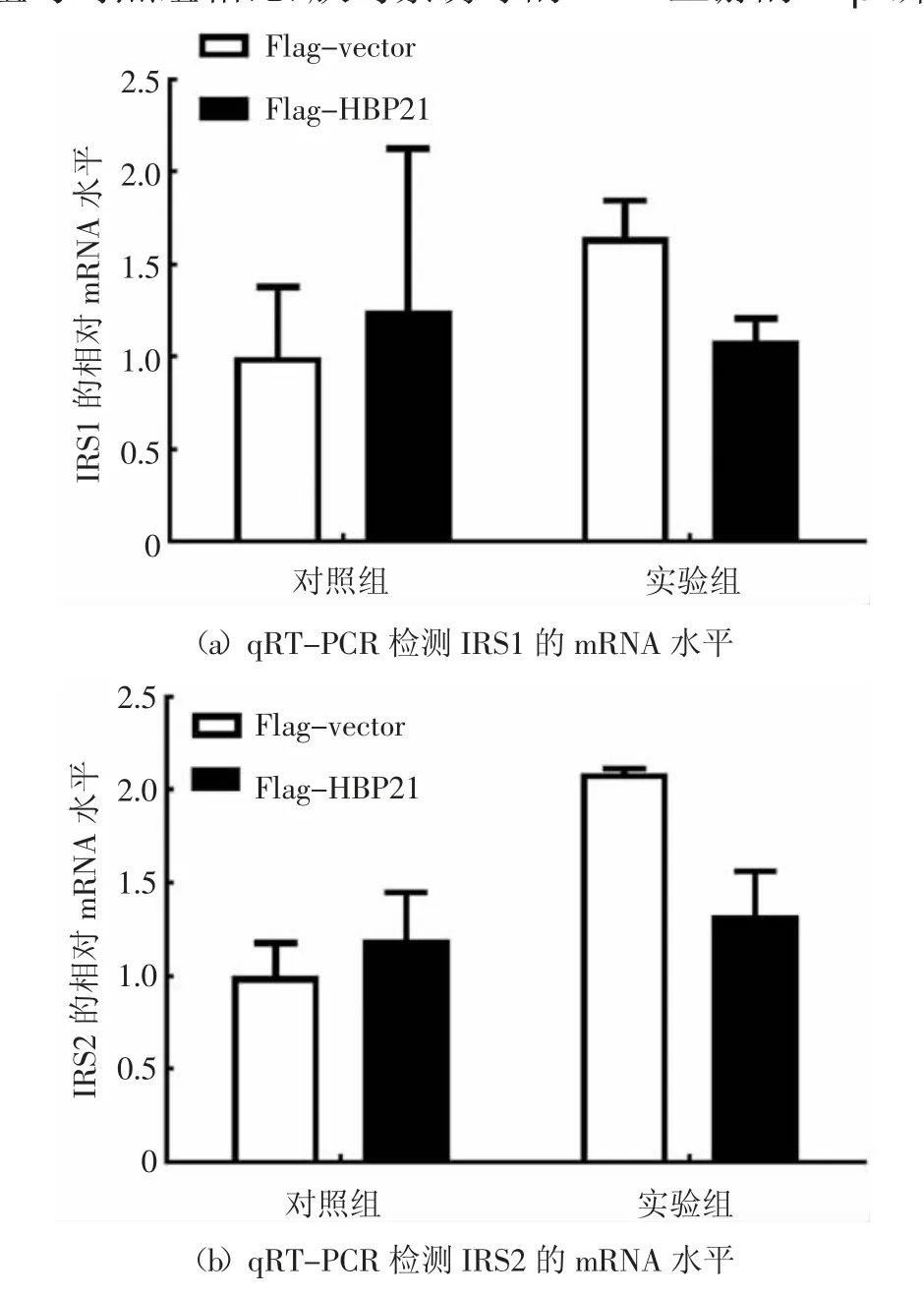
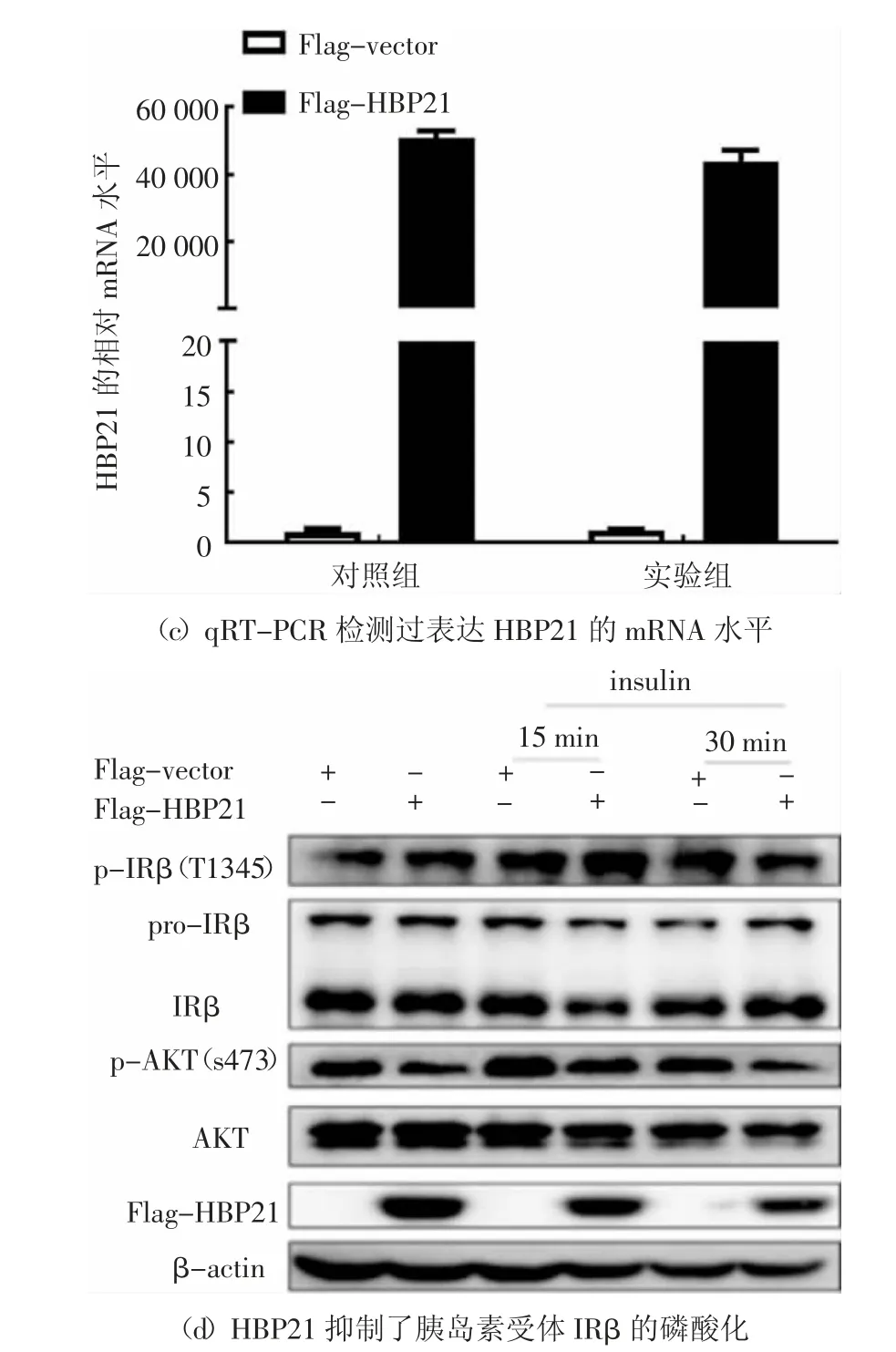
圖5 HBP21 抑制IRβ 的磷酸化Fig.5 HBP21 inhibits thephosphorylation of IRβ
3 結論
通過熒光定量PCR 技術檢測病人肝癌和癌旁組織中HBP21 的mRNA 水平,發現肝癌組織中HBP21 的mRNA 水平異常低于癌旁組織.用胰島素處理肝癌細胞Huh7,目的是激活PI3K/AKT 信號通路,發現隨著胰島素處理時間的延長,HBP21 的mRNA 和蛋白水平都呈現低表達趨勢.將體外構建的HBP21 質粒轉染進Huh7 細胞,通過蛋白免疫印跡實驗發現,HBP21 顯著抑制PI3K/AKT 信號通路中AKT 絲氨酸473 位點的磷酸化及AKT 下游mTOR 的磷酸化.進一步實驗發現,HBP21 抑制AKT的磷酸化的功能并不是通過影響PTEN 的蛋白水平和AKT 的泛素化來實現的.采用LY294002 抑制劑處理Huh7 細胞,確定了HBP21 作用于PI3K/AKT信號通路.通過一系列實驗發現,HBP21 通過抑制胰島素受體IRβ 的磷酸化,進而影響其下游的AKT 的磷酸化.
本研究闡述了HBP21 抑制PI3K/AKT 信號通路的機制,豐富了HBP21 作為抑癌基因的功能,但仍存在一些亟待解決的問題.例如HBP21 是如何影響IRβ 的磷酸化;是否存在其他蛋白協同HBP21 參與調控PI3K/AKT 信號通路;HBP21 是否具有磷酸酶的功能,這些問題需要進一步通過實驗來解決.
本文的研究為治療肝癌提供了新的思路,HBP21 在肝細胞癌中的缺失表達及其抑制PI3K/AKT 的活化有可能成為潛在治療癌癥的靶點.

