老年綜合評估技術在老年高血壓合并腦梗死患者跌倒風險分析中的應用
李宇 薩麗波 劉宇翔
跌倒會產生不良后果,如髖部骨折、創傷性腦損傷。跌倒會導致患者的日常生活能力下降、生活質量惡化和醫療成本增加,并產生重大社會影響[1,2]。在發達國家,跌倒和跌倒相關并發癥已成為老年人第五大死因[3]。跌倒已經成為影響老年人健康的主要問題[4],而許多因素都會導致跌倒風險增大[5]。高血壓合并腦梗死的老年人發生跌倒的可能性較大。盡管有報道稱血壓與跌倒不良結局之間的關系是以“J”形曲線的形式出現,但老年人的最佳血壓水平仍不清楚[6,7]。血壓管理是降低心肌梗死和中風風險的關鍵[8,9]。抗高血壓藥物相關的跌倒風險和嚴重的跌倒傷害對功能和死亡率的影響與心血管事件相似[10]。有報道稱功能獨立性測量與Morse跌倒量表一樣有效,Morse 跌倒量表是一種廣泛使用的評估跌倒風險的工具,說明患者在跌倒時處于高風險狀態[11]。慢性病的數量與跌倒風險呈正相關[12]。另一項研究表明,營養狀況是社區老年人跌倒的預測因子[13]。最常見的跌倒類型是預期的生理性跌倒,患病率為78%[14]。當患者處于高風險狀態時,這也是最有可能進行干預的類型。其他類型的跌倒包括意外跌倒(14%)和生理性跌倒(8%)。Morse跌倒量表的設計是為了確定患者在預期的生理性跌倒風險,在這個量表中得分超過45分的患者被認為有跌倒的風險。老年綜合評估(CGA)是一個多層面的跨學科診斷過程,從疾病、體能、認知、心理和社會等層面對老年患者進行全面評估,重點在于確定老年人的自理能力、心理健康水平[15]。我們對老年高血壓合并腦梗死患者進行CGA評估,同時采用Morse跌倒量表對跌倒風險進行評估,分析CGA反映的功能衰退與跌倒風險的關系。
1 材料與方法
1.1 研究對象選取2018年1月~2020年10月我院診治的190例老年高血壓合并腦梗死患者,男148例,年齡72~99歲,平均(81.4±5.8)歲,女42例,年齡73~98歲,平均(82.2±6.2)歲。納入標準:經MRI、CT等影像學和實驗室檢查符合高血壓合并腦梗死的診斷標準[16];年齡≥65周歲、住院、無嚴重心腦血管事件和惡性腫瘤及多器官衰竭。排除標準:意識不清者;嚴重的臟器(心、肺、肝、腎等)功能不全者;嚴重感染者;病歷資料不全者。每例患者都有明確的人口學特征和臨床信息記錄,患者均接受CGA。
1.2 研究方法CGA在患者入院當天進行,包括功能狀態、認知、共病、營養和入院前處方藥物數量等評估。使用Barthel指數評估日常生活活動(ADL)中的依賴程度作為功能狀態[17]。認知狀態通過簡易精神狀態檢查(Mini mental state examination,MMSE)進行評估[18],并采用老年抑郁癥量表(Geriatric depression scale,GDS)[19],采用微營養評估(Micronutrient assessment,MNA-SF)評定營養狀況[20]。多重用藥是指入院時使用了5種或5種以上的藥物。采用Chu等[21]設計的由6個變量組成的CGA評分表。6個變量及分數分配如下:ADL(Barthel指數)>95分為正常,計為0分;≤95分為具有依賴性,計為1分。MNA-SF>11分為正常,計為0分;≤11分為營養不良,計為1分。GDS<6分為正常,計為0分;≥6分為抑郁,計為1分。MMSE>24分為正常,計為0分;≤24分為癡呆,計為1分。用藥<5種計為0分;≥5種計為1分。共病種類<3種計為0分;≥3種計為1分。CGA評分范圍從0分到6分。根據CGA的分數,患者被分為3類:低分為0~1分(CGA-T1),中分為2~3分(CGA-T2),高分為4~6分(CGA-T3)。
1.3 統計學分析采用SPSS 23.0軟件進行統計分析,符合正態分布的計量資料用±s表示,采用t檢驗,多組間比較采用方差分析;計數資料以例數或百分數表示,采用卡方檢驗。用Spearman秩相關分析法比較CGA評分及其構成因素與跌倒風險的相關性。以P<0.05為差異有統計學意義。
2 結果
2.1 CGA不同評分患者的基線特征190例患者中,CGA評分較高的患者年齡較大,BMI較低,心血管疾病患病率較高,Morse跌倒量表評分>45分的占比較高(P<0.05)。在性別、糖尿病方面沒有差異(P>0.05),見表1。
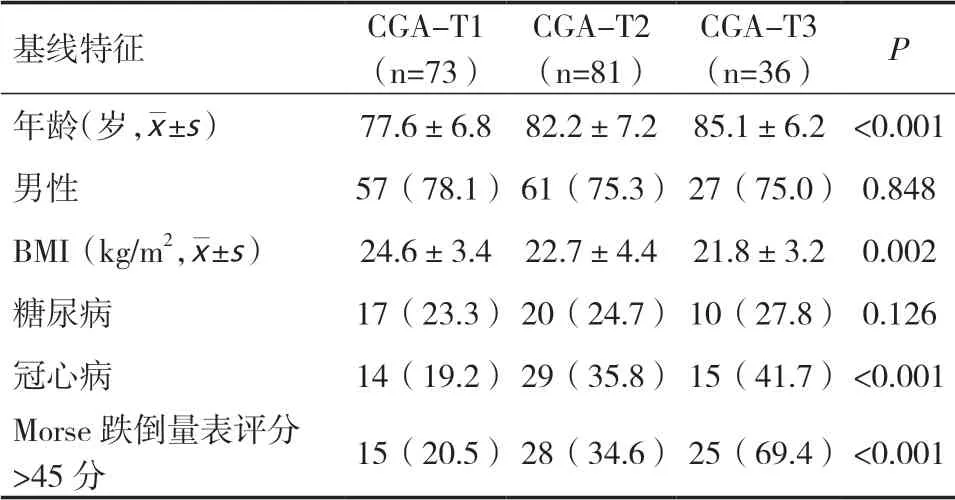
表1 不同CGA分數患者的基線特征[n(%)]
2.2 CGA評分各變量與患者跌倒風險的關系在CGA評分的6個變量中,ADL≤95分、MNA-SF≤11分和MMSE≤24分的患者在有無1年跌倒史及Morse跌倒量表評分高低者之間差異有統計學意義(P<0.05),GDS≥6分患者有無1年跌倒史之間差異有統計學意義(P<0.05),見表2。CGA評分、GDS、多重用藥及共病分別與Morse跌倒量表評分呈正相關(r=0.516、0.147、0.281、0.121,P<0.05),ADL、MNASF、MMSE分別與Morse跌倒量表評分呈負相關(r=-0.402、-0.273、-0.252,P<0.05)。
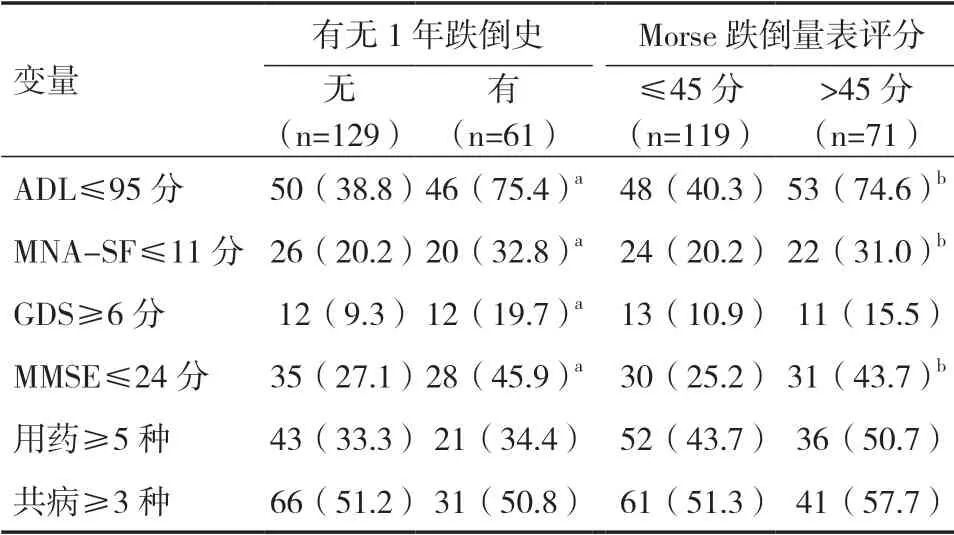
表2 CGA評分各變量對患者跌倒風險的評估[n(%)]
3 討論
本研究中老年高血壓合并腦梗死患者中6項CGA得分較高與跌倒風險增加相關。此外,日常活動的獨立性、營養不良、認知障礙、多重用藥和共病等也是CGA的組成部分,與跌倒風險相關。
雖然老年高血壓合并腦梗死患者可能存在降壓藥物應用相關的跌倒風險[22],但仍不確定何種類型的降壓藥物與跌倒相關[23]。一項為期12個月的前瞻性研究通過估算每日限定劑量來量化抗高血壓藥物劑量顯示,更高劑量的抗高血壓藥物與老年人的跌倒獨立相關,抗高血壓藥物劑量、脈壓、血壓控制之間存在著極大的相關性[24],直立性低血壓和跌倒風險的發生,尤其是CGA下降的老年人,仍需進一步研究。
有研究表明,功能獨立性和跌倒風險增加之間存在相關性[12]。本研究結果表明,在老年高血壓合并腦梗死患者中,老年綜合評估表現較差與跌倒風險相關性較高。具體地說,日常生活能力差,表明一個人在處理日常生活的總體能力方面存在局限,可以將其視為一個危險因素,MMSE≤24分也可以被視為認知障礙。低MNA-SF評分定義的營養不良也構成老年高血壓合并腦梗死患者跌倒的風險。此外,多重用藥和老年共病也歸因于高風險跌倒。Padubidri等[25]在75歲以上的墨西哥裔美國人中發現,跌倒2次及以上與6年后認知能力突然下降相關。另一項針對臺灣省社區老年人的研究表明,營養狀況是跌倒的獨立預測因子[13]。本研究中,GDS得分較高的患者跌倒風險更高。
本研究存在一些局限性。第一,社會環境作為CGA的一個方面,可以解釋跌倒風險和與跌倒相關的嚴重傷害,然而,我們缺乏相關信息來探討這一潛在機制的作用。第二,雖然對老年住院患者進行CGA可以預測住院死亡和不良后果的風險,也是提高急診老年患者存活可能性的有效方法[26],但由于入院時的CGA分數與居家狀態有部分不同,因此,近期嚴重心腎功能不全和惡性腫瘤未控制的患者被排除在本研究外。第三,本研究基于橫斷面數據,這可能受到個體間變異性或隊列效應偏差的限制,需要進行前瞻性研究,以確定CGA得分較高的個體是否會增加跌倒的發生率以及是否可以根據綜合老年醫學評估對功能衰退進行有效干預,以避免跌倒。
總之,對于老年高血壓合并腦梗死患者,CGA得分超過3分的患者有更高的跌倒風險,身心功能受損與跌倒風險增加有關。日常生活能力減退、認知能力減退、營養不良、合并癥和多重用藥等因素都會增加跌倒風險。

