酶膜反應器制備直鏈麥芽低聚糖過程中膜污染機制及再生研究
陳旭,李才明,2,李兆豐,2,班宵逢,2,洪雁,2,程力,2,顧正彪,2*
1(江南大學 食品學院,江蘇 無錫,214122)2(食品科學與技術國家重點實驗室(江南大學),江蘇 無錫,214122)
直鏈麥芽低聚糖是由2~10個葡萄糖分子以α-1,4糖苷鍵鏈接而成的直鏈低聚糖,是以淀粉為主要原料,由特異性的直鏈麥芽低聚糖生成酶經過酶解、轉苷等過程而得到的一種小分子糖,具有獨特的理化特性和生理功能,在食品、醫藥、化工等領域有著廣泛的應用[1]。但目前酶法制備直鏈麥芽低聚糖工業中還存有不足,如生產效率低,生產周期普遍在24 h以上;間歇批量式生產后需對產物進行滅酶處理,得到目的產物前需對產物進行分離提純等,造成大量能源損耗[2]。
酶膜反應器的應用則可在一定程度上解決上述問題,酶膜反應分離技術是在反應過程中即可將產物與酶和底物分離開的一種新型反應技術[3],其原理可概括為在酶促反應過程中,通過將反應體系與膜分離設備進行耦聯,在壓力驅動下使反應體系中的部分或全部產物從反應體系中選擇性分離,一定程度上解除產物抑制,加快反應進程,達到邊生產邊分離的生產模式[4-5]。
但在實際生產過程中,在淀粉及多糖類高黏度的底物環境下,膜組件會因機械作用或理化作用而引起污染物的沉積、吸附,從而出現膜污染現象,進而造成膜的處理能力下降,生產效率降低[6],因此有效避免及消除膜污染是膜分離技術能否進一步擴寬應用范圍的重要因素。HERMIA[7]最早提出了4種典型的膜污染模型理論;隨后FIELD等[8]在其基礎上對模型及應用范圍進行修正和優化;楊文瀾[9]研究了不同孔徑的陶瓷膜在處理生活污水過程中的污染形成機理,認為不同孔徑的陶瓷膜受不同污染模型主導;張翼[10]將被啤酒滅菌廢水所污染的陶瓷膜利用高壓水及無機試劑浸泡后,使陶瓷膜通量恢復至90%左右;LEE等[11]應用超聲技術將被污染的陶瓷膜通量最高恢復至94.2%。但目前關于由淀粉及多糖類污染物造成的膜污染機制及膜再生方面的研究還鮮有報道[12]。
本文主要針對以20% (質量分數)玉米淀粉為底物,應用酶膜反應器制備直鏈麥芽低聚糖工藝中出現的膜污染現象,對陶瓷膜污染機制進行分析,并在此基礎上研究不同清洗方案對污染后陶瓷膜的再生效果,以期為陶瓷膜在淀粉糖工業中的膜污染及膜再生提供指導。
1 材料與方法
1.1 實驗材料
食用玉米淀粉(含水質量分數11.63%),山東壽光巨能金玉米開發有限公司;直鏈麥芽低聚糖生成酶(malto-oligosaccharide-forming amylase,MFA酶)(酶活力120 U/mL),本實驗室發酵所得;耐高溫α-淀粉酶(酶活力7 000 U/mL),江蘇省博利生物制品有限公司;NaOH、檸檬酸、NaClO等其他試劑均為分析純,國藥集團化學試劑有限公司。
1.2 實驗設備
CeraMem-0100陶瓷膜/管式膜小試設備,膜組件為多通道管式陶瓷膜,膜長500 mm,有效膜面積為0.12 m2,平均孔徑20 nm,新膜純水通量約為255 L/(m2·h)(水溫25 ℃,壓力0.1 MPa,循環流速1 000 L/h條件下測得,下同),廈門福美科技有限公司;HH-601型超級水浴設備,常州金壇良友儀器有限公司。完整設備由反應罐、超濾泵、膜組件、收集罐等組成,如圖1所示。

1-恒溫水槽;2-蠕動泵;3-反應罐;4-超濾泵;5-膜組件; 6-收集罐;7-進料力表;8-流量計;9-攪拌槳圖1 應用膜反應器制備直鏈麥芽低聚工藝流程圖Fig.1 Process flow chart of preparing linear malt-oligomerization using membrane reactor
實驗過程中可通過調節設備頻率及循環閥門的開度調整設備壓力等各項參數,管路結構如圖2所示。

圖2 設備管路結構圖Fig.2 Equipment pipeline structure diagram
1.3 實驗方法
1.3.1 滲透通量的測定
滲透通量,指單位時間內,透過單位膜面積的滲透液的體積,按公式(1)計算:
(1)
式中:J,滲透通量,L/(m3·h);V,滲透液體積,L;A,有效膜面積,m2;t,過膜時間,h。
1.3.2 滲透通量恢復率的測定
滲透通量恢復率,指污染后的膜組件經清洗后滲透通量的恢復效果,本實驗在25 ℃、壓力0.1 MPa下以純水為介質進行測定[13],按公式(2)計算:
(2)
式中:r,滲透通量恢復率;JQ,膜經清洗后的純水滲透通量,L/(m2·h);J0,新膜的純水滲透通量,L/(m2·h)。
1.3.3 膜清洗流程
對污染后的陶瓷膜采用3步清洗方案,首先在反應結束后先用清水完全頂出殘余物料,然后向反應罐中再加入清水,遵循低壓高流速原則[14]進行清洗,調節設備參數使清洗條件保持在物料流速1 000 L/h、過膜壓力0.1 MPa,同時外循環閥門開度調至最大,此條件下充分循環沖洗40 min 后排出污水;隨后加入不同清洗劑并調至其對應清洗溫度循環清洗40 min,排出物料;最后再加入清水60 ℃同條件循環40 min。
1.3.4 數據處理
實驗結果為3次獨立實驗的平均值,用平均值和標準偏差表示。采用Origin Pro 8.0軟件分析數據和作圖,用SPSS 20.0和STATISTICA 12.0軟件進行統計學分析和非標準模型擬合分析(P<0.05)。
2 結果與分析
2.1 污染物來源及組成
該陶瓷膜設備所運行的環境為:20%(質量分數)玉米淀粉在MFA酶的催化作用下制備直鏈麥芽低聚糖體系,經產物分析發現有95%的淀粉底物被水解成小分子低聚糖并被分離出體系,所用MFA酶液為粗酶液,其中含有少量碳源、氮源等不溶物,反應結束時料液中總固體含量約為1%~2%;該MFA酶分子質量為58 kDa,絕大部分酶蛋白分子被攔截在截留側,且玉米淀粉中同樣含有少量蛋白成分;反應結束后體系pH值為5.5~6.3。綜合分析,在實驗中造成陶瓷膜污染的主要成分為淀粉、多糖和少量蛋白。
2.2 膜污染理論模型及污染機制分析
在HERMIA[7]、FIELD等[8]的理論基礎上,經過后人對模型的不斷優化,最終逐漸形成了適用于錯流過濾的4種基本污染理論模型,即濾餅模型(cake filtration model)、部分堵塞模型(intermediate blocking model)、完全堵塞模型(complete blocking model)和內部堵塞模型(internal blocking model)[15],如圖3所示。

圖3 四種典型的膜污染模型Fig.3 Four typical membrane fouling models
(1)濾餅模型:當污染物顆粒粒徑大于膜孔徑時,料液中的大分子物質和凝膠類物質在膜表面發生沉積和絮凝,形成一定面積、一定厚度的濾餅污染層,造成膜滲透通量下降,對應模型如公式(3)所示(n=0):
(3)
式中:G即K0,模型常數;Jlim,穩態時的滲透通量,L/(m2·h);J,反應結束后的滲透通量,L/(m2·h);J0,反應初始時膜滲透通量,L/(m2·h);t,反應時間,min;n,模型參數[16](下同)。
(2)部分堵塞模型:當污染物粒徑小于孔徑1~2的數量級時,污染物以“架橋”的方式在膜孔附近沉積但并不完全堵塞膜孔[9, 17],此時污染物逐漸在膜表面形成沉積層。如公式(4)所示(n=1):
(4)
式中:σ即K1,模型常數。
(3)完全堵塞模型:當物料中的污染物粒徑與膜孔徑相近時,形成的污染類型,此時污染物將部分膜孔完全“封死”,對膜的處理能力造成較大影響。如公式(5)所示(n=2):
J=Jlim+(J0-Jlim)e-K2t
(5)
式中:K2,模型常數。
(4)內部堵塞模型:污染物粒徑小于孔徑3個數量級時形成的污染[17],污染物通過機械作用或吸附作用附著在膜孔內部,并隨著時間的延續不斷累積,影響膜的分離特性,模型如公式(6)所示(n=1.5,Jlim=0):
(6)
式中:[(KS′/2)A0.5]整體即K1.5,模型常數[16]。
為更好地分析陶瓷膜反應器水解玉米淀粉過程中的膜污染機制,應用STATISTICA 12.0軟件對上述4種非標準模型進行非線性回歸擬合分析,當模型參數n分別為0、1、1.5、2時,對應的擬合結果如圖4所示,濾餅模型、部分堵塞模型、內部堵塞模型、完全堵塞模型的擬合度R分別為0.892 1、0.868 0、0.858 5和0.988 9;模型系數Kn分別為1.73×10-4、2.35×10-3、5.88×10-2、2.48×10-4。說明該體系中,完全堵塞模型占主導地位,與此同時其他3種污染方式共存,且影響程度較為接近。在反應初期,淀粉底物以大分子形式出現,最先在膜表面形成污染層,使膜通量快速下降,隨著反應的進行,污染物被酶水解分子質量逐漸減小,當污染物粒徑與膜孔徑相近時,部分膜孔被污染物完全堵塞,而更小粒徑的污染物則較難進一步進入孔內形成污染使得其擬合度R值最小[18]。
針對上述污染機制,初步確定了幾種清洗方案及操作條件如表1所示,該體系下污染物多為水解后殘留的淀粉大分子、多糖類物質和少量蛋白,較高溫度的純水對其具有較好的溶解性,可起到一定的清洗效果;王愷等[19]研究發現檸檬酸與淀粉發生酯化反應形成的檸檬酸酯淀粉,其黏度發生明顯降低,對污染物有一定的清除效果;NaOH溶液及NaOH與NaClO的復配溶液,可使污染物凝膠層和吸附層發生松動,氧化劑對蛋白質、脂類等有機物的去除可起到增強的效果[14],對該體系下的污染物有一定的清潔作用;α-淀粉酶具有強水解作用,可水解淀粉大分子,起到清除污染層、恢復膜通量的效果。基于上述理論,將清洗方案確定為純水清洗、檸檬酸清洗、NaOH清洗、NaOH和NaClO的復配清洗以及α-淀粉酶清洗。
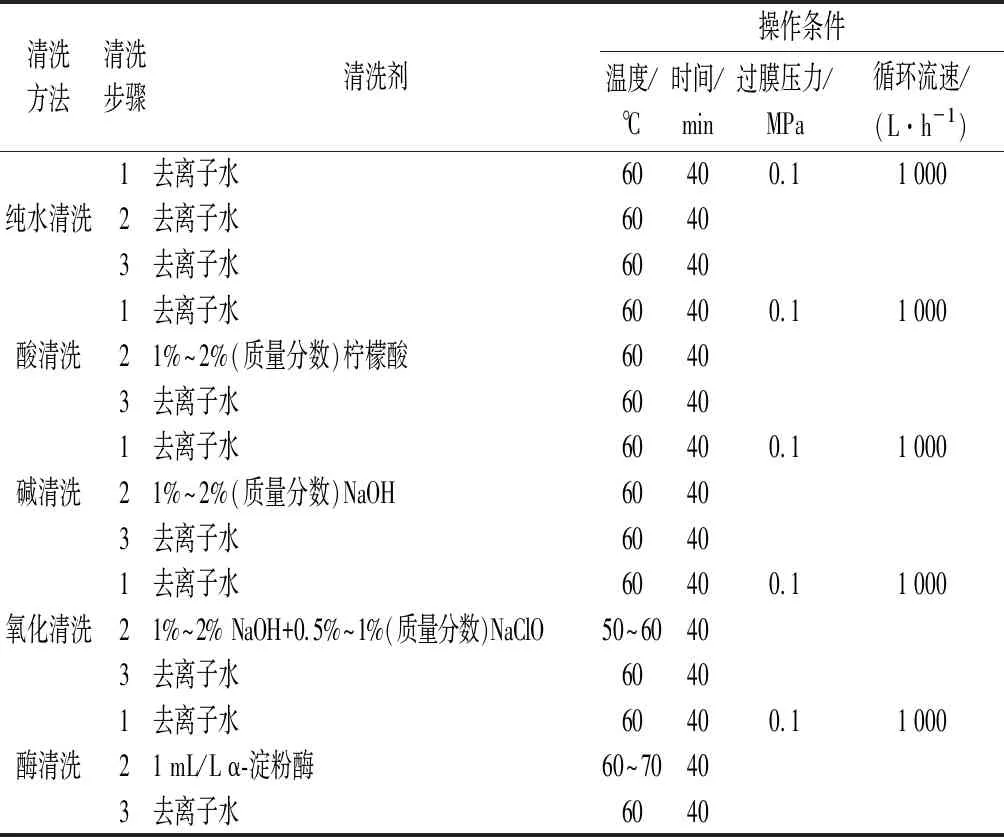
表1 不同膜清洗方案及操作條件Table 1 Different membrane cleaning programs and operating conditions
2.3 純水清洗
應用純水對污染后的陶瓷膜進行清洗復性,過程如圖5所示,清洗開始階段,膜滲透通量恢復率隨清洗時間的延長不斷恢復,此過程中高溫高流速的清水可洗去設備及管路中的部分殘余物料,在高流速的作用下膜表面的污染物沉積層和凝膠層發生松動,并隨物料排出體系;第二階段將廢水排出體系后,加入新的純水繼續清洗40 min,發現其滲透通量繼續提高。原因可能是第一階段所用水中混合了大量殘余污染物,使得滲透通量難以繼續提高,但純水對膜孔內污染物及蛋白等有機類污染物的清潔效率有限,導致第三階段滲透通量恢復率依舊沒有明顯提升。清洗結束后,滲透通量恢復率僅為71.53%。

a-濾餅模型擬合曲線;b-部分堵塞模型擬合曲線;c-內部堵塞模型擬合曲線;d-完全堵塞模型擬合曲線圖4 四種污染模型擬合曲線Fig.4 Fitting curves of four pollution models

圖5 純水清洗對膜通量恢復的影響Fig.5 The effect of pure water cleaning on membrane flux recovery
2.4 檸檬酸清洗
將膜清洗過程中第二階段所用清洗劑改為1.5%的檸檬酸溶液,結果如圖6所示,經過3個階段清洗,最終在25 ℃下測得純水通量為227 L/(m2·h)。原因可能是較低的pH值可在一定程度上提高淀粉分子的溶脹程度,提高淀粉的溶解度,而檸檬酸上的羧基可與淀粉分子上的羥基發生酯化反應形成檸檬酸酯淀粉[20],降低淀粉黏度[19],加之該體系下的玉米淀粉已經過糊化,暴露出更多的活性末端,有利于與檸檬酸的結合;同時,在酸性條件下,檸檬酸會使淀粉及多糖類物質會發生一定程度的降解,使污染物溶解度提高,有利于膜通量的恢復[21]。最終膜滲透通量恢復率達到86.92%,但仍未達到90%以上,可能原因為一方面該條件未能充分達到酯化反應所需條件[20],淀粉與檸檬酸的酯化程度有限;另一方面陶瓷膜在酸性條件下膜孔收縮,膜強度提高[22],未能有效除去孔內的污染物,從而使得滲透通量沒能恢復至更高水平。

圖6 檸檬酸清洗對膜通量恢復的影響Fig.6 The effect of citric acid cleaning on membrane flux recovery
2.5 堿清洗
將膜清洗過程中第二階段清洗劑改為1%~2%的NaOH溶液,結果如圖7所示,經過前2個階段的清洗后,改用純水在同條件下清洗40 min發現膜通量相較于酸清洗明顯提高,甚至超過25 ℃下新膜的純水通量,原因可能是60 ℃較高的水溫會使模孔徑發生可逆擴張,通量增大;隨后排凈廢液,并使體系pH恢復至中性。測得25 ℃下純水通量達到245 L/(m2·h),膜滲透通量恢復率達到95.7%。谷磊等[14]利用0.5%~1%的NaOH溶液在高流速下清洗被污染的陶瓷膜,使陶瓷膜通量恢復至96%以上,認為強堿清洗劑可破壞蛋白的凝結狀態,改變蛋白的堆積結構,對膜表面及膜孔內的污染物都有著良好的清潔效果。而本實驗中所用MFA酶分子質量為58 kDa,較為接近膜的截留分子質量50 kDa,生產過程中在壓力的作用下易使酶蛋白進入膜孔形成污染,而NaOH溶液不僅可以使陶瓷膜膜孔充分放松,有利于對孔內污染物的清洗[22],同時可使污染物中的蛋白質變性,使其聚集結構變得松散,促進其溶出,從而起到清洗膜表面和膜孔內部的雙重作用[23]。
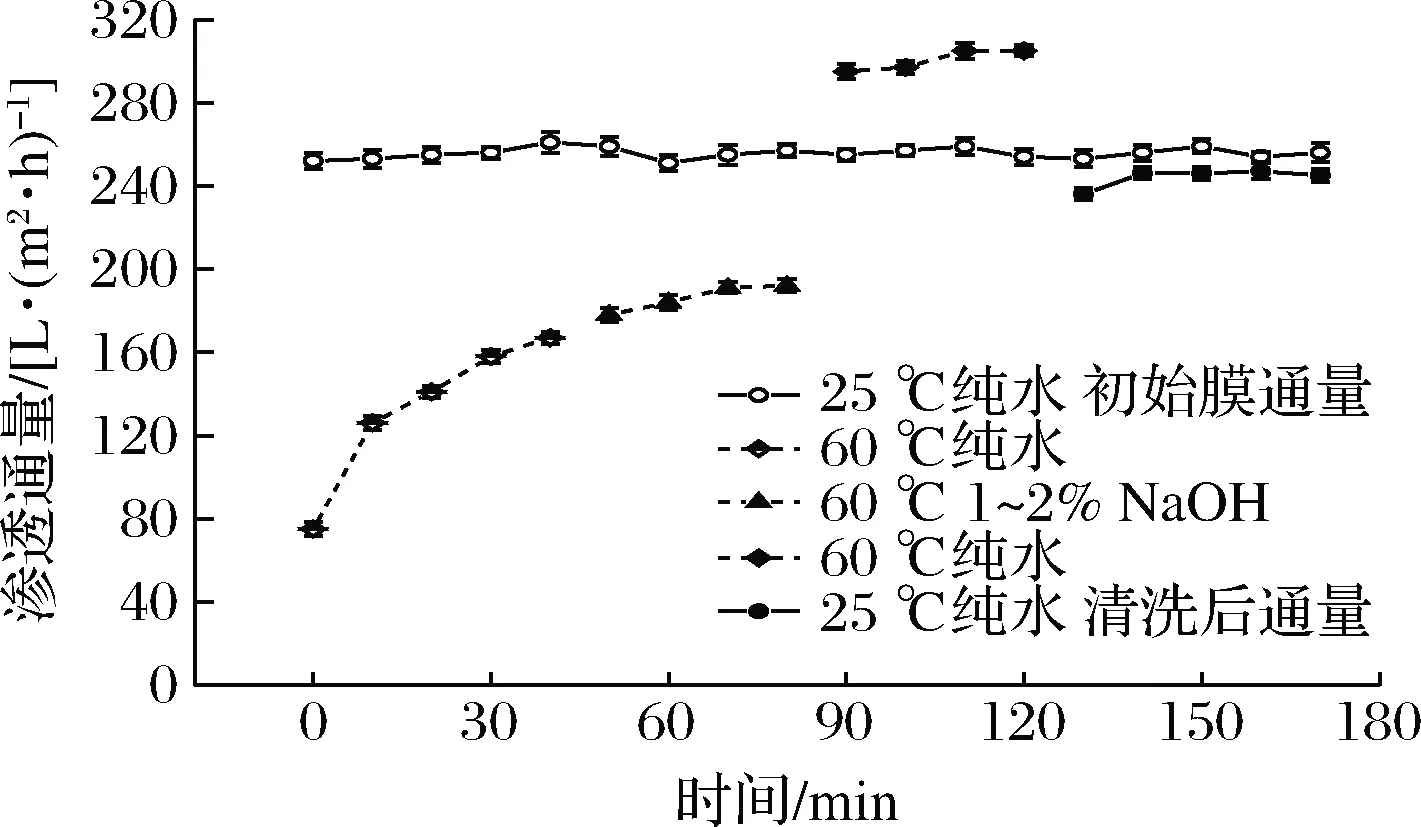
圖7 NaOH清洗對膜通量恢復的影響Fig.7 The effect of NaOH solution cleaning on membrane flux recovery
2.6 氧化劑清洗
將第二步所用試劑改為1%~2%的NaOH和0.5%~1%的NaClO復配溶液,并將pH值調至11~12,結果如圖8所示,第二階段清洗40 min后發現滲透通量也超過25 ℃下的新膜通量;當溫度降至25 ℃時,膜純水滲透通量達到254 L/(m2·h),通量恢復率接近100%。章小同等[24]利用2%的NaOH和0.5%的NaClO混合溶液,清洗被含有一定濃度蛋白的淀粉糖槳所污染的陶瓷膜發現,二者復配使用可對膜表面及孔內的有機類污染物和糖漿起到良好的去除效果,最終使膜通量恢復至100%,與本實驗結果較為接近。因為氧化劑NaClO與NaOH共同使用,在強堿性條件下使膜孔放松,提高了對孔內污染物的清洗強度,同時在強氧化劑的作用下,加劇了蛋白變性,使污染物更易溶出,有效去除了孔內的沉積層和凝膠層,二者復配使用優于單獨清洗[18]。但該清洗方法成本相對較高,且廢液pH值在10以上,對環境存在一定的污染性,需中和處理后進行排放,后續有待對二者濃度及配比進行進一步研究,以降低成本和減小對環境的污染。

圖8 氧化劑清洗對膜通量恢復的影響Fig.8 The effect of oxidant cleaning on membrane flux recovery
2.7 淀粉酶清洗
將第二步所用試劑改為1 mL/L的α-淀粉酶,結果如圖9所示,最終將體系溫度降至25 ℃測得純水通量為236 L/(m2·h),膜滲透通量恢復率達到92.31%。原因在于α-淀粉酶具有較強的水解能力,可以水解未充分反應的淀粉大分子[25],污染物中大部分均可被該酶水解。經實驗室測定,該高溫α-淀粉酶在70~80 ℃時酶活力可達到80%以上,且在高流速下,由于物料與膜表面的摩擦作用,會使體系溫度略有提高[22],可進一步提高該酶的催化活力。但由于酶對膜孔內污染物和蛋白的清洗效果有限,使得最終膜滲透通量恢復率未能達到更高水平。趙延均等[26]先利用胰蛋白酶,后利用NaOH溶液清洗被蛋白和固形物污染的超濾膜發現,兩步清洗效果優于二者單獨清洗,最終使膜通量恢復至95%以上。二者共同使用,一方面彌補了酶對于孔內污染物清潔能力的不足,另一方面酶對其底物的作用效率高于無機試劑;第二步NaOH可同時將第一步中的蛋白酶充分去除,避免了二次污染。后續研究中可借鑒此方案來進一步提高清洗效果,降低清洗成本。
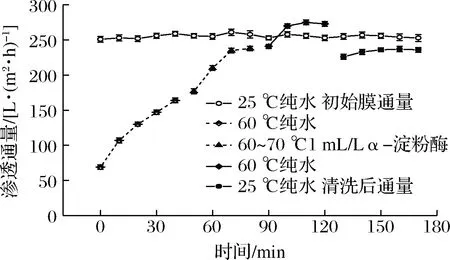
圖9 淀粉酶清洗對膜通量恢復的影響Fig.9 The effect of amylase cleaning on membrane flux recovery
3 結論
本文對于應用陶瓷膜反應器制備直鏈麥芽低聚糖體系中發生的膜污染,通過模型擬合,發現其污染機制受完全堵塞模型所主導,其他3種污染并存。在此基礎上,用常見的清洗劑對其進行膜復性,結果表明,純水和檸檬酸清洗后膜通量未能恢復至90%以上;1 mL/L的α-淀粉酶清洗劑可使膜通量恢復至92.31%;堿清洗劑和氧化清洗劑可使膜通量恢復至95%以上,是比較理想的清洗方案,NaOH和NaClO復配使用清洗效果優于NaOH單獨使用,清洗后膜通量接近100%。綜合分析,對于由淀粉、多糖及少量蛋白所造成的膜污染,加酶清洗適用于膜的日常清潔,氧化清洗則適用于長期或高強度生產后的膜復性。

