雙模態改良型酶聯免疫吸附測定法用于黃曲霉毒素B1的檢測研究
張光胤,蔡愛麗,鄧放明,趙倩*,石星波
1(食品科學與生物技術湖南省重點實驗室,湖南 長沙,410128)2(湖南農業大學 食品科學技術學院,湖南 長沙,410128)
由真菌毒素引起的食品安全已成為人們高度關注的熱點問題。其中以黃曲霉毒素B1(aflatoxin B1,AFB1)污染最為嚴重,其毒性、致癌性、致突變性、致畸性在所有真菌毒素中最強[1-4],并容易污染谷物,乳制品,水果和飼料[5]。許多國家都規定了AFB1的限量標準,例如,歐盟對AFB1的要求低至2 μg/kg[6]。我國對食品中AFB1也采取了嚴格的限量標準,例如,花生、玉米及其制品中的AFB1≤20 μg/kg;糧食、豆類、發酵食品及調味品中的AFB1≤5 μg/kg;乳制品及嬰兒配方食品中AFB1≤10 μg/kg[7]。目前食品中AFB1的主要檢測方法包括液相色譜-質譜法[8-9]、高效液相色譜法[10]、免疫色譜法[11-12]、時間分辨免疫熒光分析技術[13-14]。雖然這些分析法具有較好的準確度和良好的重復性,但仍存在著耗時、靈敏度低、需要復雜昂貴的檢測儀器和專業操作人員的缺陷,在基層和現場無法被廣泛應用。因此,建立一種簡便、快速、靈敏的檢測方法顯得尤為重要。
酶聯免疫吸附檢測方法(enzyme linked immunosorbent assay,ELISA)作為應用最廣的方法之一[15],在食品質量控制領域引起了廣泛的關注[16-17]。但是,由于ELISA依賴抗體捕獲目標物,成本較高,且只能達到中等靈敏度(μg/mL~ng/mL),無法滿足痕量目標物的檢測[18]。至今為止,研發人員已利用納米材料具有較大的比表面積、易于化學修飾、高負載能力的優點[19-20],通過納米材料作為載體來富集酶提高了ELISA的靈敏度[21-23]。盡管使用納米材料改良ELISA已擁有可觀的前景,但仍無法滿足便攜和現場檢測的需求。
核酸適配體(aptamer,Apt)是由TUERK等[24]創建的指數富集的配體系統進化技術從DNA數據庫里篩選出來可特異性識別靶標物質的核酸序列。相對于抗體而言,Apt的特異性更強、穩定性更高且更易于合成和修飾,特別適合作為小分子的生物識別元件[25-26]。研究表明,Apt技術可提高檢測的敏感度和特異性[27],并且Apt和抗體的組合也顯示出了良好的特異性[28-29]。
我們設計了一種雙模態改良型ELISA,用于AFB1的高靈敏便攜式檢測。使用親和素化的磁納米顆粒(magnetic nanoparticles,MNPs)作為載體,富集辣根過氧化物酶(horseradish peroxidase,HRP),同時偶聯生物素化的AFB1Apt制備檢測探針(MNPs@Apt@HRP)。通過Apt與抗體組合共同識別目標物,以HRP催化H2O2氧化無色底物TMB成為藍色的ox-TMB,經過808 nm激光照射后ox-TMB還可發生很強的光熱效應使溶液溫度升高。
1 材料與方法
1.1 試劑與材料
AFB1標品(分析純),美正生物科技有限公司。TMB(分析純)、磷酸鹽緩沖溶液(phosphate buffer saline,PBS),北京索萊寶科技有限公司。H2O2(30%)、檸檬酸(分析純)、醋酸鈉(分析純)、乙二胺四乙酸二鈉(分析純),國藥集團化學試劑有限公司。AFB1Apt序列(5′-3′)為:GTT GGG CAC GTG TTG TCT CTC TGT GTC TCG TGC CCT TCG CTA GGC CC[27],由上海生工生物工程有限公司合成。
Heraeus Pico 17離心機,賽默飛世爾科技公司產品;TCS-10金屬恒溫振蕩器,杭州瑞誠儀器有限公司產品;Spark多功能酶標儀,瑞士帝肯公司產品;LSR808H-7 W-FC808激光器,吉藤電子科技有限公司產品;ELISA試劑盒,美正生物技術有限公司產品。
1.2 MNPs@Apt@HRP檢測探針的制備
將MNPs(12 μL,0.1 mg beads/mL),AFB1Apt(12 μL,100 μmol/L)和HRP(12 μL,0.1 g/L)混合后,使用PBS稀釋至1.2 mL,25 ℃ 孵育40 min,10 000 r/min離心8 min,并用超純水洗滌3次除去多余HRP與AFB1適配體,洗滌后加入1.2 mL的PBS重懸,得到MNPs@Apt@HRP檢測探針,4 ℃保存備用。
1.3 探針的制備優化及驗證研究
取0.1 μL MNPs(10 mg beads/mL)與12 μL HRP(0.1 g/L),加入PBS緩沖液稀釋至1 mL。25 ℃條件下分別孵育10、20、30、40、50 min后,10 000 r/min離心8 min,分別取上清液10 μL,加入等體積的TMB和H2O2,避光反應30 min,使用多功能酶標儀檢測A652nm。
分別取10 μL HRP和50 μL H2O2;10 μL HRP和50 μL TMB;50 μL TMB和50 μL H2O2;10 μL HRP,50 μL TMB和50 μL H2O2作為對照組。然后分別取100 μL MNPs,50 μL TMB和50 μL H2O2;100 μL MNPs@Apt@HRP,50 μL TMB和50 μL H2O2作為實驗組(使用的HRP質量濃度為0.1 g/L)。避光反應30 min。觀察溶液的顏色變化,檢測A652nm(每組3個平行)。然后使用808 nm激光照射4 min。立即將便攜式溫度計插入溶液中,檢測溶液溫度變化。插入溫度計探頭約5~8 s后獲得的最高穩定值為光熱測量信號。
1.4 探針調控比色信號研究
分別取100 μL質量濃度為5×10-3、2×10-3、1×10-3、6×10-4、3×10-4、1×10-4、6×10-5、3×10-5g/L的MNPs@Apt@HRP加入到50 μL TMB和50 μL H2O2溶液中,避光反應30 min。觀察溶液的顏色變化,并檢測A652nm。
1.5 基于比色與熱雙模態改良型ELISA檢測方法的建立
1.5.1 AFB1標準曲線的繪制
利用MNPs@Apt@HRP檢測探針與抗體的組合識別96孔聚苯乙烯微板上的一系列濃度的AFB1。具體步驟如下:
(1)AFB1抗體包被:向微孔板中加入100 μL 10 g/L AFB1抗體,4 ℃過夜;
(2)封閉:棄去液體,甩干,并用0.01 mol/L PBS緩沖液洗滌3次,加入200 μL牛血清白蛋白(BSA,0.001 g/L)進行封閉,37 ℃下避光孵育1 h;
(3)加入AFB1標準溶:棄去液體,甩干,用0.01 mol/L PBS緩沖液洗滌3次,分別加入質量濃度為1×10-5、1×10-6、1×10-7、1×10-8、1×10-9、1×10-10、1×10-11、1×10-12g/L的AFB1標準溶液,25 ℃ 下避光孵育30 min(每個濃度3組平行);
(4)加入MNPs@Apt@HRP探針:棄去液體,甩干,用0.01 mol/L PBS緩沖液洗滌3次,向孔中加入200 μL MNPs@Apt@HRP探針溶液,25 ℃下避光孵育30 min。
(5)加入底物:棄去液體,甩干,用0.01 mol/L PBS緩沖液洗滌3次,加入100 μL PBS緩沖液,50 μL TMB和50 μL H2O2,然后避光于25 ℃孵育30 min。
拍照記錄每個孔中溶液顏色的變化,檢測溶液的A652nm并進行光熱免疫測定,記錄得到的雙模態信號分別繪制AFB1檢測的標準曲線。
1.5.2 比色與熱雙模態改良型ELISA的特異性研究
分別選取7種結構類似于AFB1的化合物,包括棒曲霉素(patulin)、黃曲霉毒素B2(aflatoxin B2,AFB2)、T-2毒素(trichothecenes,TS)、伏馬毒素B1(fumonisin B1,FB1)、玉米赤酶烯酮(zearalenone,ZEN)、赭曲霉毒素A(ochratoxin A,OTA)、脫氧雪腐鐮刀菌烯醇(deoxynivalenol,DON)及混合樣品,測試該方法的特異性。AFB1的質量濃度為10-7g/L;干擾毒素的質量濃度為10-6g/L。在相同條件下,檢測溶液的雙模態信號變化。
1.6 幾種常見食品中AFB1的檢測
1.6.1 比色與熱雙模態改良型ELISA
1.6.1.1 樣品的前處理
(1)牛奶:取1 mL樣品,加入3 mL超純水,混合均勻;加熱至沸騰10 min;立刻以10 000 r/min離心10 min,取上清液備用。
(2)花生:將樣品粉碎,取5.0 g置入100 mL錐形瓶中,加入40%甲醇25 mL混合均勻;振蕩10 min(200 r/min);以4 000 r/min離心5 min;取上清液1 mL,再加入4 mL去離子水;搖勻,備用。
(3)醬油:取5.0 g樣品,加入10 mL乙腈溶液,振蕩10 min(200 r/min)后,4 000 r/min離心5 min;取0.5 mL上清液,加入4.5 mL超純水;搖勻,備用。
(4)醋:取1 mL樣品,加入4 mL甲醇,振蕩均勻后,4 000 r/min離心5 min;取1 mL上層液體,加入9 mL超純水,將混合液的pH調節至7~8;搖勻,備用。
1.6.1.2 牛奶樣品中加標回收率檢測
取1 mL牛奶前處理的上清液,加入一定量的AFB1標準溶液,使上清液中AFB1的終質量濃度分別為1×10-7、1×10-8、1×10-9g/L(做3組平行)。根據上文中所述實驗過程,完成牛奶樣品中AFB1的檢測,并計算回收率。
1.6.1.3 樣品中AFB1含量的檢測
將本文建立的比色與熱雙模態改良型ELISA用于檢測花生、牛奶、醬油和醋4種樣品中AFB1的含量,并與商業化試劑盒檢測結果進行對比分析,驗證該檢測方法的準確性及可靠性。
1.6.2 商業化ELISA試劑盒
為了驗證新建方法的準確性,采用商業化ELISA試劑盒進行 AFB1檢測,具體操作見試劑盒說明。
2 結果與分析
2.1 比色與熱雙模態改良型ELISA檢測AFB1的原理
圖1展示了比色與熱雙模態改良型ELISA檢測AFB1的原理。在聚苯乙烯微孔板上包被AFB1抗體,MNPs@Apt@HRP為檢測探針。當AFB1存在時,通過Apt和抗體的組合識別并捕獲AFB1,形成“三明治”結構。以TMB和H2O2作為顯色底物,待檢物濃度的改變會導致探針濃度的不同,從而影響底物TMB顏色的改變,實現對AFB1的可視化檢測。再通過808 nm激光照射之后,ox-TMB產生的光熱效應導致溶液溫度升高,以便攜式溫度計實現對AFB1的熱信號便攜檢測。AFB1濃度越大,偶聯的探針越多,ox-TMB顯色越明顯;溫度升高越多。相反,如果沒有目標分子或者很少,檢測探針被沖洗掉后,無比色及溫度信號產生。通過ox-TMB的A652nm與經過808 nm激光4 W/cm2功率密度照射2 min后的溫度變化,實現了對AFB1的雙模態信號檢測。
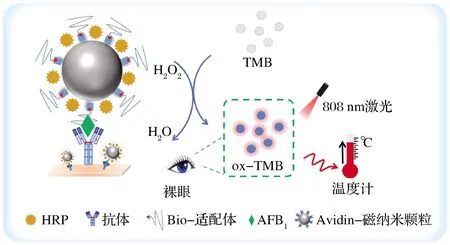
圖1 基于比色與熱雙模態改良型ELISA用于AFB1 檢測的原理示意圖Fig.1 Schematic diagram of high-sensitivity detection of AFB1 based on colorimetric and thermal bimodal improved ELISA
2.2 探針制備的優化
HRP催化TMB氧化生成ox-TMB是信號產生的關鍵因素,為了探索最佳的實驗條件,我們研究了MNPs與HRP結合時間(10、20、30、40、50 min)對探針的影響。MNPs與HRP結合完畢后離心分離游離的HRP,取離心后的上清液進行顯色反應。通過比較A652nm可以獲得MNPs與HRP的最佳結合時間。如圖2所示,結合時間達到40 min時,曲線趨勢趨于穩定,ox-TMB的顏色不再產生明顯變化,此時MNPs與HRP的結合效率較高。因此,選擇40 min作為MNPs與HRP的結合時間。
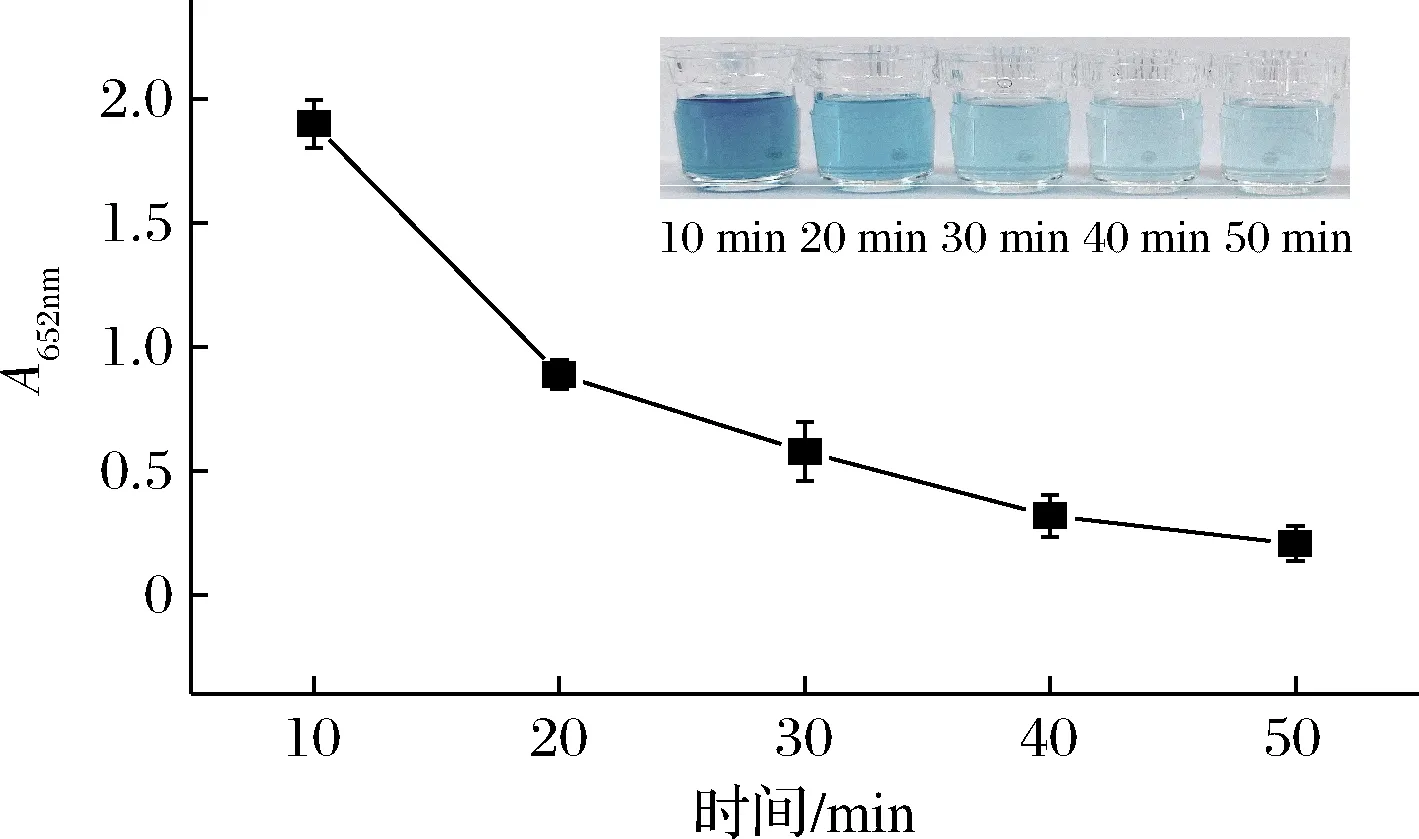
圖2 不同時間MNPs與HRP結合離心后上清液中HRP 催化生成ox-TMB的吸光度值Fig.2 The absorbance value of HRP catalyzed to produce ox-TMB in the supernatant after centrifugation of MNPs and HRP at different times 注:插圖為不同時間對應的比色照片
2.3 HRP修飾情況與實驗可行性的驗證
HRP成功修飾在MNPs的表面,并且MNPs不影響顯色反應是該方法建立的前提。本文探究了不同情況下TMB和H2O2顯色反應,以此考察HRP在MNPs上的修飾情況與MNPs對顯色反應的影響(圖3)。
如圖3-a所示,只有HRP,TMB和H2O2都存在的情況下,溶液會從無色變為藍色,MNPs@Apt@HRP,TMB與H2O2都存在的情況下,也發生了顏色變化,表明MNPs@Apt@HRP成功催化TMB氧化生成ox-TMB,而單獨的MNPs無法催化TMB產生明顯的顏色變化。由此可證明,HRP已在MNPs的表面成功修飾。
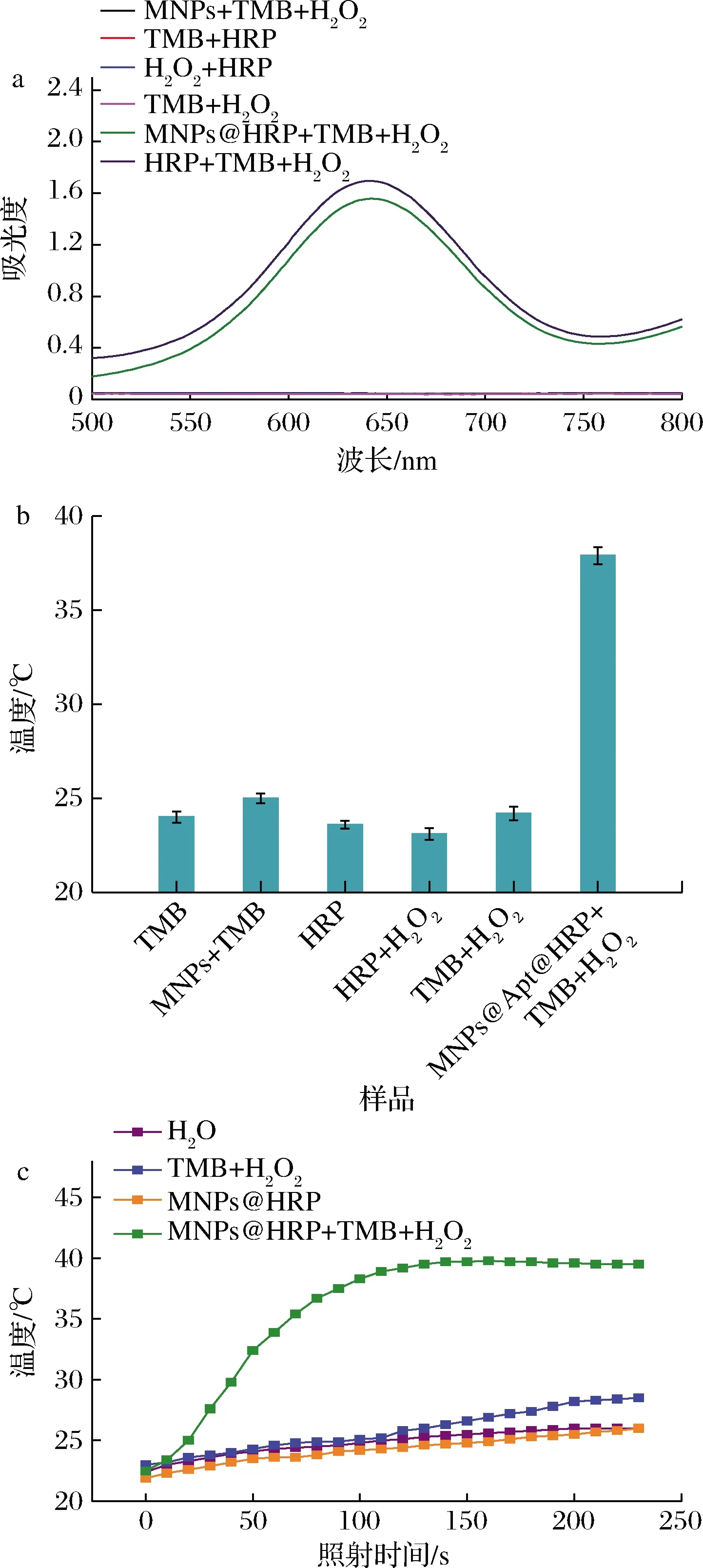
a-驗證HRP修飾情況的可見光光譜;b-不同反應溶液的溫度變化; c-時間對溫度變化的影響圖3 實驗可行性的驗證Fig.3 Verification of experimental feasibility
同樣,使用4 W/cm2的808 nm激光輻照2 min,測試光熱效應,輻照后立即使用便攜式溫度計測量溶液的溫度。如圖3-b所示,觀察到MNPs@Apt@HRP,TMB與H2O2都存在的體系中溫度升高了13.9 ℃,在TMB、MNPs+TMB、HRP、HRP+H2O2、TMB+H2O2的體系中輻照后未發現明顯的溫度升高。說明808 nm激光不會催化TMB氧化生成ox-TMB,而且熱信號的產生是因為ox-TMB受到輻照后將光信號轉變為熱信號。這些結果證明了MNPs@Apt@HRP探針介導的比色與熱雙模態改良型ELISA具備可行性。
為了確認輻照時間,使用808 nm激光持續照射3 min。使用便攜式溫度計連續監控溫度變化。如圖3-c所示,照射時間在0~150 s時,溫度隨時間的增加而增大,當時間達到150 s時,溫度趨于穩定,當時間>150 s時,溫度不再發生明顯改變。因此,在隨后的免疫分析研究中,以150 s作為照射時間。
2.4 MNPs@Apt@HRP對ox-TMB生成量的影響
微孔板中捕獲MNPs@Apt@HRP的量是否對生成的ox-TMB濃度有影響是比色與熱雙模態改良型ELISA完成對不同濃度AFB1檢測的關鍵。本文研究了不同濃度的MNPs@Apt@HRP對ox-TMB生成量的影響,結果如圖4所示。在3.91×10-6~5×10-3g/L,隨著探針濃度增加,觀察到混合液從無色到藍色的趨勢,并且探針質量濃度為5×10-3g/L時A652nm的增加最為明顯。表明隨著檢測探針濃度的增加,可產生更高濃度的ox-TMB,微孔板中捕獲的探針的量與ox-TMB比色信號的產生成正相關。
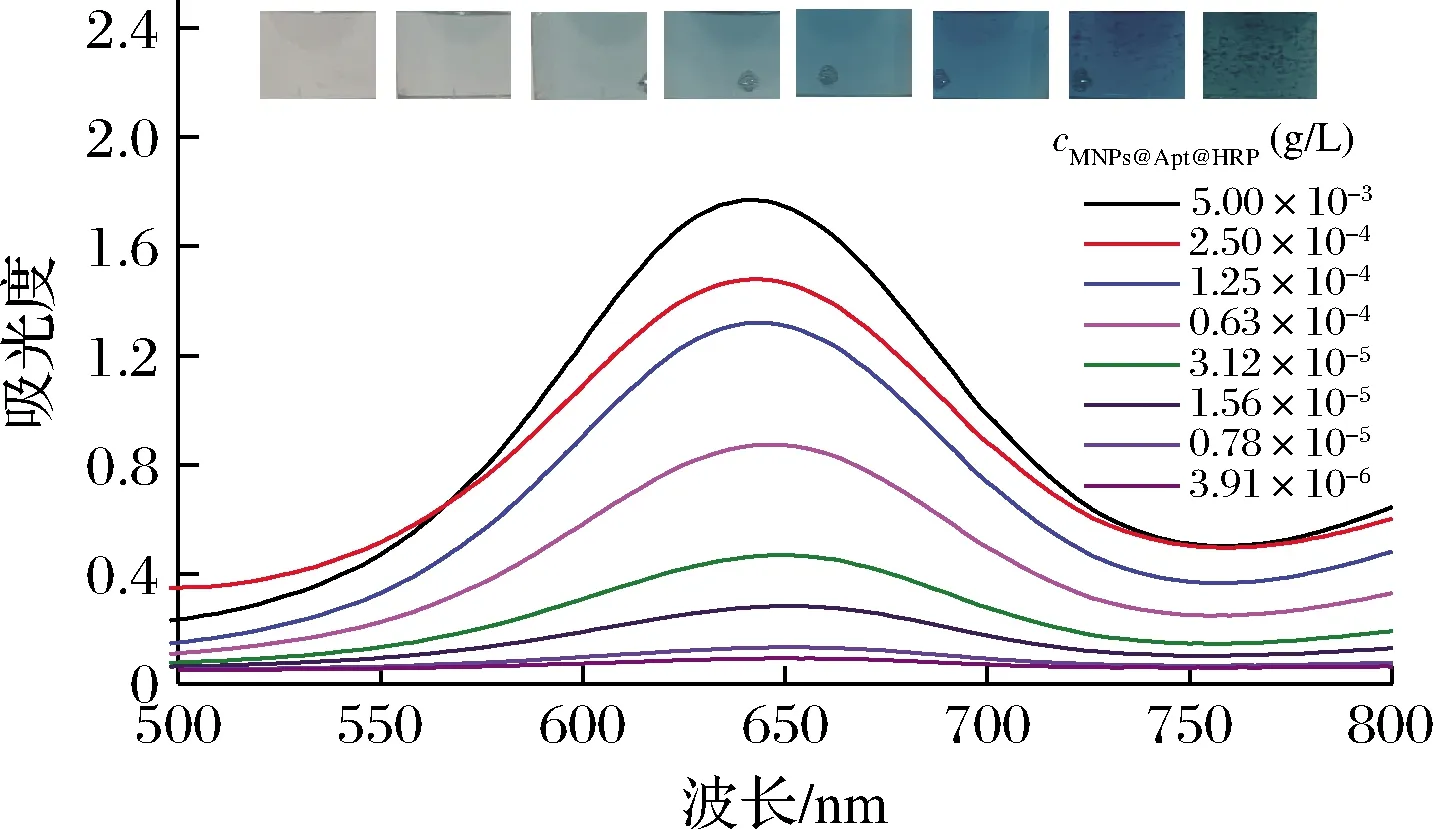
圖4 不同濃度的MNPs@Apt@HRP與TMB和H2O2 相互作用的可見光光譜Fig.4 Visible spectra of the interaction of different concentrations of MNPs@ATP@HRP with TMB and H2O2 注:插圖為不同濃度MNPs@Apt@HRP對應的混合液照片
2.5 比色與熱雙模態改良型ELISA用于AFB1的檢測
在最佳條件下,研究了比色與熱雙模態改良型ELISA用于AFB1檢測的靈敏度。如圖5-a所示,當AFB1的質量濃度為1×10-5~1×10-11g/L時A652nm與AFB1濃度的對數呈現良好的線性關系,回歸方程為A=0.047 1 lgc+0.757,線性相關系數R2=0.990 4(圖5-b)。圖5中插圖可用于定性或半定量分析。當AFB1的質量濃度達到1×10-12g/L時,A652nm幾乎不再發生明顯改變,檢測靈敏度達到2.47×10-12g/L。

a-可見光光譜;b-標準曲線圖5 不同濃度的AFB1可見光光譜和標準曲線Fig.5 The visible spectra of AFB1 with different concentrations and standard curve 注:插圖為不同濃度AFB1對混合液的顏色影響的照片
使用熱信號對AFB1進行定量檢測,結果如圖6所示。當AFB1質量濃度為1×10-8~1×10-12g/L時,溫度升高與AFB1濃度的對數呈線性相關,回歸方程為ΔT=1.57 lgc+28.72,線性相關系數R2=0.991 6,檢測靈敏度為3.79×10-13g/L。因此,通過使用便攜式溫度計可實現對AFB1的高靈敏定量檢測。
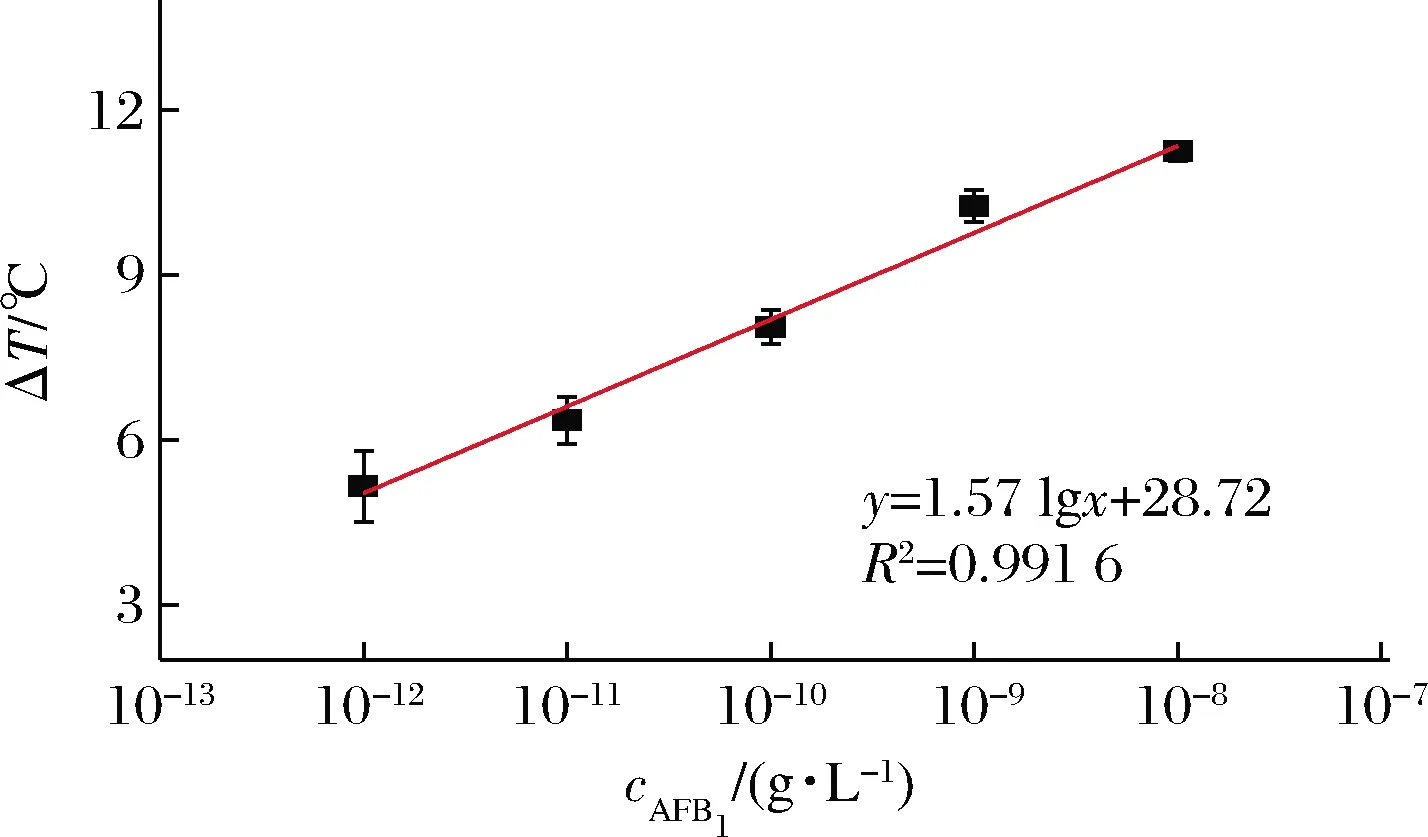
圖6 熱信號檢測AFB1的標準曲線Fig.6 Standard curve of thermal signal detection AFB1
2.6 比色與熱雙模態改良型ELISA用于AFB1檢測的特異性
使用比色與熱雙模態改良型ELISA分別測定了質量濃度為1×10-6g/L的干擾毒素(TS、OTA、AFB2、patulin、ZEN、FB1、DON)來進行免疫檢測特異性研究。結果如圖7所示,在檢測7種干擾毒素時,既沒有觀察到干擾毒素產生明顯的吸光度變化,并且無明顯的溫度信號產生。而在檢測低質量濃度AFB1(1×10-7g/L)時可觀察到A652nm出現明顯吸收峰,溫度信號也有明顯的升高。此外,測定混合液時,觀察到比色與溫度信號與單獨檢測AFB1時幾乎沒有變化。這些結果證明了即使存在高濃度干擾物質,比色與熱雙模態改良型ELISA仍具有較高的特異性。
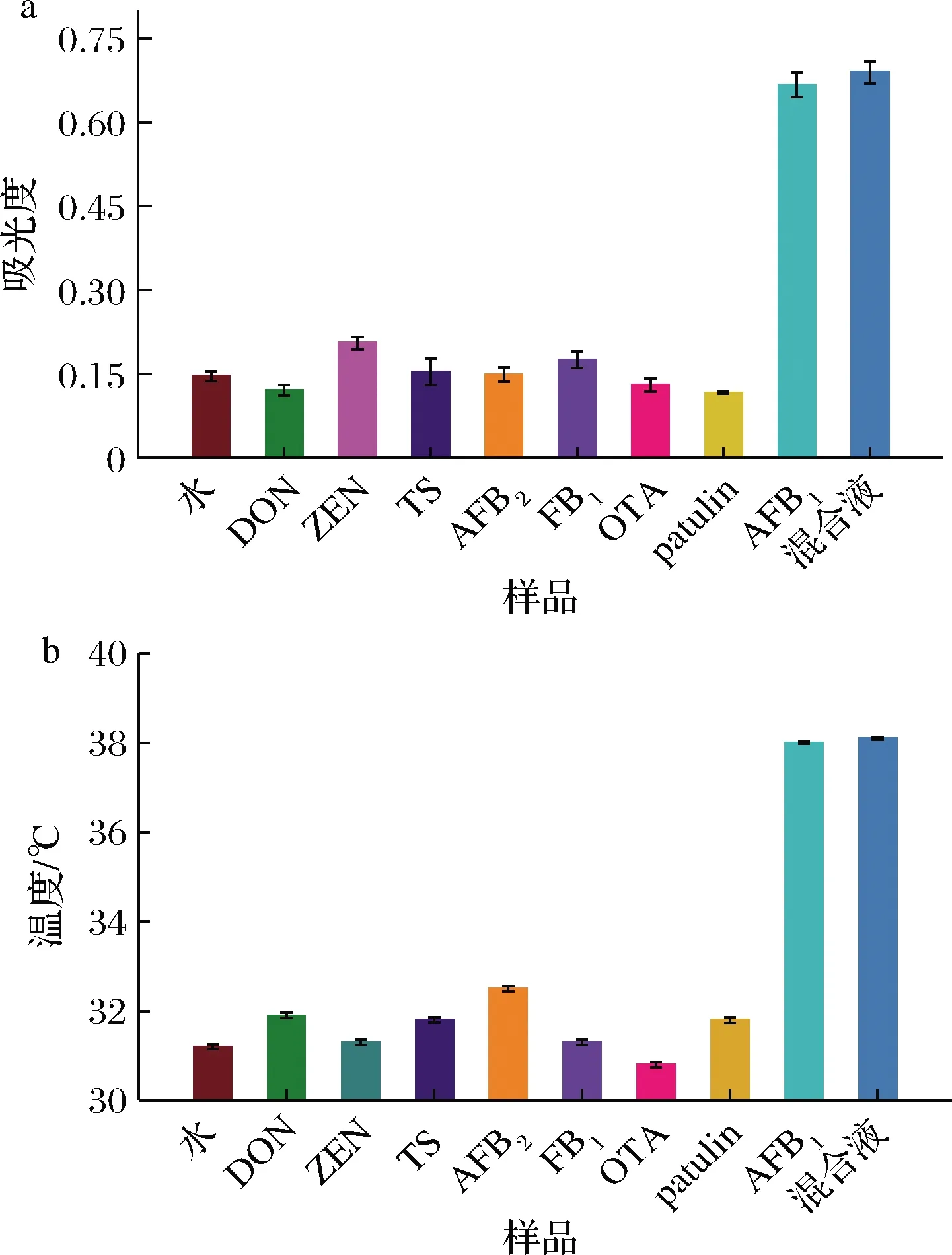
a-比色信號;b-熱信號圖7 檢測AFB1的特異性分析Fig.7 Specificity analysis of AFB1
2.7 方法實用性結果研究
為了驗證比色與熱雙模態改良型ELISA在實際樣品中的適用性,我們采用標準加入法對牛奶樣品中的AFB1含量進行了檢測。我們在商業化ELISA試劑盒未檢測到AFB1的牛奶樣品中加入不同濃度的AFB1標準品,使樣品中的AFB1終質量濃度分別為1×10-7、1×10-8、1×10-9g/L。檢測結果如表1所示,基于比色與熱信號的測結果與加入的理論值相比,二者基本保持一致。基于雙模態信號的檢測回收率分別為99.07%~100.82%;100.74%~102.12%,相對標準偏差(relative standard deviation,RSD)分別為1.03%~2.55%;1.13%~2.84%。結果證明了該方法在實際樣品檢測中具有良好的實用性和準確性。
表1 比色與熱雙模態改良型ELISA測定牛奶中 AFB1的回收率Table 1 Colorimetric and thermal bimodal improved ELISA to determine the recovery rate of AFB1 in milk
按照2.8中所述商業ELISA試劑盒中的使用方法檢測不同質量濃度的AFB1標準溶液(0、0.03、0.12、0.48、2 μg/L)。檢測結果如圖8 所示,隨著AFB1濃度的增大,A652nm逐漸降低。當AFB1質量濃度為0.03~2.00 μg/L,AFB1濃度與A652nm呈明顯線性關系,線性方程為A=-0.108 6 lgc+0.144 4,其中R2=0.994 9,檢測靈敏度為1.7×10-3g/L。本文中的雙模態改良型ELISA比色性檢測AFB1的靈敏度為2.47×10-12g/L,熱信號對AFB1的檢測靈敏度達到3.79×10-13g/L,分別比商業化試劑盒提高了3個和4個數量級。
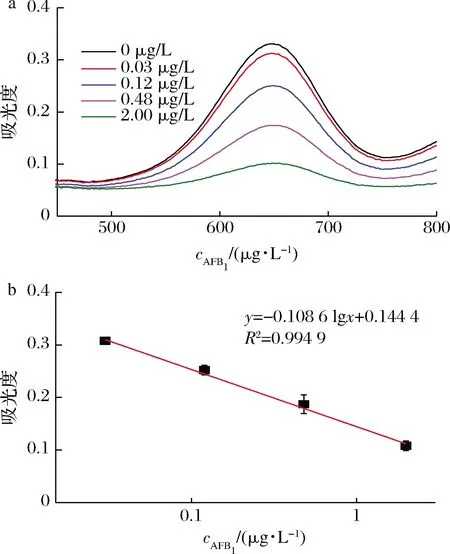
a-可見光光譜;b-標準曲線圖8 ELISA試劑盒的可見光光譜和標準曲線Fig.8 The visible spectra and standard curve of ELISA Kit
之后,我們用購買的ELISA試劑盒和設計的比色與熱雙模態改良型ELISA方法分別對花生、牛奶、醬油、醋4種樣品中的AFB1進行了檢測。如表2所示,試劑盒檢測出牛奶中AFB1的濃度與2種信號檢測出的結果基本保持一致,因此設計的改良型ELISA方法與ELISA試劑盒檢測結果具有一致性。試劑盒在花生、醬油、醋中未檢出AFB1。而比色信號與熱信號檢測到的花生,醬油和醋中AFB1的濃度基本一致,可見該方法實用性良好。盡管已檢測到一定量的AFB1,但遠遠低于國家要求的≤5 μg/L,仍在安全范圍內。
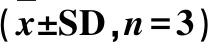
表2 比色與熱雙模態改良型ELISA檢測樣品中的 AFB1含量 單位:g/L
3 結論
本文采用MNPs作為載體來富集HRP和AFB1Apt制備檢測探針,Apt與抗體組合作為識別元件,以TMB的顯色反應與ox-TMB的光熱效應為信號輸出,構建了比色與熱雙模態的改良型ELISA,實現了AFB1的可視化比色及便攜式溫度信號的高靈敏及高特異性檢測,檢測靈敏度分別達到了2.47×10-12、3.79×10-13g/L。與商業化ELISA試劑盒相比, 靈敏度分別提高了3個和4個數量級。最后,將該方法成功應用于牛奶,花生,醋和醬油中AFB1的檢測。適配體與抗體的組合捕獲目標物相比試劑盒的競爭性結合更穩定、易修飾,且相較使用兩個抗體形成三明治結構的ELISA成本更低。因此,該方法能夠滿足痕量檢測AFB1的需求,在食品檢測領域具有良好的應用前景。

