食管癌患者術后發生低蛋白血癥的影響因素及其對臨床結局的影響
梁虹藝 1,黃雪峰 2,莫澤珣 3,徐曉玲 4,王冰 4,楊琰 4,袁進
(中國人民解放軍南部戰區總醫院 1.臨床藥學科;2.藥劑科;3.MICU,廣東廣州 510010;4.南方醫科大學藥學院,廣東廣州 510515)
據2018年全球癌癥數據,食管癌病死率和新發病率分別位居全球第6位和第7位[1]。我國是食管癌高發國家,發病率排全球前五,遠高于亞洲和世界平均水平[2-3]。早期食管癌患者內鏡下切除可獲得根治,療效與外科手術相當,患者5年生存率可達95%[4-5]。但手術后患者發生低蛋白血癥的比例較高。有研究報道,低蛋白血癥與食管癌術后發生肺部感染、吻合口瘺、傷口感染等并發癥密切相關。而對于食管癌術后患者是否補充、何時補充白蛋白尚存學術爭議,目前我國也尚未出臺人血白蛋白使用的相關指南或專家共識。本文通過分析我院近3年食管癌手術患者數據,以探討食管癌術后發生低蛋白血癥的高危因素及其對臨床結局的影響,進而評價術后補充白蛋白使用的合理性。
1 資料與方法
1.1 研究材料
通過醫院信息系統調取2015年1月?2017年12月在南部戰區總醫院胸外科行食管癌手術切除的所有住院患者病歷共211例,篩選出手術前血清白蛋白(Alb)正常(40~55 g/L)的131例作為研究對象,將術后未檢驗生化指標的病歷剔除。所有患者均在全麻下行食管癌根治術,術后行抗感染、術前/術后營養支持及其他對癥治療。
1.2 研究方法
自行設計Excel表格記錄患者病歷數據,包括患者性別、年齡、BMI、住院天數、病程、住院費用、手術名稱、手術時間、麻醉方式、出血量、輸血量、補液量、營養素用法用量、人血白蛋白用法用量、實驗室檢查等。根據術后首次檢查的血清Alb值,將其分為研究組(Alb<35 g/L)和對照組(Alb≥35 g/L)。單因素分析兩組患者一般資料、實驗室檢查、圍術期指標、營養支持情況,比較兩組患者住院時間、費用、術后并發癥和感染發生率。
由于本研究是回顧性病例分析,論文不涉及患者隱私,豁免倫理審批。
1.3 低蛋白血癥
低蛋白血癥是多種原因所致的血清總蛋白質減少特別是血清白蛋白的減少,本文所指低蛋白血癥是指血清白蛋白低于術前且絕對值<35 g/L[6]。
1.4 營養支持
本研究的營養支持指除正常飲食外,外源性輸注三大營養素,包括氨基酸、脂肪乳和葡萄糖。以1 g糖類物質提供4 kcal、1 g脂肪乳提供9 kcal計算營養支持提供的熱量;以6.25 g氨基酸約提供1 g氮量計算營養支持提供的氮量;由于住院期間患者每日營養攝入量略有變化,故按日均營養攝入計算。
1.5 臨床結局
根據Dino等[7]發表的Ⅴ級并發癥分類系統,將Ⅱ級以上的并發癥列入臨床結局觀察。以患者平均住院時間、住院費用、術后并發癥和術后感染例數為指標,考察研究組和血清白蛋白對照組以上指標的差異。
1.6 統計分析
運用SPSS25.0統計學軟件進行數據分析。計數資料用率表示,采用χ2檢驗;計量資料采用均數±標準差(x±s)表示,組間比較采用兩樣本獨立t檢驗(正態分布)及非參數檢驗(Mann-WhitneyU檢驗)(非正態分布),手術前后數據采用配對t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 患者一般情況
131份患者中,剔除18例術后未檢驗生化指標者,其余113例納入統計分析。其中男95例(占84.1%),女18例(占15.9%);年齡43~83歲,平均(59.2±8.2)歲。BMI最低10.8 kg/m2,最高29.4 kg/m2,平均(21.9±3.4)kg/m2;病程最短2 d,最長3年,平均(126.5±233.9)d。
2.2 術后低蛋白血癥情況
與術前相比,術后所有113例患者血清白蛋白均有所降低,由手術前的(43.66±2.76)g/L降至術后的(34.24±4.94)g/L,平均降低了(9.42±9.35)g/L,手術前后比較差異有統計學意義(P<0.01),其中64例發生術后低蛋白血癥(Alb<35 g/L),占56.64%。
2.3 影響術后低蛋白血癥因素
2.3.1 兩組患者一般資料 收集兩組性別、年齡、BMI、食管癌病程等一般資料,由表1可知,兩組患者一般資料對術后低蛋白血癥無顯著影響(P>0.05)。
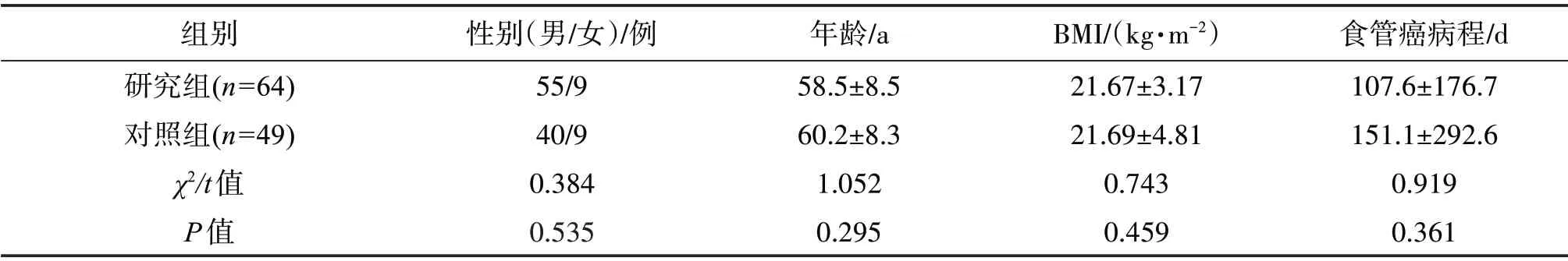
表1 兩組患者一般資料比較Table 1 Comparison of general information of patients between two groups(x±s)
2.3.2 術前實驗室數據比較 由表2可知,研究組和對照組的術前實驗室檢測指標,除了腺苷脫氫酶檢測結果差異具有統計學意義外(P<0.05),其余指標檢測結果均無顯著性差異(P>0.05)。見表2。
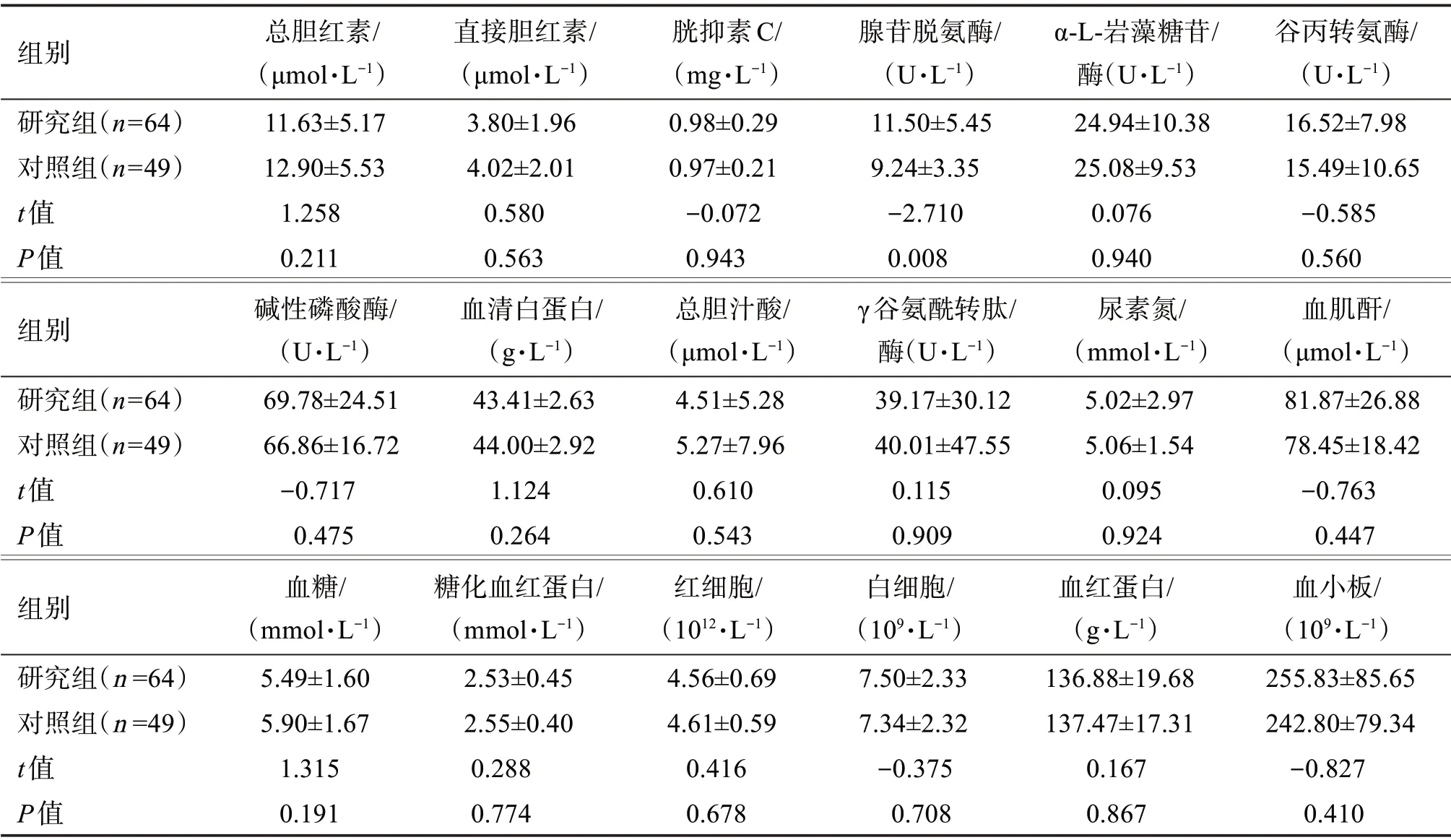
表2 兩組患者術前實驗室檢測數據對比Table 2 Comparison of preoperative data between two groups(x±s,n=113)
2.3.3 圍術期情況比較 由表3可知,食管癌患者的手術方式、手術時間、出血量、輸血量、補液量對術后發生低蛋白血癥均無顯著性影響(P>0.05)。見表3。
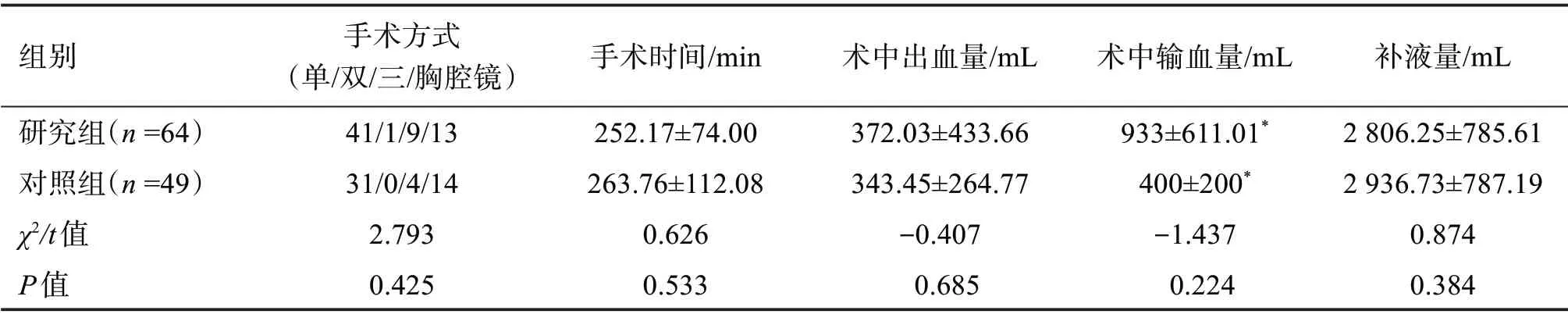
表3 兩組患者圍術期指標比較Table 3 Comparison of perioperative indicators between two groups(x±s)
2.3.4 兩組營養支持比較 由表4可知,兩組患者日均營養熱卡、總營養支持天數、術前營養支持患者數及術前營養天數均無統計學差異(P>0.05)。見表4。

表4 兩組患者營養支持情況Table 4 Comparison of nutritional support between two groups(x±s)
2.4 兩組臨床結局比較
由表5可知,研究組患者的住院費用顯著增加(P<0.05),住院天數差別不顯著。研究組術后感染率(20.31%vs6.12%)和并發癥(42.19%vs16.32%)發生率更高(P<0.05)。見表5。術后感染有肺部感染和傷口感染,研究組分別發生8例和5例,對照組分別發生2例和1例;術后并發癥有吻合口瘺、胸腔積液、呼吸困難、肋骨斷端出血、術后腦梗死、反流、胃創面出血7種,兩組發生例數分別為8、3、1、1、1、0、0例和2、1、0、0、0、1、1例。
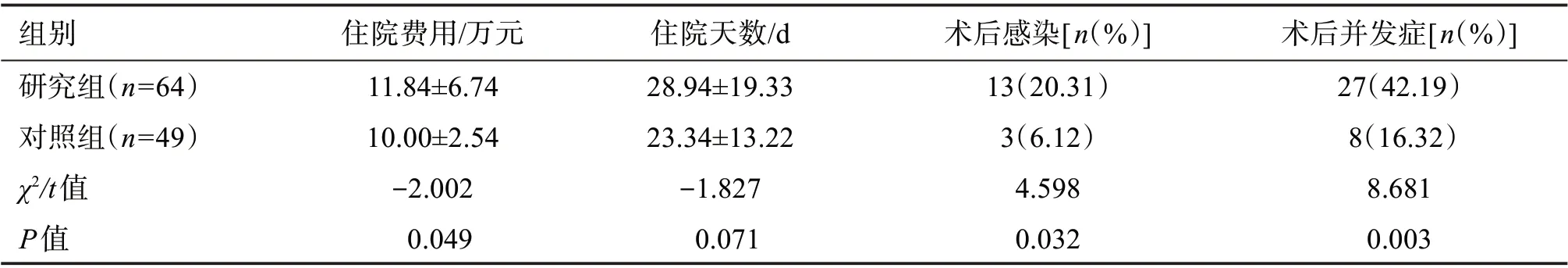
表5 兩組患者臨床結局比較Table 5 Comparison of clinical outcomes between two groups
2.5 人血白蛋白使用分析
113例患者中,研究組和對照組分別有58例(90.63%)和44例(89.80%)補充了人血白蛋白,其中研究組出院時血清Alb較術后有顯著提高(P<0.001),但仍有41例(70.69%)未升至35 g/L以上;對照組仍有34例(77.27%)出院時未恢復至40 g/L以上。對照組出院時Alb較術后低,但差別無統計學意義(P=0.450)。說明外源性補充人血白蛋白(H-Alb)注射液并不能快速糾正食管癌患者術后低蛋白血癥狀態。見表6。
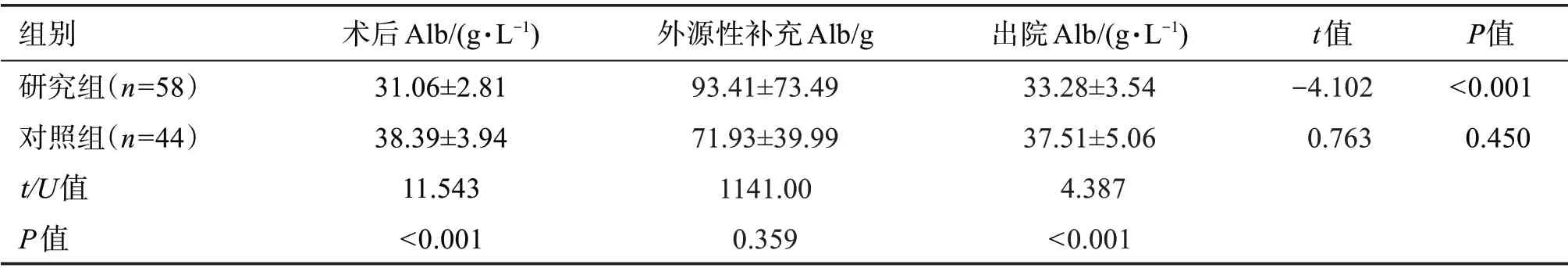
表6 外源性補充人血白蛋白注射液患者血清白蛋白恢復情況Table 6 Recovery of serum albumin in patients after supplementation with human albumin injection(x±s,n=102)
3 討論
3.1 食管癌患者出現術后低蛋白血癥的高危因素分析
本研究發現,食管癌患者術后血清白蛋白濃度較術前平均降低了9.42 g/L,56.64%的患者出現術后低蛋白血癥,說明低蛋白血癥是食管癌患者術后常見現象。究其原因,可能有以下幾個方面[8-9]:①吸收減少:食管癌患者多存在吞咽困難、食欲不振、持續胃腸減壓、術后禁食等導致外源性蛋白質攝入不足。②合成減少:術后機體處于高應激狀態,肝臟合成急性時相蛋白質增多,而血清白蛋白、各種球蛋白等合成急劇減少。③分解增加:術后機體處于高分解狀態,通過加速蛋白質分解來釋放氨基酸獲得能量,造成機體持續的負氮平衡。④丟失增加:食管癌根治術創面大,胸腔滲液增多,導致機體大量血清蛋白質丟失。
由結果可知,研究組患者術前腺苷脫氨酶水平較對照組有顯著性升高,提示患者的肝臟儲備合成功能可能降低;研究組患者失血量更多,直接導致血清白蛋白丟失量大。另外手術應激引起的大量炎癥因子釋放,激活機體炎癥反應,微血管內皮間隙在炎癥介質的作用下開放,致使微血管白蛋白滲漏,產生全身毛細血管滲漏綜合征,部分白蛋白滲漏到組織間隙中。高血壓和糖尿病患者血管內皮損傷,血管通透性增加,當合并食管癌手術創傷,加劇毛細血管內皮細胞損傷,更易引起毛細血管滲漏,從而導致低蛋白血癥[10]。但以上因素由于絕大多數患者術后未監測炎癥因子,本研究并未考察,后續可開展此類研究。
3.2 低蛋白血癥對食管癌術后并發癥的影響
有研究表明,低蛋白血癥被認為與全身術后炎癥反應和預后不良[11]、住院時間長短及病死率密切相關[12]。但2015年發表的一篇綜述[13]卻指出該結論存有爭議,即也有研究顯示這些并發癥與低蛋白血癥無相關性,而與患者的C反應蛋白(CRP)、吸煙、病程、營養不良和低T細胞水平相關。
本研究結果顯示,低蛋白血癥患者術后并發癥如肺部并發癥、傷口感染、吻合口瘺等發生率較高,可能的原因如下:①肺部并發癥:食管癌術后低蛋白血癥患者肌肉和脂肪大量消耗導致肌肉萎縮,呼吸肌萎縮削弱了通氣和換氣功能,易出現肺部并發癥[14]。長期低蛋白可影響肺組織的修復,加重胸、腹水的發生,且由于缺乏必需氨基酸和必需脂肪酸,機體免疫功能低下,發生肺部感染機會增多。有研究顯示,低蛋白血癥是食管癌術后肺部感染的獨立危險因素[15]。本研究得出一致結果,術后研究組(低蛋白血癥)患者的肺部并發癥(肺部感染、胸腔積液、呼吸困難)發生率較對照組高。②傷口感染:蛋白質是促進術后傷口愈合的重要基礎物質。由于營養不良導致蛋白質缺乏,造成傷口愈合延遲,也會導致機體免疫力下降;同時,低蛋白血癥使局部組織水腫,不利于傷口愈合,易造成傷口感染[16]。本研究結果顯示,食管癌術后研究組較對照組切口感染率增加。③吻合口瘺:吻合口瘺是食管癌術后嚴重的并發癥,病死率大于50%[17],發生率約為5.1%~9.2%[17-18]。研究顯示,低蛋白血癥為食管癌術后并發吻合口瘺的獨立危險因素[18-19]。術后低蛋白血癥導致機體修復能力降低,影響吻合口的愈合;同時還能降低機體的抗感染能力,吻合口處易形成感染灶,引起局部的炎癥、水腫。另外,低蛋白血癥時,血漿膠體滲透壓降低,可以引起食管壁水腫,壓迫食管壁靜脈,導致血液回流障礙,嚴重者甚至壓迫食管壁動脈造成吻合口供血不足,不但影響吻合口的愈合還易造成吻合口處缺血壞死而發生吻合口瘺[16]。本研究結果顯示,食管癌術后研究組吻合口瘺的發生率高于對照組。可見,低蛋白血癥更易發生術后并發癥,低白蛋白水平是食管癌預后不良的獨立危險因素[20]。
3.3 外源性補充人血白蛋白的合理性評價
對于術后低蛋白血癥患者,傳統觀點認為,靜脈輸注人血白蛋白可提高或維持血漿膠體滲透壓,減少術后組織水腫,促進傷口愈合,所以臨床上習慣使用人血白蛋白來糾正。但本研究結果顯示,術后補充白蛋白僅僅是提高了白蛋白的數值(P<0.05),提高率僅為29.31%,并不能從根本上改善由于氮供應不足所致各個組織器官蛋白質合成不足的問題。這與早期相關研究結果一致:輸注白蛋白并沒有改善患者原發病的治療效果和減少術后并發癥的發生率,其作用僅僅是提高血清白蛋白的含量這一表觀參數,對于糾正低白蛋白血癥或改善臨床結果均無益處[21-22]。從本研究的結果看,外源性補充白蛋白并未在一定程度上改善患者的病情,降低患者低蛋白血癥的發生率。
2010年美國醫院聯合會(UHC)修訂了《人血白蛋白使用指導原則》(2005版),基于臨床試驗的系統評價顯示,由于腫瘤等原因導致蛋白合成不足、代謝過度等引起的低蛋白血癥,依靠補充人血白蛋白并不能使患者獲益[23]。究其原因,可能是由于外科手術患者術后早期的低蛋白血癥并非全是營養不良或蛋白質分解所導致,根本原因可能是熱卡和氮的攝入不足[24]。而本研究的熱氮比也顯示熱量和氮配比不合理。要改善外科患者術后高分解代謝、負氮平衡和低蛋白血癥,應該從根本上解決營養不良的問題,提供合適的能量和營養底物。研究顯示,對于食管癌術后患者,氨基酸注射液可直接提供給機體必需和非必需氨基酸,靜脈補充氨基酸能有效提高患者血清白蛋白水平,是用于營養控制的有效方法[25]。但需注意,輸注氨基酸需有足夠的熱量支持,避免氨基酸被當作能源物質而消耗。另外,由于白蛋白所含的氨基酸中缺乏如色氨酸和異亮氨酸等人體必需氨基酸,對于白蛋白含量正常的患者再外源性補充白蛋白不僅無益,還可抑制機體自身白蛋白的合成,加速其分解,并可出現循環負荷過重、血鈉增高等副作用[26]。本研究中對照組也有89.80%的患者補充外源性白蛋白,這不僅加重患者經濟負擔,也未使患者獲益。美國大學醫院聯合會(the University Hospital Consortium,UHC)制定的關于“人血白蛋白、非蛋白膠體溶液和晶體溶液的使用指南[27]推薦人血白蛋白僅用于血清白蛋白水平極低(<15 g/L)的危重患者,若血清白蛋白水平在15~20 g/L,應根據患者實際情況制定治療方案。
3.4 本研究的局限性
本研究的局限性包括(1)為回顧性研究,資料收集不全。如患者術前合并癥(高血壓、糖尿病、COPD等慢性基礎病),及術前/術后的PCT、CRP及細胞因子水平等。如最新META分析表明較高的術前C反應蛋白/白蛋白比是食管癌患者的不良預后因素[29];(2)未追蹤并發癥患者的生存率及生活質量;(3)營養支持不規范,包括營養素配比、療程、途徑等;(4)納入患者樣本量偏少,無法再對亞組進行干預研究,如研究組補充和未補充白蛋白的臨床結局對比等。
綜上所述,食管癌患者術后易發生低蛋白血癥,對臨床結局有不良影響,如住院費用顯著增加、術后并發癥和術后感染率更高。術后外源性補充人血白蛋白并不能快速糾正低蛋白血癥。

