基于網(wǎng)絡(luò)藥理學(xué)探討四逆散治療腸易激綜合征的潛在作用機(jī)制
嚴(yán)海冬 1,繆文清 1,張志鵬 2*,蔡延渠
[1.咸寧市中心醫(yī)院,湖北咸寧 437000;2.湖北科技學(xué)院藥學(xué)院,湖北咸寧 437100;3.廣東藥科大學(xué)新藥研發(fā)中心,廣東廣州 510006;4.廣東省教育廳現(xiàn)代中藥重點(diǎn)實(shí)驗(yàn)室,廣東廣州 510006;5.國(guó)家中醫(yī)藥管理局中藥制劑實(shí)驗(yàn)室(三級(jí)),廣東廣州 510006]
腸易激綜合征(irritable bowel syndrome,IBS)是臨床常見的功能性腸胃病,其發(fā)病機(jī)制不明確,可能與精神心理因素、腸道感染、內(nèi)臟高敏性等相關(guān)[1],目前臨床尚無特效治療藥物。依據(jù)其臨床特征,IBS屬于中醫(yī)“泄瀉”“饗泄”“郁癥”范疇,病因主要為外感六淫、七情內(nèi)傷、勞倦過度等[2]。
四逆散出自張仲景的《傷寒論?辨少陰病脈證并治》,由柴胡、白芍、枳實(shí)和甘草組成[3],臨床治療IBS取得良好的治療效果[4]。IBS病機(jī)在于肝氣郁結(jié)、脾胃不和、氣機(jī)郁滯、通降失常、傳導(dǎo)失職。四逆散中柴胡升發(fā)陽氣、疏肝解郁,苦平,為君藥;白芍?jǐn)筷庰B(yǎng)血,為臣藥;柴胡協(xié)同白芍?jǐn)筷幒完帯l達(dá)肝氣,升散而無耗陽傷血;枳實(shí)辛苦酸,理氣解郁、泄熱破結(jié),與柴胡相伍便于陽氣布散,與白芍相伍理氣和血;甘草調(diào)和諸藥。現(xiàn)代藥理學(xué)研究結(jié)果顯示,四逆散具有促進(jìn)胃腸活動(dòng)、抑制胃酸分泌、調(diào)節(jié)免疫系統(tǒng)、抗病毒等藥理作用[5],但缺乏治療IBS的物質(zhì)基礎(chǔ)和作用機(jī)制方面研究。
2007年英國(guó)藥理學(xué)家提出“網(wǎng)絡(luò)藥理學(xué)”概念,“網(wǎng)絡(luò)藥理學(xué)”的整體觀念、系統(tǒng)觀念符合中藥的作用特點(diǎn),因此在中藥的現(xiàn)代化研究中得到廣泛應(yīng)用。鄭洋等[6]利用網(wǎng)絡(luò)藥理學(xué)分析了莪術(shù)的物質(zhì)基礎(chǔ)和可能的作用機(jī)制,李筱楠等[7]分析了“梔子‐川芎”藥對(duì)的抗抑郁作用靶點(diǎn),并通過動(dòng)物實(shí)驗(yàn)進(jìn)行了驗(yàn)證。李娜等[8]應(yīng)用網(wǎng)絡(luò)藥理學(xué)研究?jī)?yōu)化潰結(jié)方治療潰瘍性結(jié)腸炎的作用靶點(diǎn)、代謝物、KEGG信號(hào)通路等,揭示了優(yōu)化潰結(jié)方的分子通路機(jī)理和作用機(jī)制,有助于其臨床療效體系的評(píng)價(jià)。本研究通過網(wǎng)絡(luò)藥理學(xué)方法,篩選四逆散活性成分和潛在作用靶點(diǎn),分析四逆散治療IBS的潛在作用機(jī)制和物質(zhì)基礎(chǔ)。
1 材料和方法
1.1 四逆散活性成分的篩選和收集
在TCMSP平臺(tái),分別以“柴胡”“白芍”“甘草”“枳實(shí)”進(jìn)行檢索,收集上述中藥的物質(zhì)成分,以O(shè)B≥30%和DL≥0.18為截?cái)嘀担Y選適合口服吸收的物質(zhì)成分。在此基礎(chǔ)上,在Drugbank數(shù)據(jù)庫(kù)逐一檢索上述成分,獲得活性物質(zhì)成分的作用靶點(diǎn)[9]。
1.2 IBS疾病靶點(diǎn)的收集
以“irritable bowel syndrome”為關(guān)鍵字,分別通過人類基因組注釋數(shù)據(jù)庫(kù)Genecards、疾病相關(guān)的基因與突變位點(diǎn)數(shù)據(jù)庫(kù)DisGeNET、治療靶標(biāo)數(shù)據(jù)庫(kù)TTD收集IBS相關(guān)的基因靶點(diǎn),數(shù)據(jù)統(tǒng)一為gene symbol后,數(shù)據(jù)去重,建立IBS疾病靶點(diǎn)數(shù)據(jù)庫(kù)[10]。
1.3 四逆散治療IBS相關(guān)靶點(diǎn)的確定
將活性物質(zhì)成分的作用靶點(diǎn)和IBS疾病靶點(diǎn)數(shù)據(jù)輸入同一Excel表格后,采用IF[COUNTIF(B:B,A2)>0,A2,0]公式取交集獲得交集靶點(diǎn),數(shù)據(jù)采用在線繪制韋恩圖平臺(tái)Venny 2.1進(jìn)行可視化。
1.4 四逆散治療IBS蛋白質(zhì)互作網(wǎng)絡(luò)的構(gòu)建
交集靶點(diǎn)上傳至String數(shù)據(jù)庫(kù),設(shè)置物種為“Homo sapiens”,進(jìn)行在線蛋白質(zhì)‐蛋白質(zhì)的相互作用分析,導(dǎo)出數(shù)據(jù)資料,采用Cytoscape3.7.2 進(jìn)行數(shù)據(jù)的可視化分析。以中位degree值為截?cái)嘀担Y選核心靶點(diǎn),構(gòu)建四逆散治療IBS的核心靶點(diǎn)PPI網(wǎng)絡(luò)[11]。
1.5 GO富集分析和KEGG富集分析
將四逆散治療IBS的核心靶點(diǎn)導(dǎo)入至Metascape數(shù)據(jù)庫(kù)平臺(tái)GO富集分析和KEGG通路分析。以P<0.01為條件篩選,得到四逆散治療IBS的核心靶點(diǎn)的GO富集分析和KEGG通路分析,獲得的KEGG通路采用KEGGmapper進(jìn)行可視化[12]。
1.6 活性成分和核心靶點(diǎn)的分子對(duì)接驗(yàn)證
隨機(jī)抽取4對(duì)活性成分和核心靶點(diǎn)進(jìn)行Swiss DOCK分子對(duì)接,驗(yàn)證藥物與靶點(diǎn)之間的連接性能。
2 結(jié)果
2.1 四逆散的主要活性成分
經(jīng)過篩選,從“柴胡”“白芍”“甘草”和“枳實(shí)”中總計(jì)篩選獲得140種活性化合物,其中柴胡活性成分17種,白芍活性成分13種,甘草活性成分92種,枳實(shí)活性成分20種。部分重要活性成分見表1。
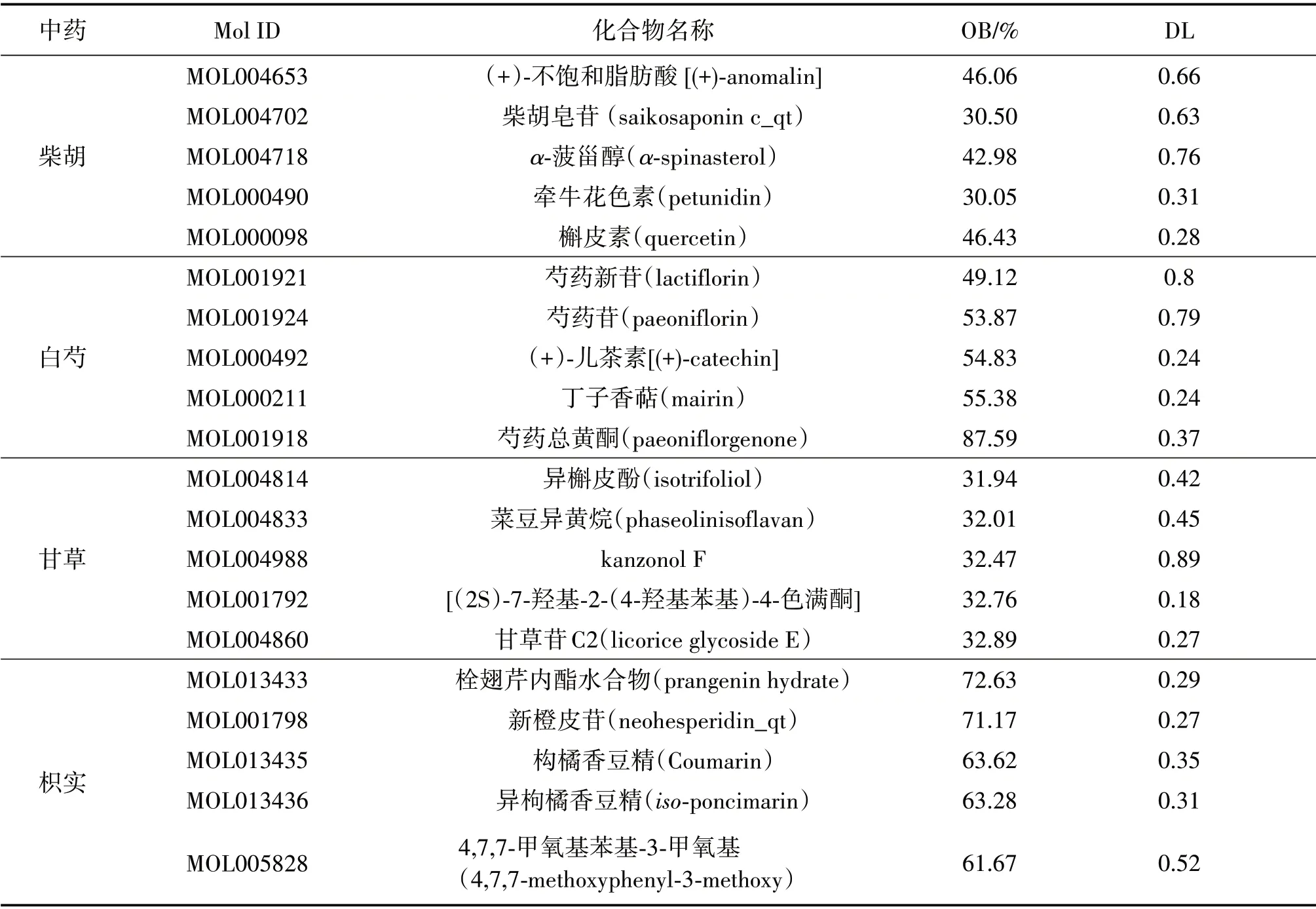
表1 四逆散的主要活性成分Table 1 The main active components of Sini Powder
2.2 IBS的疾病治療靶點(diǎn)和四逆散活性作用靶點(diǎn)交集
“柴胡”對(duì)應(yīng)疾病靶點(diǎn)342個(gè),“白芍”對(duì)應(yīng)疾病靶點(diǎn)122個(gè),“甘草”對(duì)應(yīng)疾病靶點(diǎn)1 704個(gè),“枳實(shí)”對(duì)應(yīng)疾病靶點(diǎn)298個(gè),去重后獲得269個(gè)疾病靶點(diǎn)。對(duì)疾病數(shù)據(jù)庫(kù)以“irritable bowel syndrome”為關(guān)鍵詞 進(jìn) 行 檢 索,分 別 從“disgenet”“drugbank”“gene‐Cards”“OMIM”和“TTD”數(shù)據(jù)庫(kù)獲得429、139、1 000、485、27個(gè)IBS疾病治療靶點(diǎn),去重后獲得1 774個(gè)靶點(diǎn)。以IBS疾病靶點(diǎn)和四逆散活性成分靶點(diǎn)取交集,獲得251個(gè)交集靶點(diǎn)。見圖1。
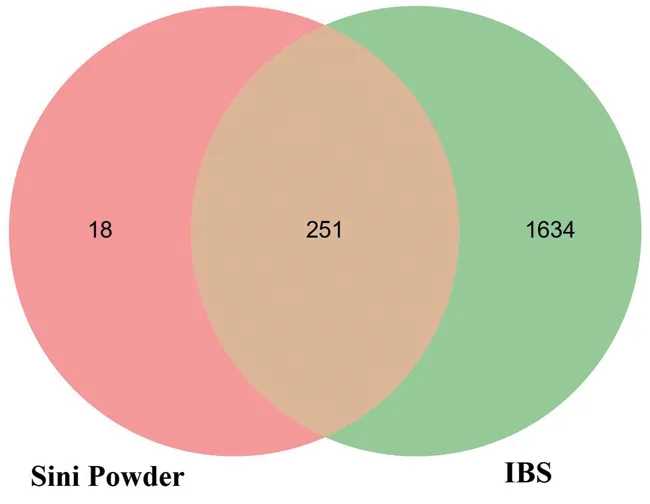
圖1 IBS疾病治療靶點(diǎn)和四逆散活性作用靶點(diǎn)交集Figure 1 The intersection of therapeutic targets of IBS and active targets of Sini Powder
將四逆散活性成分?jǐn)?shù)據(jù)和相應(yīng)疾病靶點(diǎn)數(shù)據(jù)導(dǎo)入Cytoscape軟件,構(gòu)建“藥物‐有效成分‐靶點(diǎn)”網(wǎng)絡(luò)。通過網(wǎng)絡(luò)degree分析發(fā)現(xiàn),degree值排名前10的成分分別為白花前胡丁素、槲皮素、谷甾醇、山柰酚、木犀草素、7?甲氧基?2?甲基異黃酮、苯甲酰芍藥苷、芒柄花黃素、柚皮素、異鼠李素(degree分別為152、150、63、63、58、42、42、40、38、38),可能是其中發(fā)揮藥效的主要物質(zhì)成分。見圖2。
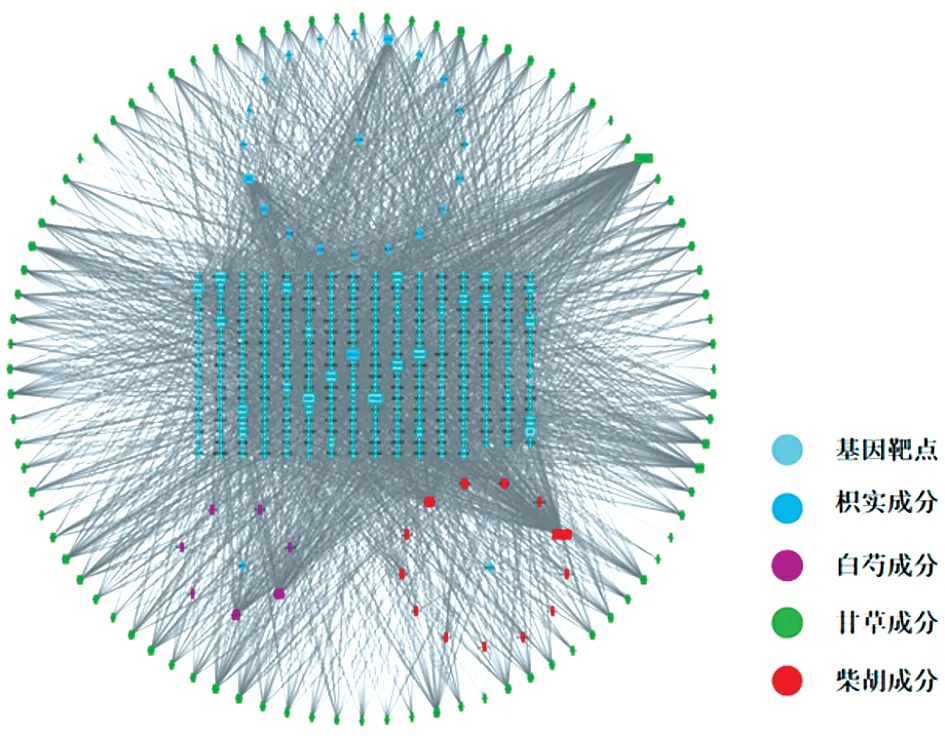
圖2 四逆散的“藥物‐有效成分‐靶點(diǎn)”網(wǎng)絡(luò)Figure 2 The"drug?active component?target"network of Si‐ni Powder
2.3 四逆散治療IBS關(guān)鍵靶點(diǎn)的PPI網(wǎng)絡(luò)
將251個(gè)交集靶點(diǎn)導(dǎo)入String數(shù)據(jù)庫(kù),得到四逆散治療IBS的交集靶點(diǎn)PPI網(wǎng)絡(luò),PPI網(wǎng)絡(luò)中顯示節(jié)點(diǎn)251個(gè),邊8 946條,平均節(jié)點(diǎn)度值(degree)為36.51,見圖3。顏色越深,節(jié)點(diǎn)度值越大,發(fā)揮的生物學(xué)功能越明顯。以degree數(shù)值>75為截點(diǎn),選取核心疾病靶點(diǎn)構(gòu)建四逆散治療IBS的核心靶點(diǎn)PPI網(wǎng)絡(luò),AKT1、MAPK1、MMP2、EGF、TP53、CASP3、EGFR、MMP9、TNF、IL6具有最高的degree值,是四逆散治療IBS的關(guān)鍵潛在治療靶點(diǎn)。見圖4。
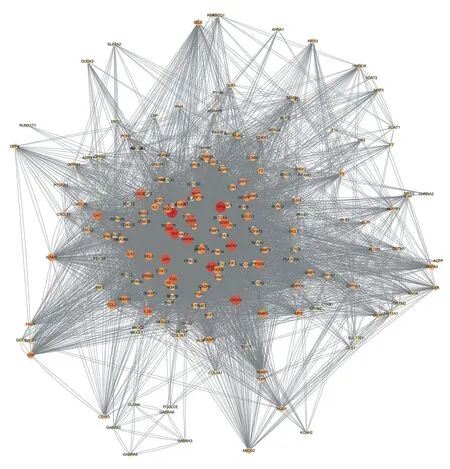
圖3 四逆散治療IBS的交集靶點(diǎn)PPI網(wǎng)絡(luò)Figure 3 PPI network of intersection target of Sini Powder in the treatment of IBS

圖4 四逆散治療IBS的核心靶點(diǎn)PPI網(wǎng)絡(luò)Figure 4 PPI network of core target of Sini Powder in the treatment of IBS
2.4 四逆散治療IBS核心靶點(diǎn)的GO富集分析和KEGG富集分析
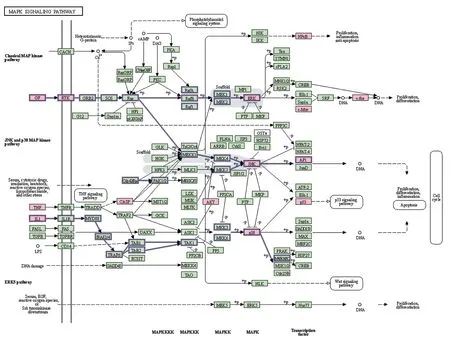
圖7 四逆散治療IBS的信號(hào)通路Figure 7 Signal pathway of Sini Powder in the treatment of IBS
以P<0.01為截?cái)嘀担瑢?duì)四逆散治療IBS的核心靶點(diǎn)進(jìn)行GO富集分析(見圖5)和KEGG富集分析(見圖6~7)。結(jié)果顯示:GO biological processes主要涉及對(duì)刺激的反應(yīng)、細(xì)胞增殖、生殖過程、運(yùn)動(dòng)、免疫系統(tǒng)過程、生物黏附、多細(xì)胞過程、細(xì)胞過程、行為和解毒等。GO cellular components主要涉及ficolin?1顆粒腔、分泌顆粒腔、區(qū)域膜、髓鞘、細(xì)胞膜穴樣內(nèi)陷、溶酶體、樹突、質(zhì)膜蛋白復(fù)合物和早期內(nèi)體等。GO molecular functions主要涉及一氧化氮合酶調(diào)節(jié)活性、細(xì)胞因子受體結(jié)合、蛋白激酶結(jié)合、生長(zhǎng)因子受體結(jié)合、激活轉(zhuǎn)錄因子結(jié)合、受體配體活性、受體調(diào)節(jié)活性、組蛋白脫乙酰基酶結(jié)合、RNA聚合酶Ⅱ基礎(chǔ)轉(zhuǎn)錄因子結(jié)合和轉(zhuǎn)錄輔激活子結(jié)合。KEGG富集分析涉及到的信號(hào)通路包括癌癥信號(hào)通路、IL?17信號(hào)通路、腫瘤壞死因子信號(hào)通路、Toll樣受體信號(hào)通路、c型凝集素受體信號(hào)通路、NOD樣受體信號(hào)通路、細(xì)胞凋亡、幽門螺桿菌感染中的上皮細(xì)胞信號(hào)轉(zhuǎn)導(dǎo)、cAMP信號(hào)通路、PI3K?Akt信號(hào)通路、MAPK信號(hào)通路、NF?κB信號(hào)通路、炎癥性腸病、催產(chǎn)素信號(hào)通路等。
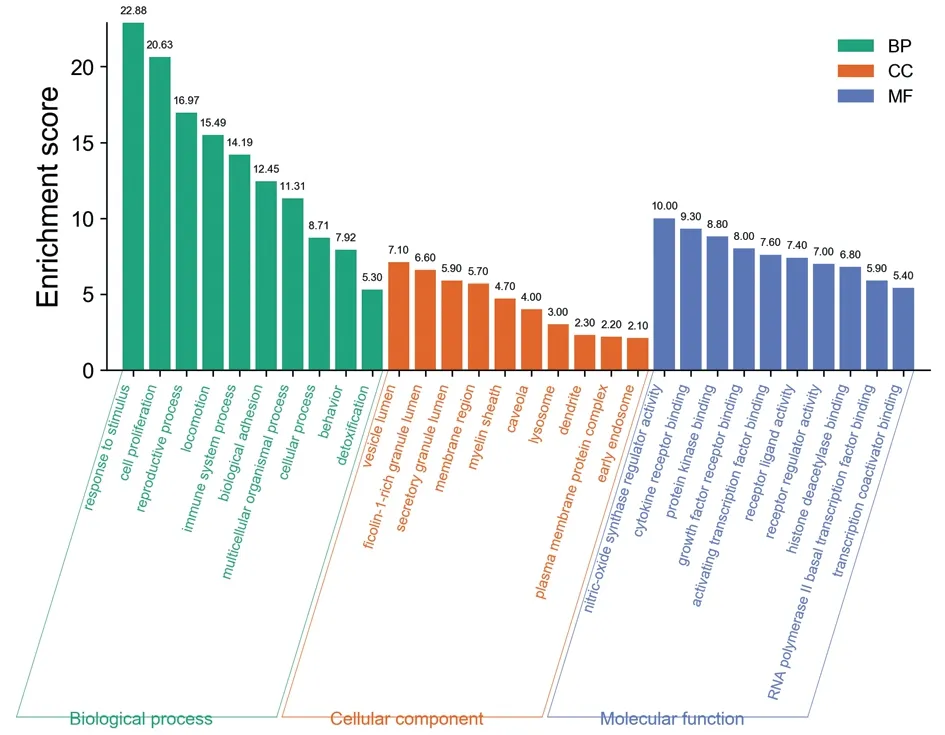
圖5 四逆散治療IBS的核心靶點(diǎn)GO富集分析圖Figure 5 Go enrichment analysis of the core target of Sini Powder in the treatment of IBS
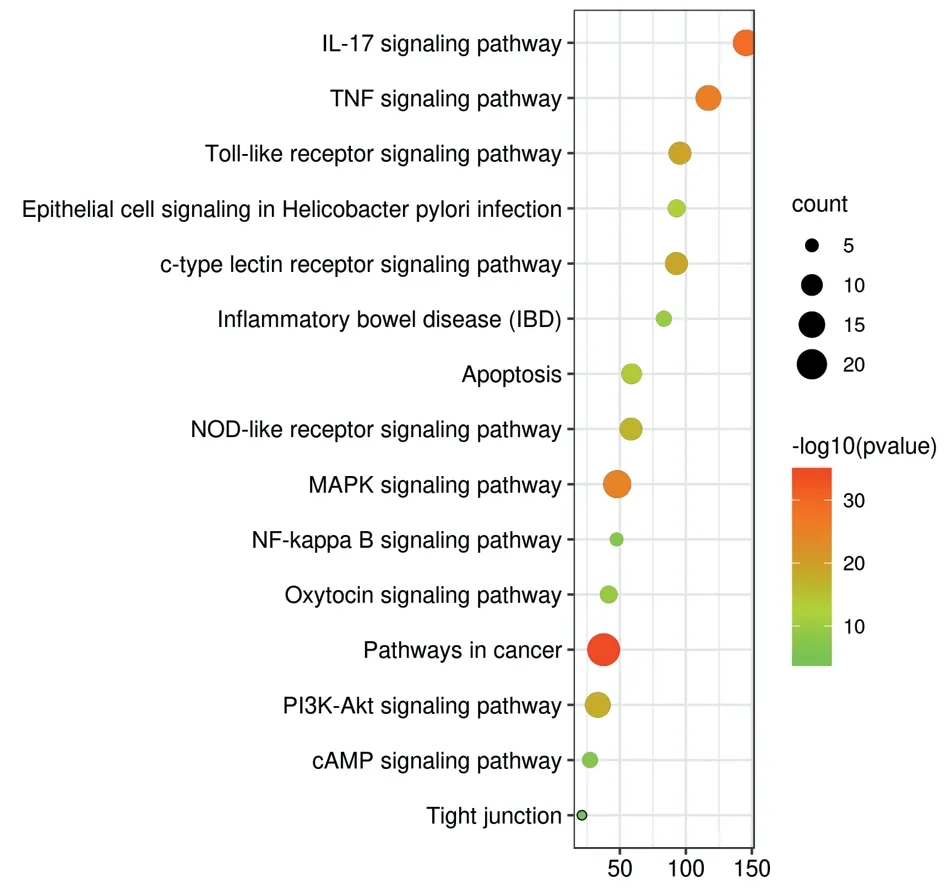
圖6 四逆散治療IBS的核心靶點(diǎn)KEGG富集分析圖Figure 6 KEGG enrichment analysis of core target of Sini Powder in treating of IBS
2.5 活性成分與核心靶點(diǎn)的分子對(duì)接驗(yàn)證
隨機(jī)選取活性成分與核心靶點(diǎn)進(jìn)行分子對(duì)接驗(yàn)證,圖8結(jié)果顯示,山柰酚與AKT1、槲皮素與AKT1、槲皮素與MAPK1、谷甾醇與CASP3的Esti‐matedΔG均小于?5 kJ/mol,表明活性成分與核心靶點(diǎn)具有良好的結(jié)合性能。
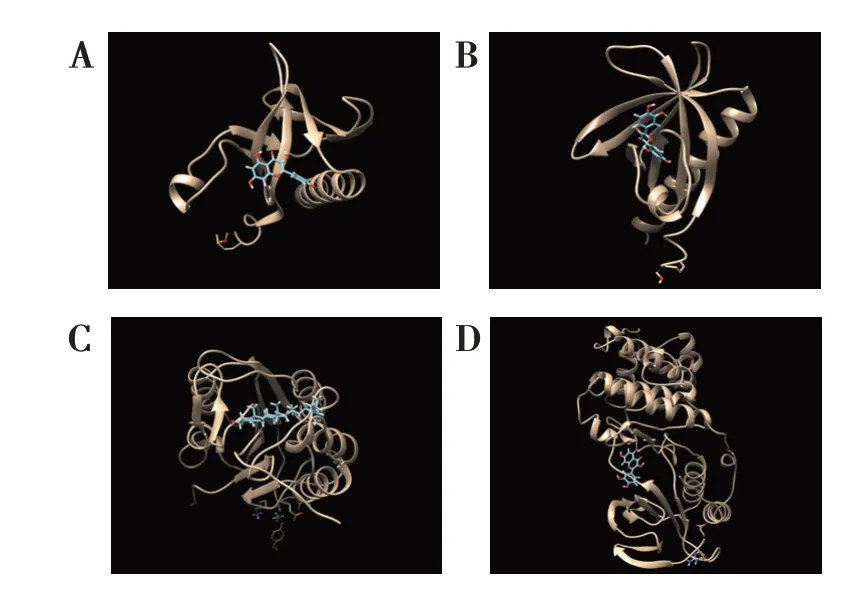
圖8 四逆散活性成分與核心靶點(diǎn)的分子對(duì)接驗(yàn)證結(jié)果Figure 8 Molecular docking verification of active compo‐nents and core targets of Sini Powder
3 討論
本研究利用TCMSP平臺(tái),對(duì)四逆散的4味中藥進(jìn)行了檢索,并以O(shè)B≥30%和DL≥0.18為截?cái)嘀担Y選適合口服吸收的物質(zhì)成分。四逆散中含有活性成分140個(gè),潛在作用靶點(diǎn)作用靶點(diǎn)269個(gè),與IBS疾病靶點(diǎn)取交集,獲得251個(gè)交集靶點(diǎn)。在四逆散的“藥物‐有效成分‐靶點(diǎn)”網(wǎng)絡(luò)中,通過network分析,degree值排名前10的成分分別為白花前胡丁素、槲皮素、谷甾醇、山柰酚、木犀草素、7?甲氧基?2?甲基異黃酮、苯甲酰芍藥苷、芒柄花黃素、柚皮素、異鼠李素。degree值越大,越有可能是四逆散發(fā)揮藥效的有效成分。
槲皮素是自然界廣泛存在的一類黃酮醇類化合物,具有抗菌、抗感染、抗過敏、降血脂等作用。已有研究在動(dòng)物模型上證實(shí)了槲皮素的抗IBS作用,如黃泓軻等[13]發(fā)現(xiàn)槲皮素與5?氨基水楊酸協(xié)同治療、改善感染后腸易激綜合征大鼠癥狀體征;而在體外實(shí)驗(yàn)中,槲皮素可通過加強(qiáng)緊密連接蛋白的結(jié)構(gòu)和功能改善腸上皮屏障功能[14]。谷甾醇可通過抑制炎癥因子和相關(guān)酶的過表達(dá)來緩解急性結(jié)腸炎[15];木犀草素可通過干預(yù)IRE1/XBP1通路調(diào)節(jié)炎癥性腸病小鼠內(nèi)質(zhì)網(wǎng)應(yīng)激穩(wěn)態(tài),對(duì)于腸道具有保護(hù)作用[16]。白花前胡丁素是一種香豆素類化合物,本研究中具有最高degree值,但目前尚未見白花前胡丁素在IBS應(yīng)用中的相關(guān)報(bào)道,推測(cè)它可能是一種潛在的IBS治療藥物,值得在下一步研究中加以驗(yàn)證。
AKT1、MAPK1、MMP2、EGF、TP53、CASP3、EG‐FR、MMP9、TNF?α、IL6是四逆散治療IBS的關(guān)鍵潛在治療靶點(diǎn)。EGF、EGFR可以通過調(diào)控ZO?1和Occludin蛋白來調(diào)節(jié)屏障的通透性[17],ERK/MAPK通路可以通過調(diào)控緊密連接蛋白水平來增強(qiáng)腸道的屏障功能[18],四逆湯或可通過增強(qiáng)腸黏膜緊密連接蛋白的表達(dá)促進(jìn)腸道組織的修復(fù)。TNF?α是一種廣譜的炎性細(xì)胞因子,也是腸道黏膜屏障損傷的重要啟動(dòng)因子,一方面可改變腸道緊密連接蛋白的表達(dá)和分布,另一方面可通過誘導(dǎo)炎癥因子IL?6和IL?1β的產(chǎn)生,損傷黏膜組織[19]。
IBS在臨床上雖然不歸屬炎性疾病,但是90%IBS患者的腸壁炎性細(xì)胞增多,腸道炎癥可破壞腸道上皮的屏障功能,導(dǎo)致IBS的發(fā)生。本研究通過KEGG富集分析發(fā)現(xiàn),四逆散作用通路中包含多個(gè)炎癥信號(hào)通路,如IL?17信號(hào)通路在炎癥反應(yīng)和炎癥維持過程中起著非常重要的作用,在IBS的發(fā)生發(fā)展過程中,IL?17出現(xiàn)先下降后升高的動(dòng)態(tài)改變[20];郭文濤等在研究中發(fā)現(xiàn)腹瀉型腸易激綜合征患者腸黏膜中的TLR?2和TLR?4的表達(dá)升高,TLR的表達(dá)水平與腸道擬桿菌門和梭菌屬存在一定的關(guān)聯(lián)[21];同時(shí),TLR4可以激活NF?κB信號(hào)通路介導(dǎo)內(nèi)臟超敏反應(yīng)的發(fā)生,TLR4/MyD88/NF?κB導(dǎo)致炎性因子的產(chǎn)生也是IBS產(chǎn)生的重要因素[22]。
綜上所述,本研究通過網(wǎng)絡(luò)藥理學(xué)方法探討了四逆散治療腸易激綜合征的潛在物質(zhì)基礎(chǔ)和作用機(jī)制,其活性成分主要通過調(diào)節(jié)炎癥信號(hào)通路和腸道運(yùn)動(dòng)發(fā)揮治療IBS作用,為下一步研究的開展提供了理論基礎(chǔ)。

