胃惡性黑色素瘤一例
程中華 馮 珍 唐 楠 荊佳晨
1 病例資料
患者,女性,67歲,工人。因“腹痛、黑便3周”于2020年4月8日入院。患者入院1周前曾因解黑便就診于九江市都昌縣人民醫(yī)院,當(dāng)?shù)匦形哥R檢查示賁門下緣胃體可見巨大不規(guī)則菜花樣隆起,病理示胃體惡性腫瘤,淋巴瘤可能性較大,不排除低分化癌,免疫組織化學(xué)檢測結(jié)果示CK(-)、CAM5.2(-)、CD3(-)、CD79a(-)、約45% Ki-67(+),診斷胃體惡性腫瘤伴潰瘍,考慮淋巴瘤,建議加做相關(guān)抗體及基因檢測輔助診斷。患者既往有10年高血壓病史,最高可達(dá)165/105 mmHg(1 mmHg=0.133 kPa),平時口服氯沙坦鉀片,血壓控制尚可。患者6年前行膽囊切除術(shù)。否認(rèn)藥物過敏史,否認(rèn)遺傳病、腫瘤家族史,無吸煙、飲酒嗜好。查體示:皮膚、球結(jié)膜稍蒼白,全身皮膚表面無異常黑痣等改變,未觸及腫大淋巴結(jié),心肺聽診無特殊,腹軟,上腹輕壓痛,無反跳痛、未捫及包塊,雙下肢不腫。
患者入院后行上腹部增強CT檢查,結(jié)果示:(1)胃底及賁門處胃壁腫塊,周圍脂肪間歇模糊伴多發(fā)腫大壞死淋巴結(jié);(2)膽囊切除術(shù)后所見,肝內(nèi)外膽管擴張;(3)肝右葉小囊腫,右腎小囊腫。見圖1。PET-CT示:(1)胃癌,胃周多發(fā)淋巴結(jié)轉(zhuǎn)移;(2)兩側(cè)肺門淋巴結(jié)炎性增生,左附件囊腫;(3)左胸壁、下腹壁炎性結(jié)節(jié)可能,左后頸肌肉生理性攝取可能。4月15號再次復(fù)查胃鏡示:胃體近賁門口見一直徑5 cm新生物,表面壞死,伴污垢及自發(fā)性出血(見圖2)。復(fù)旦大學(xué)附屬中山醫(yī)院病理科會診意見:胃體惡性腫瘤,目前免疫組織化學(xué)檢測結(jié)果未提示B細(xì)胞淋巴瘤、神經(jīng)內(nèi)分泌腫瘤等來源,建議手術(shù)切除后進一步明確類型。免疫組織化學(xué)檢測結(jié)果示CK7(-)、CD20(-)、CD5(-)、Bcl-2(-)、約30% Bcl-6(+)、CD10(+)、約70% Ki-67(+)、Syn(-)、CD56(-)、部分淋巴細(xì)胞CD79a(+)、EMA(-)、CD30(-)、原位雜交EBER(-)。患者轉(zhuǎn)入本院外科后于5月5日行手術(shù)治療,術(shù)中所見胃體小彎側(cè)近賁門2 cm處一浸潤性腫塊,約5.0×5.5 cm,質(zhì)地硬,邊界欠清,未侵犯漿膜層,無周圍組織浸潤,肝臟、結(jié)腸、小腸未見占位,腫瘤周圍淋巴結(jié)明顯腫大,脾門部淋巴結(jié)融合成團,約3.0×3.6 cm,行胃癌根治術(shù)+全胃切除食管空腸Y型吻合術(shù)。全胃切除標(biāo)本病理示:惡性腫瘤,光鏡下可見腫瘤細(xì)胞呈圓形或不規(guī)則形,包漿豐富,嗜酸,核偏位,細(xì)胞異型性顯著,可見散在分布的黑色素顆粒(見圖3A),形態(tài)學(xué)及免疫表型符合轉(zhuǎn)移性惡性黑色素瘤(MM),腫物大小約5.5×5.0×2.0 cm,潰瘍型,伴大片壞死,浸潤深肌層外纖維結(jié)締組織;胃小彎處融合結(jié)節(jié)示MM,大小約5×3×2 cm;脈管內(nèi)見癌栓,未見明確神經(jīng)侵犯。食管二次切緣病理示:胃兩切緣及大網(wǎng)膜未見腫瘤組織;胃小彎淋巴結(jié)未見腫瘤轉(zhuǎn)移,胃小彎另見MM結(jié)節(jié)1枚,直徑約0.5 cm;胃大彎淋巴結(jié)未見腫瘤轉(zhuǎn)移。免疫組織化學(xué)檢測結(jié)果示HMB-45(+)、SOX-10(+)、S-100(+)、Melan-A(+)、約80% Ki-67(+)、MPO(-)、Vimentin(+)、核旁點狀A(yù)E1/AE3(+)、PD-1[克隆系:ZM43,腫瘤細(xì)胞(-),間質(zhì)淋巴細(xì)胞(-)],PD-L1[克隆系:SP142,約10%腫瘤細(xì)胞(+),約5%間質(zhì)淋巴細(xì)胞(+)]。見圖3B~D。術(shù)后再次經(jīng)臨床全面細(xì)致檢查未發(fā)現(xiàn)皮膚、肛周黏膜等處黑痣樣病變或結(jié)節(jié),追問病史發(fā)現(xiàn)患者曾在2016年因右側(cè)上眼瞼贅生物于當(dāng)?shù)蒯t(yī)院行手術(shù)治療,術(shù)后病理示非典型痣。借原眼部手術(shù)病理片于華山醫(yī)院進一步就診,明確診斷為眼部黑色素瘤。經(jīng)電話隨訪,本例患者術(shù)后口服伊馬替尼行靶向治療,9月復(fù)查腹部增強CT示肝、肺轉(zhuǎn)移,患者于10月死亡。
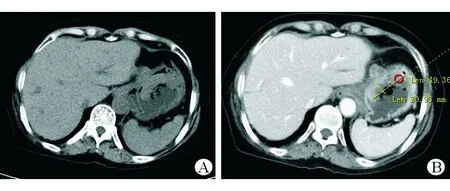
圖1 上腹部增強CT檢查結(jié)果 A 平掃期胃底及賁門處胃壁可見大小約49×21 cm不規(guī)則軟組織腫塊影凸向胃腔 B 增強后可見不均勻強化
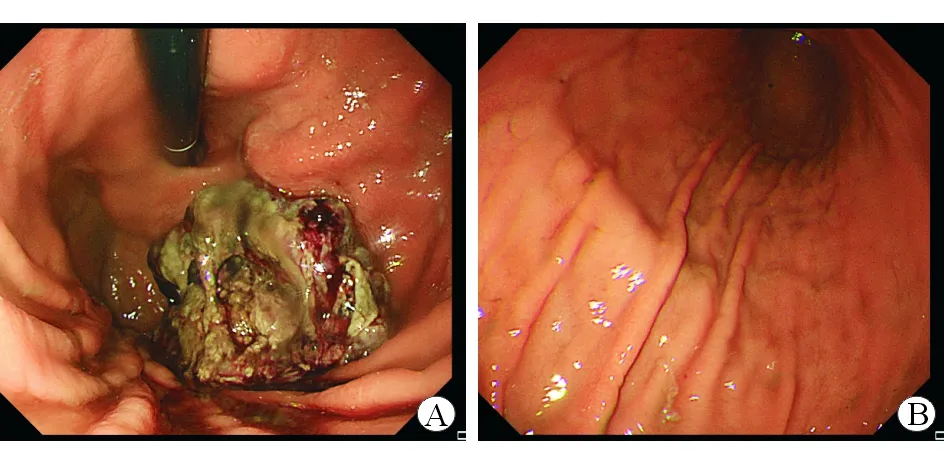
圖2 胃鏡檢查結(jié)果 A 胃體前壁近賁門口見一直徑約5 cm 新生物 B 胃體其余部分及胃竇黏膜光滑
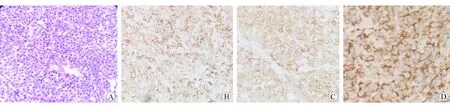
圖3 手術(shù)大體標(biāo)本 A 手術(shù)大體標(biāo)本可見散在黑色素顆粒 H-E染色 ×100 B HMB-45表達(dá)陽性 免疫組織化學(xué)染色 ×400 C Melan-A表達(dá)陽性 免疫組織化學(xué)染色 ×400 D Vimentin表達(dá)陽性 免疫組織化學(xué)染色 ×400
2 討論
MM是發(fā)生于黑色素細(xì)胞的高度惡性腫瘤,容易發(fā)生血行轉(zhuǎn)移和淋巴結(jié)轉(zhuǎn)移,臨床以皮膚和眼部MM多見,發(fā)病危險因素包括遺傳、環(huán)境、社會經(jīng)濟和職業(yè)因素,以及外傷、年齡等。年齡越大,發(fā)病率越高。長時間紫外線過度照射被認(rèn)為是最重要的原因[1]。MM一般經(jīng)淋巴管和血管轉(zhuǎn)移,多轉(zhuǎn)移至肺、肝、腦、骨等器官,眼和直腸來源的黑色素瘤容易發(fā)生肝轉(zhuǎn)移[2],胃腸道轉(zhuǎn)移少見,而小腸因血運豐富成為MM胃腸道轉(zhuǎn)移的常見部位(67%),其次為結(jié)腸(9%)、胃(6%)和直腸(2%)。胃腸道MM罕見,且多為轉(zhuǎn)移性,原發(fā)性少見,胃腸道MM患者中4%~12%不能發(fā)現(xiàn)原發(fā)灶[3]。
胃腸道MM臨床表現(xiàn)無特異性,早期可無癥狀,中晚期可出現(xiàn)腹脹、腹痛、反酸、噯氣、惡心、嘔吐、消瘦、貧血等不典型癥狀,甚至合并出血、穿孔、腸梗阻等并發(fā)癥。因胃腸道MM缺乏特異性的臨床表現(xiàn),且醫(yī)生對此病缺乏認(rèn)識,極易被漏診、誤診,詳細(xì)的病史詢問和仔細(xì)的體格檢查有助于提高胃腸道MM的診斷率。目前消化內(nèi)鏡檢查是發(fā)現(xiàn)胃腸道MM的常用方法。胃腸道MM內(nèi)鏡下的表現(xiàn)無特異性。近10年來的報道指出,胃腸道MM內(nèi)鏡下多表現(xiàn)為多發(fā)黑色結(jié)節(jié)樣隆起性病變,單發(fā)病變非常少見;亦有少部分患者表現(xiàn)為隆起潰瘍性病變,易誤診為胃癌或淋巴瘤。組織病理學(xué)檢查是胃腸道MM診斷和分期的金標(biāo)準(zhǔn),常規(guī)病理H-E染色切片中是否含有黑色素顆粒是診斷MM的指標(biāo)之一,但40% MM的腫瘤細(xì)胞及間質(zhì)內(nèi)不含黑色素顆粒。本例患者入院時未提及右眼非典型痣手術(shù)史,體格檢查結(jié)果示全身皮膚未見明顯黑痣及腫塊,2次胃鏡檢查結(jié)果均顯示胃體隆起性腫塊,表面有壞死及自發(fā)性出血,但鏡下均未見明顯黑色素顆粒存在,給最初診斷帶來困難。免疫組織化學(xué)檢測主要用于鑒別診斷,S-100、HMB-45、Melan-A、SOX-10及Vimtentin 陽性有助于鑒別胃腸道MM與惡性淋巴瘤或其他胃腸道惡性腫瘤。研究發(fā)現(xiàn),S-100蛋白免疫組織化學(xué)染色用于診斷MM的敏感度較高,但特異度較低;HMB-45免疫組織化學(xué)染色用于診斷MM的特異度較高,與S-100聯(lián)合應(yīng)用可提高對MM的診斷率[4]。Vimentin是黑色素細(xì)胞和黑色素瘤細(xì)胞所特有的,在鑒別無色素性黑色素瘤與上皮或者神經(jīng)源性腫瘤方面具有重要意義,也可用于黑色素瘤的輔助診斷。本例患者手術(shù)后標(biāo)本的免疫組織化學(xué)染色結(jié)果顯示S-100、SOX-10、HMB-45、Melan-A和Vimentin均呈陽性表達(dá),診斷為胃腸道MM。原發(fā)性胃腸道MM較罕見,需進一步尋找原發(fā)病灶。經(jīng)詳細(xì)詢問病史,高度質(zhì)疑患者3年前右側(cè)上眼瞼手術(shù)的非典型痣病理診斷,對該病理切片再次行免疫組織化學(xué)檢查,最終明確診斷為眼部黑色素瘤術(shù)后胃腸道轉(zhuǎn)移。
胃腸道MM轉(zhuǎn)移早、預(yù)后差,早期發(fā)現(xiàn)、早期治療是改善預(yù)后的關(guān)鍵。早期以手術(shù)治療為主要治療方法,手術(shù)方式為擴大切除。Ahn等[5]發(fā)現(xiàn)手術(shù)可延長原發(fā)性及繼發(fā)性胃腸道MM患者的生存期。Shenoy等[6]認(rèn)為姑息性手術(shù)可明顯緩解胃腸道轉(zhuǎn)移性MM患者癥狀。對于中晚期患者,術(shù)后可聯(lián)合化學(xué)治療、免疫治療及靶向治療。干擾素α+達(dá)卡巴嗪常作為黏膜MM的經(jīng)典術(shù)后輔助化學(xué)治療方案。靶向治療和免疫治療是目前治療惡性MM的研究熱點。常用的靶向藥物包括維羅非尼和伊馬替尼。免疫治療的發(fā)展迅速,目前國內(nèi)已有2種PD-1單抗獲批,分別為帕博利株單抗和特瑞普利單抗,均可用于治療接受全身系統(tǒng)治療失敗的、不可切除或轉(zhuǎn)移性黏膜MM患者[7]。
綜上所述,胃腸道MM臨床上較為罕見,惡性程度高,病情進展快,患者生存期短,但因缺乏特異性的臨床表現(xiàn),容易誤診、漏診。臨床醫(yī)生需提高對該病的認(rèn)識,早診斷、早治療尤為重要。

