康益膠囊對大鼠腦缺血再灌注神經功能損傷及氧化應激的影響
丁培娜,崔應麟,王雪可,陳冠廷
(1.河南中醫藥大學第二臨床醫學院,河南 鄭州 450000;2.河南省中醫院,河南 鄭州 450002)
缺血性腦血管疾病已經成為嚴重威脅人類健康的疾病之一。對于腦血管疾病的治療,及早恢復缺血腦組織血流灌注、改善局部供氧,是降低其病死率、致殘率的重要手段之一。但在恢復血流灌注后, 則可能出現更為嚴重的腦組織結構及功能的損害, 稱為缺血/再灌注損傷(ischemia/reperfusion, I/R)[1]。因此,腦缺血再灌注損傷后的診療,受到越來越多的重視,而中藥制劑在此方面,獲得了顯著的療效[2]。腦梗死屬中風的范疇,究其病因病機,主要是以虛為本,以風、痰、瘀、火為標,其中又以氣虛致脈道不利、瘀血阻絡為多見[3]。康益膠囊是在前人基礎上,結合多年臨床經驗,針對中風病因病機特點,篩選的有效藥物組成,具有益氣活血、通絡祛濁之功效。
本實驗采取線栓法制備大鼠大腦中動脈急性腦梗死模型,主要觀察康益膠囊對腦缺血再灌注損傷后大鼠神經功能缺損癥狀、腦組織氧化應激水平的影響,探討康益膠囊的作用機制。
1 材料
1.1 實驗動物
健康Wistar雄性大鼠80只,體質量(210±20)g,購自北京維通利華實驗動物技術有限公司,生產合格證號:SCXK(京)2016-0011。大鼠分籠喂養,在室溫20~25 ℃、相對濕度40%~60%、自然光照情況下給予充足的水和食物,自然晝夜循環。所有動物實驗經河南省中醫院(河南中醫藥大學第二附屬醫院)倫理委員會批準后進行。
1.2 儀器與試劑
水合氯醛(北京索萊寶科技有限公司, 批號:T8590);CPA324S型電子天平 (北京賽多利斯儀器系統有限公司); H1650型離心機 (湖南湘儀實驗室儀器開發有限公司);5417型低溫高速離心機(Eppendorf公司);脫水機(德國 LEICA AS P300);谷胱甘肽過氧化物酶 (GSH-Px)、過氧化氫酶(CAT)、 過氧化物酶(LDH)(南京建成生物工程研究所)。
1.3 藥物
康益膠囊(由河南省中醫院自制)是依據急性中風的病因病機特點,由紅參、丹參、三七、土鱉蟲、水蛭、大黃按照1∶3∶1∶2∶1∶0.6的比例研末配制而成,具有益氣活血、通絡祛濁之功效;銀杏葉片(揚子江藥業集團有限公司,國藥準字Z20027949,9.6 mg∶2.4 mg/片)。兩種藥物均配置成混懸液,4 ℃保存備用。
2 方法
2.1 模型制備
參考Longa的實驗方法[4],略作改良后制備大鼠大腦中動脈阻塞 (middle cerebral artery occlusion,MCAO)模型。所有大鼠禁食12 h,自由飲水。10%水合氯醛(35 mg/kg)腹腔注射麻醉大鼠。麻醉后的大鼠,仰臥位固定在手術板上,頸正中線開口,逐層分離,暴露右側頸總動脈(CCA)、頸內動脈(ICA)和頸外動脈(ECA),避免刺激迷走神經。在CCA近心端和ECA近端、緊鄰分叉處各置一根絲線并結扎,用動脈夾夾閉頸內動脈,在CCA上距ICA、CCA分叉4 mm地方剪一“V”形切口,將栓線圓鈍端沿切口插入ICA,緩緩向前推進18~20 mm,稍遇阻力即停止前進。結扎,固定栓線和防止出血,逐層縫合傷口,栓線末端留1 cm于皮外。2 h后拔出線拴,形成再灌注。假手術組的大鼠不插入線拴,只分離血管。
按照Zea-Longa′s五級標準評分法,術后2 h對大鼠進行神經行為癥狀評分。評分方法見表1。評分在1~3分者為造模成功,評分為0分、4分及生命體征不平穩的動物剔除。

表1 Zea Longa's五級標準評分法
2.2 分組與給藥
將大鼠隨機分為假手術組、模型組、康益膠囊低劑量組和康益膠囊中劑量組、康益膠囊高劑量組和銀杏葉組,共6組,每組12只。結合前期的預實驗結果,各組給藥劑量按照人和大鼠體表面積換算,人與大鼠的換算系數為0.018[5],康益膠囊低劑量組給予75 mg/kg混懸液,康益膠囊中劑量組給予150 mg/kg混懸液,康益膠囊高劑量組給予300 mg/kg混懸液,陽性藥物組給予銀杏葉片150 mg/kg混懸液,模型組、假手術組則灌胃相同體積的溶劑對照。再灌注后24 h開始灌胃給藥,每日1次,連續灌胃14 d。
2.3 評價指標
2.3.1 一般情況觀察
實驗期間每天觀察并記錄大鼠活動、飲食情況、精神狀況、體質量變化等。
2.3.2 神經行為恢復評分
采用改良神經功能評分(mNSS)[6]評估康益膠囊對腦缺血再灌注大鼠神經功能恢復的影響。于術后24 h、第3天、第7天、第14天分別評分,每次固定在同一時間點完成。mNSS總分為18分,神經功能損傷程度隨分值增大而加重,其中0~6分為輕度損傷,7~12分為中度損傷,13~18分為重度損傷。
2.3.3 大鼠腦組織中的含水量
第14天評分后,每組大鼠隨機選取6只,麻醉后斷頭取腦,剝離腦組織,生理鹽水沖洗,嗅球、低位腦干及小腦去除,用濾紙吸干水分后稱重(腦濕重)。置于100 ℃的烘箱中烘烤 24 h后再稱重(腦干重)[7]。
腦組織含水量(%)=(腦濕重-腦干重)/腦濕重×100%
2.3.4 大鼠腦組織中CAT、GSH-Px活性和LDH含量的檢測
將各組剩余6只大鼠,處死后斷頭取腦,冰盒內快速分離大腦,取部分右側大腦半球,準確稱重后,按照1∶9的比例加入預冷至4 ℃的生理鹽水,在冰上研磨制備成10%組織勻漿,然后在4 ℃下3 000 r/min離心10 min,取上清液。分別按試劑盒說明書測定CAT、GSH-Px的活性和LDH含量。
2.4 統計學方法
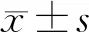
3 結果
3.1 一般情況
康益膠囊各劑量組灌胃期間,大鼠活動、精神、飲食、體質量與余組大鼠無明顯差異。
3.2 大鼠神經功能評分(mNSS)比較
假手術組沒有神經功能缺損;灌胃前,其余各組間神經功能評分無明顯差異(P>0.05)。灌胃14 d后,模型組神經功能缺損改善不明顯;康益膠囊低、中、高劑量組和銀杏葉組神經功能缺損評分較模型組均顯著降低,差異有統計學意義(P<0.05,P<0.01);高劑量組較銀杏葉組改善更明顯(P<0.01)。結果見表2。
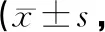
表2 各組大鼠神經功能mNSS評分比較分)
3.3 大鼠腦組織含水量的比較
模型組大鼠的腦組織含水量均明顯升高,與假手術組比較有顯著性差異(P<0.01);康益膠囊低、中、高劑量組較模型組腦含水量明顯降低 (P<0.05,P<0.01);高劑量組與銀杏葉組比較無統計學意義(P>0.05)。結果見表3。
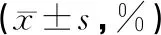
表3 各組大鼠腦缺血后腦組織含水量的比較
3.4 大鼠腦缺血再灌注腦組織CAT、GSH-Px活性的比較
與假手術組相比,模型組CAT、GSH-Px的活性顯著下降 (P<0.01);康益膠囊中劑量組及高劑量組CAT活性明顯高于模型組 (P<0.05) ;康益膠囊各組及銀杏葉組GSH-Px活性明顯高于模型組 (P<0.05,P<0.01)。結果見表4。
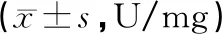
表4 各組大鼠腦缺血再灌注腦組織CAT、GSH-Px活性的比較
3.5 大鼠腦缺血再灌注腦組織中LDH水平的比較
與假手術組相比,模型組LDH的含有量顯著增加(P<0.01);康益膠囊各組及銀杏葉組LDH的含量明顯低于模型組(P<0.05,P<0.01)。結果見表5。
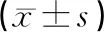
表5 各組大鼠腦缺血再灌注腦組織LDH含量的比較
4 討論
腦梗死后局部腦組織缺血和缺氧,進一步引起病灶處組織軟化、壞死,導致神經功能缺損。及時恢復血流灌注是目前最佳治療方案。研究顯示[8],再灌注治療可拯救即將死亡的細胞,在功能上恢復可逆性損傷,但大量自由基的生成、氧化應激的激活等仍會持續損傷腦組織進而導致神經功能缺損癥狀。在健康狀態下,腦內存在抗氧化系統,使腦內的氧化作用與抗氧化作用處于平衡狀態,保證神經系統功能正常,其中的酶抗氧化系統,包括有CAT、GSH-Px等,它們在自由基的生成、清除及過氧化鏈式反應的中止等方面發揮著重要作用。腦缺血再灌注損傷時,自由基就會大量生成,同時自由基清除酶活性也會下降,導致自由基清除率降低,自由基大量蓄積,體內抗氧化能力紊亂,損害腦神經功能[9-11]。大量自由基作用于脂質發生過氧化反應,致使蛋白質和核酸等生物大分子氧化損壞,蛋白質氧化引起蛋白質羥基的生成[12-13]。谷胱甘肽過氧化物酶(GSH-Px)是人體內的自由基清除酶、水溶性過氧化物分解酶,可以起神經保護的作用,其活性能夠反映機體自由基清除的能力[14];過氧化氫酶(CAT) 是具有還原活性的抗氧化酶,能減輕脂質過氧化損傷,其活性可以反應氧化應激反應的激活狀態[15];腦細胞在急性缺氧狀態會釋放大量乳酸脫氫酶(LDH),LDH可作為反映神經元損傷情況的指標[16]。本實驗研究表明,大鼠在腦缺血再灌注后,神經功能缺損癥狀明顯,腦水腫顯著,腦組織中自由基清除酶如CAT、GSH-Px的活性明顯降低,LDH含量明顯升高,腦損傷明顯。
本實驗研究結果顯示,康益膠囊可明顯促進大鼠腦缺血再灌注后神經功能缺損癥狀的恢復;顯著降低腦組織含水量;提高MCAO 后大鼠腦組織中CAT、GSH-Px等的活性,明顯降低LDH的含量。可見,康益膠囊具有明顯的修復神經功能缺損、降腦水腫和抗氧化的作用,對大鼠缺血性損傷起到修復作用。

