煤吸附硫化氫混合氣體的試驗研究*
孫維吉,馬楊奇,姜涵文,秦 冰,梁 冰
(遼寧工程技術大學 力學與工程學院,遼寧 阜新 123000)
0 引言
近年來,我國中西部部分煤礦(如鐵新礦、烏東礦、東山礦等)在開采時均出現硫化氫(H2S)大量涌出的情況。H2S是礦井有毒有害氣體之一,當開采富含H2S煤層時,H2S大量涌出會對工作面作業人員造成極大的危害,甚至危及生命。同時煤層H2S作為賦存在煤多孔介質中的氣體,自身的吸附特性及其對甲烷等其他氣體的吸附影響規律較復雜。因此,研究煤對H2S的吸附特性,對揭示煤層中H2S賦存狀態、煤層H2S防治有重要意義。
煤對氣體的吸附一般屬于物理吸附。因H2S具有毒性,故研究煤對H2S的吸附不宜采用100%高純硫化氫開展試驗,需要利用混合氣體吸附理論設計針對多種氣體的吸附研究,國內外學者對此開展大量研究:薛景戰等[1]通過用Langmuir和D-A 2種模型對H2S吸附試驗數據進行擬合,初步分析H2S的吸附特征,然而對煤吸附H2S規律并不明確;楊宏民等[2]將多組分混合氣體吸附解吸試驗分為競爭吸附和置換吸附2類,并認為煤對混合氣體的吸附與吸附過程的先后順序無關,只與吸附的濃度比例(分壓比)和平衡壓力等條件有關;吳迪等[3]利用具有溫度調控功能的吸附試驗裝置,研究不同溫度條件下煤對CH4/CO2二元混合氣體的吸附規律,發現在CH4/CO2二元混合氣體吸附體系中,CO2吸附占據主導地位,煤對CO2的吸附能力大于對CH4的吸附能力;高莎莎等[4]探究CH4/CO2二元混合氣體在煤體中的解吸規律,提出CH4和CO2之間存在著競爭吸附和置換解吸的作用。有關煤對混合氣體的研究主要集中于CO2,N2,CH4組成的多元混合氣體的吸附方法,以及通過注入CO2或N2提高煤層氣采收率的技術上[5-10],但煤對H2S的吸附研究成果較少,且對煤吸附含H2S混合氣體研究也較少。梁冰等[11]通過量子化學方法模擬計算出煤吸附H2S的吸附能力;何也等[12]通過進行煤壓汞試驗和平衡水條件下的等溫吸附試驗,得出煤變質程度越高,煤對H2S的吸附越有利,并且壓力能夠促進煤對H2S的吸附;吳家浩[13]研究溫度、煤粒徑等因素對H2S吸附的影響,認為煤吸附H2S受多重因素影響。
綜上所述,目前關于煤對CH4,CO2,N2等單一氣體及其組成的多元混合氣體的吸附解吸規律已得到廣泛而深入的研究,但因H2S劇毒性制約,煤對H2S的吸附研究無法從測試方法、技術、結果等方面有所突破。故本文采用由H2S/He,H2S/N2組成的二元混合氣體分別開展等溫吸附試驗,利用分壓測試方法計算不同壓力條件下煤對H2S的吸附量,進而得到煤對H2S及混合氣體的吸附規律。
1 H2S混合氣體吸附分壓測試原理
煤對H2S的吸附規律,是將H2S和其他氣體組成混合氣體,通過測試煤對混合氣體及其他單一氣體的吸附規律,間接得出煤對H2S的吸附規律。煤對混合氣體中某一組分的吸附量由該氣體組分與混合氣體的濃度比決定,由Amagat提出的分體積定律[14]可知混合氣體濃度比等于分壓比,一般通過氣體組分分壓比值計算煤對混合氣體中某一組分的吸附量。故通過分別測量煤對H2S/N2混合氣體和N2的吸附量,間接得出煤對H2S的吸附量。確定H2S/N2混合氣體中H2S和N2的濃度比即可得到H2S和N2的分壓比,如式(1)所示:
P1∶P2=(P·M)∶(P·Q)=M∶Q=CN2∶CH2S
(1)
式中:CN2為H2S/N2混合氣體中N2的濃度,mol/L;CH2S為H2S/N2混合氣體中H2S的濃度,mol/L;P1為N2的分壓值,MPa;P2為H2S的分壓值,MPa;P為H2S/N2混合氣體壓力,MPa;M為N2的分壓比,%;Q為H2S的分壓比,%。
由分壓比可求出H2S和N2的分壓值,如式(2)~(3)所示:
P1=P·M
(2)
P2=P·Q
(3)
將N2的分壓代入Langmuir吸附方程,可求出H2S/N2混合氣體中N2的吸附量,如式(4)所示:
(4)
式中:a為在試驗溫度下,單位質量固體的表面飽和吸附氣體時,氣體的吸附量,m3/t;b為Langmuir吸附常數,MPa-1,不同溫度下吸附常數不同;XN2為H2S/N2混合氣體中N2的吸附量,m3/t。
分別測得煤對H2S/N2混合氣體、N2的吸附量Xsum,XN2,將混合氣體吸附量Xsum減去組分N2的吸附量XN2,可求得H2S/N2混合氣體中H2S的吸附量,如式(5)所示:
XH2S=Xsum-XN2
(5)
式中:XH2S為H2S/N2混合氣體中H2S的吸附量,m3/t;Xsum為H2S/N2混合氣體的總吸附量m3/t。
2 H2S混合氣體等溫吸附試驗
2.1 試驗樣品
試驗煤樣取自山西保利鐵新煤礦9#煤層。9#煤層平均厚度1.28 m,原煤灰分平均值為13.03%,硫含量平均值為2.89%,屬高硫煤。在新暴露煤壁采集并對所取樣品進行真空封裝處理,以防止其氧化變質。將所取煤樣在實驗室粉碎并篩分出60目~80目的煤顆粒,使用烘干箱在105 ℃條件下烘8 h,確保煤樣質量恒重。
2.2 試驗儀器
吸附試驗采用美國康塔克默公司生產的高壓吸附儀(型號:i-SorbHP),該裝置包括氣源、氣體增壓裝置、加熱包、真空泵、高壓吸附裝置等。試驗壓力范圍為0.005~20 MPa,試驗溫度范圍為20~673 K,管路保溫精確度可達±0.01 ℃,適用于多種氣體吸附分析;硫化氫等腐蝕氣體最大允許濃度1%。試驗系統結構如圖1所示。
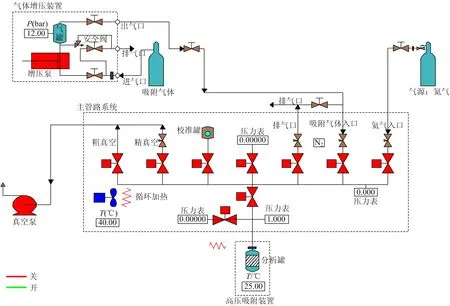
圖1 試驗系統結構
2.3 試驗方案
研究煤對H2S及H2S混合氣體的吸附規律,分別由H2S/He和H2S/N2組成的混合氣體作為吸附介質開展吸附試驗。吸附試驗根據《煤的高壓等溫吸附試驗方法》(GB/T 19560—2008)[15]進行。具體方案如下:
1)采用H2S濃度為48×10-6mol/L的H2S/He二元混合氣體,開展40,50,60 ℃條件下等溫吸附試驗,研究H2S吸附規律。
2)采用H2S濃度為200×10-6mol/L的H2S/N2二元混合氣體,開展40,50,60 ℃條件下等溫吸附試驗,研究H2S/N2混合氣體吸附規律。
3)對比煤對混合氣體吸附后H2S和N2吸附量變化,分析H2S,N2對煤吸附混合氣體的影響。
3 試驗結果及分析
3.1 H2S/He混合氣體等溫吸附規律
利用H2S/He混合氣體為吸附介質開展吸附試驗,由于煤對He不吸附,不需要考慮He與H2S之間發生競爭吸附,測試得到的吸附曲線即為H2S吸附曲線,如圖2所示。由圖2可知,煤對H2S的吸附量隨壓力升高而增加,隨溫度升高而降低,溫度對煤吸附H2S影響較大。吉布斯自由能函數如式(6)所示:
ΔG=ΔH-TΔS
(6)
式中:ΔG為自由能變化量,J/mol;ΔH為系統焓的變化量,J/mol;T為熱力學溫度,K;ΔS為熵的變化量,J/(mol·K)。
煤吸附氣體是自發過程,即ΔG<0;自由度較高氣體分子在被吸附到煤表面后自由度降低,系統的熵減少,即ΔS<0;要滿足式(6)成立,則ΔH必小于0。即吸附為放熱過程,表明溫度升高不利于煤吸附H2S。
環境溫度分別為40,50,60 ℃時得到的Langmuir等溫吸附模型參數見表1,不同溫度下煤對H2S的吸附常數a不同,40,50,60℃時吸附常數a分別為4.505,3.709,0.893 m3/t。圖2及表1結果均表明煤對硫化氫吸附符合Langmuir吸附,可以用Langmuir等溫吸附模型表征。

圖2 H2S吸附曲線

表1 不同溫度下煤吸附H2S擬合結果
3.2 煤吸附H2S或N2單一氣體規律分析
在煤吸附H2S試驗后,開展40,50,60 ℃條件下煤吸附N2試驗,以分析煤對2種單一氣體吸附的差異性。40,50,60 ℃條件下煤吸附N2和H2S的吸附試驗結果如圖3所示。由圖3可知,等溫條件下2種氣體吸附量均隨平衡壓力增加而增大;煤吸附N2和H2S的吸附曲線斜率不同,表明吸附平衡壓力對煤吸附2種氣體影響效果不同,相同條件下增加相同平衡壓力,煤吸附N2增量大于煤吸附H2S增量。

圖3 不同溫度煤吸附H2S,N2的吸附曲線
3.3 H2S/N2混合氣體等溫吸附規律
通過前述試驗研究及已有文獻可知,H2S和N2吸附曲線均符合Langmuir吸附模型,將H2S,N22種氣體以一定的濃度比混合組成混合氣體開展吸附試驗,分析其吸附特性和吸附能力。40,50,60 ℃時N2及H2S/N2混合氣體的等溫吸附曲線如圖4所示。進一步獲得不同溫度下煤吸附N2、H2S/N2的Langmuir吸附模型及吸附常數值,見表2~3。由表2~3可知,相同溫度條件下,H2S/N2混合氣體的吸附曲線可用Langmuir吸附模型表征,且擬合度較高。

表2 不同溫度下煤吸附N2擬合結果
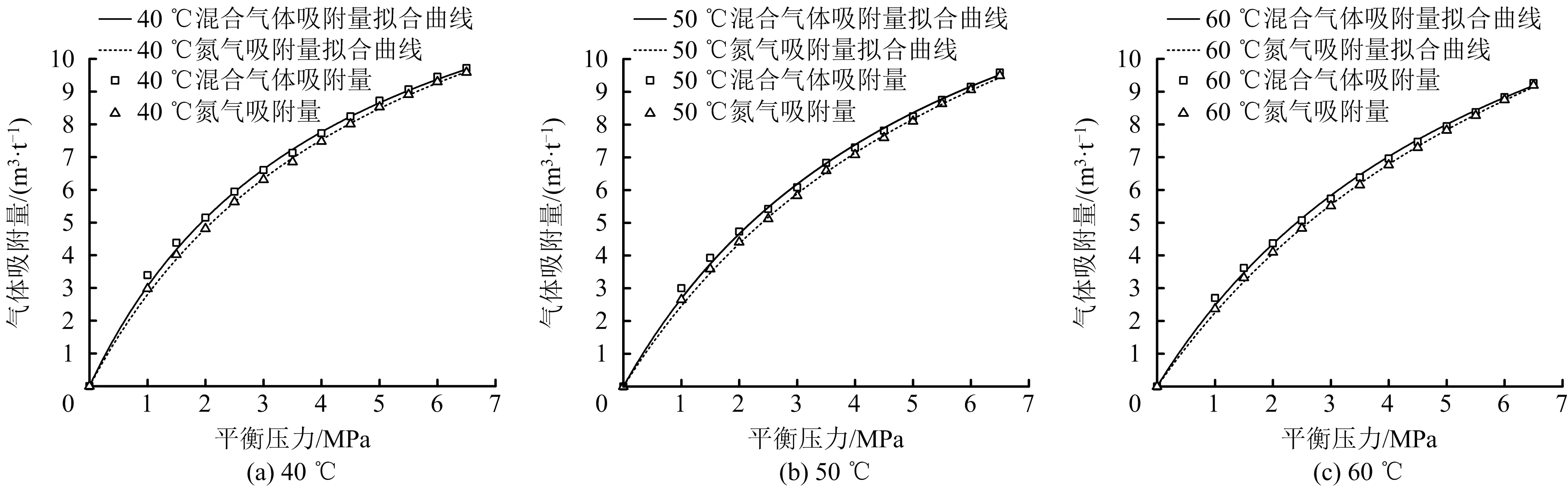
圖4 不同溫度條件下N2及H2S/N2混合氣體等溫吸附曲線
在相同溫度及吸附壓力條件下,H2S/N2混合氣體吸附量高于N2吸附量,其原因是吸附N2時,N2分子并未占據煤表面的全部吸附空位,即煤表面吸附空位覆蓋率并未達到100%,而煤吸附混合氣體時,N2分子和H2S分子會吸附于不同的煤表面吸附空位,即混合氣體分子覆蓋率高于單一N2分子覆蓋率,所以混合氣體吸附量高于單一N2吸附量。

表3 不同溫度下煤吸附H2S/N2擬合結果
煤對N2,H2S的吸附是放熱的動態平衡過程,提高吸附溫度會使吸附平衡向脫附的方向移動,導致吸附量降低;另外,煤對氣體吸附有時間效應,溫度升高會使吸附氣體分子活性增強,吸附氣體停留在煤孔隙表面的時間減少,從而降低吸附量。
在同一平衡壓力點處,將H2S/N2混合氣體吸附量與N2吸附量相減,可計算煤對混合氣體中H2S吸附量。根據質量守恒定律可以計算平衡壓力下二元氣體的總吸附量,可由吸附相中各組分的摩爾分數求出各組分的吸附量。煤吸附H2S/N2混合氣體時H2S的吸附規律如圖5所示。由圖5可知,隨著吸附壓力增加,混合氣體中H2S吸附量降低,煤樣對N2的吸附能力大于H2S。H2S和N2間存在競爭吸附,N2競爭吸附能力優于H2S。從微觀角度看,隨著吸附壓力增大,各組分吸附氣體的濃度也同比增加,濃度占比高的氣體分子進入煤表面空隙的數量增多,與煤表面空位的碰撞率增高,故發生吸附的氣體量增多。
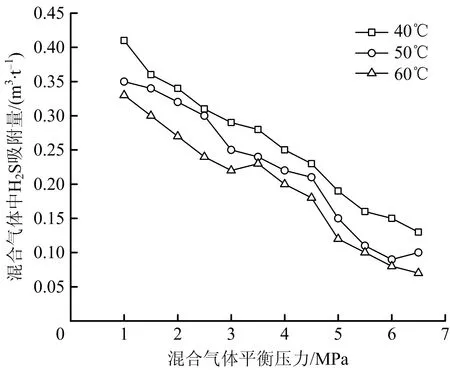
圖5 混合氣體吸附中的硫化氫吸附規律
3.4 煤對H2S和N2競爭吸附機理
由熱力學理論可知,同一種氣體的熱運動劇烈程度與氣體壓力、溫度有關[7]。氣體溫度一定時,氣體壓力升高,氣體分子之間碰撞頻率[16]增加,促使氣體與煤表面碰撞頻率增加,煤對氣體的吸附量增加;氣體壓力一定時,溫度升高,氣體分子碰撞頻率降低,吸附量相應減少。對于N2/H2S混合氣體吸,附氣體碰撞頻率除了與溫度、壓力有關外,還與相對分子質量有關,當吸附壓力、溫度一定時,N2相對分子質量小于H2S,N2分子碰撞頻率大于H2S,N2更容易吸附在煤表面。
4 結論
1)將低濃度H2S和He按一定比例組成混合氣體開展煤吸附H2S試驗,在試驗安全的前提下獲得煤吸附H2S等溫吸附曲線,煤吸附H2S等溫吸附曲線可用Langmuir模型表征。
2)煤吸附N2和H2S的能力不同,相同條件下,隨著吸附壓力的增加,煤吸附N2的量更多。隨著吸附壓力增大,各組分吸附氣體的濃度也同比增加,濃度占比高的氣體分子進入煤表面空隙的數量增多,與煤表面空位碰撞率增高,吸附量增多。
3)煤吸附H2S/N2混合氣體時,煤對H2S/N2混合氣體的吸附量大于煤對N2的吸附量。煤吸附氣體能力大小不僅與吸附壓力、溫度有關,還與氣體物理化學參數及表面吸附位有關。
4)H2S和N2間存在競爭吸附,隨著吸附平衡壓力增加,混合氣體中H2S吸附量降低,煤樣對N2的吸附能力大于H2S,N2競爭吸附能力優于H2S。

