淺談如何從化學(xué)試題中提取有效信息
邊華然



【摘要】高中化學(xué)教學(xué),重點(diǎn)培養(yǎng)學(xué)生獲取信息和處理信息的能力。尤其近年來(lái)化學(xué)考試題題干閱讀量越來(lái)越大,如何快速、準(zhǔn)確的從所給的信息中獲取有效信息并進(jìn)行有效整合是提高解題準(zhǔn)確率和效率的主要保障。
【關(guān)鍵詞】文字信息 實(shí)驗(yàn)裝置圖形? 化工流程
化學(xué)試題中的信息主要有三種呈現(xiàn)形式:文字信息、實(shí)驗(yàn)裝置圖形信息和化工流程信息。“獲取和解讀信息,提取和整合有效信息”是理綜考試中化學(xué)試題中的核心要求。然而,有時(shí)解題時(shí)題干信息不是很明確,而是在細(xì)微處描述讓學(xué)生容易忽視,因此,有效信息的提取和整合要全面,要把文字、圖形和圖表有效結(jié)合從而達(dá)到快速、準(zhǔn)確答題的目的。
一、文字信息的有效提取
文字信息是最基本的信息模式,化學(xué)試題中,對(duì)題干提示信息,文字性材料中要排除與中心問(wèn)題無(wú)關(guān)或產(chǎn)生干擾的信息,由表及里,依據(jù)問(wèn)題中心詞去粗取精獲取有效信息并進(jìn)行整合,從而達(dá)到快速、準(zhǔn)確有效解題的目的。
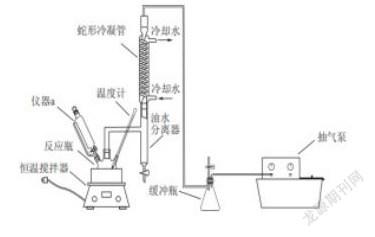
例如:(節(jié)選)過(guò)氧乙酸(CH3COOOH)是一種常用的消毒劑,易溶于水、易揮發(fā)、見(jiàn)光或受熱易分解。其制備原理為:△H<0,同時(shí)利用乙酸丁酯與水形成共沸物(沸點(diǎn)90.7℃)及時(shí)分離出水,以提高產(chǎn)率。實(shí)驗(yàn)裝置如圖。
(1)過(guò)氧乙酸保存時(shí)應(yīng)注意___________(填標(biāo)號(hào))。
A.避光? B.低溫? C.密閉? D.隔絕空氣
(2)反應(yīng)體系采用減壓的目的是______________________________。
題干信息:“過(guò)氧乙酸易溶于水、易揮發(fā)、見(jiàn)光或受熱易分解”,說(shuō)明了過(guò)氧乙酸的溶解度,沸點(diǎn)低,不穩(wěn)定的性質(zhì),所以保存時(shí),應(yīng)該低溫遮光密封;壓強(qiáng)越大,沸點(diǎn)越高;反之,要降低共沸物的沸點(diǎn),可以減小壓強(qiáng),故第2小題答案為:減壓可以降低共沸物的沸點(diǎn),防止溫度過(guò)高,過(guò)氧乙酸分解;
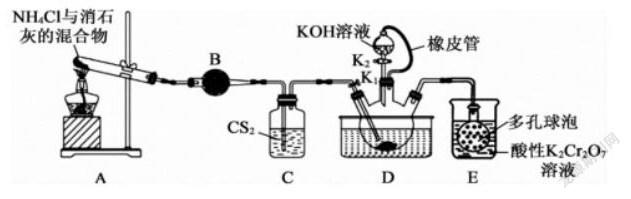
又如:硫氰化鉀(KSCN)俗稱(chēng)玫瑰紅酸鉀,是一種用途廣泛的化學(xué)藥品。實(shí)驗(yàn)室用如下裝置進(jìn)行制取:
已知:①CS2不溶于水,密度比水的大;②NH3不溶于CS2;③三頸燒瓶?jī)?nèi)盛放有CS2、水和催化劑。回答下列問(wèn)題:
(1)制備流程中:
①裝置C的主要作用是___。三頸燒瓶的下層CS2液體必須浸沒(méi)導(dǎo)氣管口,主要原因是___。
②裝置D中發(fā)生反應(yīng)CS2+3NH3NH4SCN+NH4HS,該反應(yīng)比較緩慢,反應(yīng)至CS2消失。
已知條件中,因NH3不溶于CS2,故C的作用為觀(guān)察氨氣逸出的速率,從而控制裝置A的加熱溫度(或觀(guān)察產(chǎn)生氣泡的數(shù)量,控制加熱的溫度);已知NH3不溶于CS2,CS2不溶于水,密度比水的大,則導(dǎo)出氨氣的導(dǎo)管口應(yīng)浸沒(méi)在CS2液面以下,防止發(fā)生倒吸、或使氨氣和二硫化碳充分接觸;
二、實(shí)驗(yàn)裝置圖有效信息的獲取與整合
化學(xué)是以實(shí)驗(yàn)為基礎(chǔ)的自然科學(xué),高考中實(shí)驗(yàn)題要求考生聯(lián)系所學(xué)過(guò)的實(shí)驗(yàn)知識(shí)與技能,進(jìn)行知識(shí)類(lèi)比、遷移和重組。從實(shí)驗(yàn)裝置中獲取有效信息,可以幫助學(xué)生快速地理清解題思路,正確回答提出的問(wèn)題。
例如:某小組同學(xué)預(yù)利用下圖所示裝置制備SOCl2,雙頸瓶中所加試劑為25.4mL SCl2,發(fā)生如下反應(yīng):Cl2+SO2+SCl2=2SOCl2,
(1)洗氣瓶的作用是_______________________。
(2)干燥管中所加試劑是__________ ,其作用是
分析裝置圖中洗氣瓶的結(jié)構(gòu)特點(diǎn),該裝置有干燥氣體、混合氣體、通過(guò)氣泡控制通入的氣體體積比的作用,玻璃導(dǎo)管的存在也可以平衡體系的壓強(qiáng)。冷凝器上方的干燥管有吸收酸性氣體和水蒸氣的作用,再結(jié)合 SCl2和SOCl2遇水分解,故該裝置的作用就是防止空氣中的水蒸汽進(jìn)入裝置;
又如:科學(xué)家利用如圖的電化學(xué)原理裝置將CH4和CO2耦合轉(zhuǎn)化生成乙烯、乙烷、水和一氧化碳,由原理圖可知,A電極上CO2→CO、C元素化合價(jià)降低、發(fā)生還原反應(yīng),則A電極為陰極,電解質(zhì)傳導(dǎo)O2-,B電極為陽(yáng)極,陰極反應(yīng)式為CO2+2e-=CO+O2-,陽(yáng)極B上生成一定量的乙烯和乙烷混合氣體,
三、工藝流程中有效信息的獲取與整合
化學(xué)工藝流程題是近年高考中的新題型,它以工業(yè)實(shí)際生產(chǎn)和化學(xué)實(shí)驗(yàn)相關(guān)的物質(zhì)制備、分離和提純?yōu)橹行模粤鞒虉D為信息背景,以物質(zhì)的性質(zhì)和轉(zhuǎn)化為考查點(diǎn)。此類(lèi)題目綜合性比較強(qiáng),難度較大,而從工藝流程中獲取有效信息成為解題的關(guān)鍵。
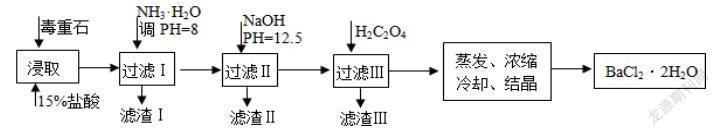
例如:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等雜質(zhì)),實(shí)驗(yàn)室利用毒重石制備BaCl2·2H2O的流程如下:
(1)寫(xiě)出“浸取”環(huán)節(jié)發(fā)生的主要離子方程式______。實(shí)驗(yàn)室用37%的鹽酸配置15%的鹽酸,除量筒外還需使用下列儀器中的______。(雙選,填選項(xiàng)字母)? ?a.燒杯? ? b.容量瓶? ? c.滴定管? ? ? d.玻璃棒
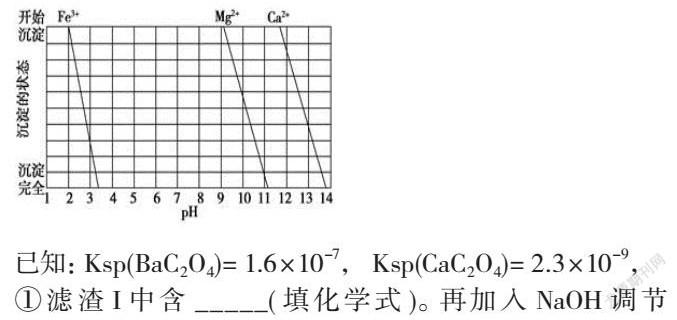
(2)下圖是一些難溶氫氧化物在不同pH下的沉淀一溶解圖
已知:Ksp(BaC2O4)= 1.6×10-7, Ksp(CaC2O4)= 2.3×10-9,
①濾渣I中含 _____(填化學(xué)式)。再加入NaOH調(diào)節(jié)pH=12.5可除去______(填離子符號(hào))
②加入H2C2O4應(yīng)避免過(guò)量的原因是________
25℃, H2C2O4的電離平衡常數(shù)如下:
H2C2O4 Ka1=5.36×10-2 Ka2=5.35×10-5
①HC2O4-的電離平衡常數(shù)表達(dá)式? Ka2=__________
②NaHC2O4溶液呈_______(酸性、堿性、中性)
由題干流程可知:加鹽酸溶解時(shí),碳酸鋇和鹽酸反應(yīng)而溶解變?yōu)锽a2+,加入氨水調(diào)節(jié)pH為8,只能使Fe3+完全沉淀,濾渣1為Fe(OH)3,再加入氫氧化鈉調(diào)節(jié)pH=12.5,只能使Mg2+完全沉淀,Ca2+部分沉淀,濾渣Ⅱ中含Mg(OH)2、Ca(OH)2;加入H2C2O4的目的是得到CaC2O4沉淀,以便除去剩余的Ca2+,最后通過(guò)蒸發(fā)濃縮、冷卻結(jié)晶、過(guò)濾得到BaCl2·2H2O,
總之,高中階段要以培養(yǎng)學(xué)生綜合素質(zhì)為目標(biāo),引導(dǎo)學(xué)生樹(shù)立社會(huì)主義核心價(jià)值觀(guān)。化學(xué)學(xué)科具有其學(xué)科的特殊性,其核心素養(yǎng)也是學(xué)生綜合素質(zhì)的重要組成部分。通過(guò)學(xué)習(xí)化學(xué),可以提高學(xué)生的觀(guān)察能力和動(dòng)手能力,促進(jìn)學(xué)生形成科學(xué)探究的精神和開(kāi)拓創(chuàng)新的意識(shí),教師也要通過(guò)授課培養(yǎng)學(xué)生科學(xué)的態(tài)度和對(duì)社會(huì)的責(zé)任。古人云:授之以魚(yú),不如授之以漁,授人以魚(yú)之救一時(shí)之急,授人以漁則可解一生之需。老師不僅僅是傳授知識(shí),更應(yīng)傳授學(xué)生主動(dòng)獲取知識(shí)的能力。新課程下提高學(xué)生主動(dòng)獲取和處理信息的能力,乃是教學(xué)本質(zhì)的追求,也應(yīng)該是每一位教師的努力方向。

