電針聯合有氧運動對腦梗死后缺血半暗帶cAMP/PKA通路的影響
張良兵,操禮瓊,董 巍
(安徽醫科大學附屬安慶市第一人民醫院, 安徽 安慶 246003)
電針是目前改善腦梗死后運動功能障礙的重要補充手段,以改善中風后遺諸癥[1-2]。有數據證實電針與有氧運動可協同改善腦梗死患者的神經功能缺損癥,但其作用機制目前尚無統一定論。有學者[3]證實腦組織細胞內cAMP/PKA通路的活化是修復神經元功能的靶點,更有研究人員[4]將cAMP/PKA通路作為非影像學標志軸突再生的指標。本研究通過觀察腦組織超微結構及cAMP、PKA蛋白表達變化,結合實驗性大鼠的運動功能評價,旨在探討電針結合有氧運動改善腦梗死后運動功能障礙的可能機制。
1 材料與方法
1.1 動 物 選用SPF級成年雄性SD大鼠[初始體重(220±20)g]92只,由中國上海SLAC實驗動物有限責任公司提供[合格證號:SCXK(滬)2017-0005],于安徽中醫藥大學動物實驗中心適應性喂養,體重達(280±20)g進行實驗研究。食物和水在整個實驗過程中由動物自由索取。實驗經安徽中醫藥大學動物管理制度和使用委員會批準后進行,嚴格按照國際道德準則和國家健康指南關于維護和使用實驗動物相關條例進行處理實驗動物。
1.2 試劑及儀器 TTC染液、PMSF、SDS-PAGE電泳膠、BCA工作液(碧云天公司,中國),PKA ELISA試劑盒(CST公司,美國),DAPI染色液(CST公司,美國),cAMP、β-actin一抗和堿性磷酸酶標記山羊抗兔(Promega公司,美國)等。
電針儀(G6805,中國上海醫療儀器廠),小動物跑臺(軟隆科技,中國),高速冷凍離心機(Thermo Fisher,美國),切片機(Leica,德國),激光共聚焦熒光顯微鏡(Bio-rad,美國),透射電鏡(TACHI,日本)酶標儀(Leica,德國),電泳槽(Bio-rad,美國),轉膜儀(Bio-rad,美國),凝膠成像系統(Bio-rad,美國)。
1.3 實驗分組 本研究共分五組,將SD大鼠進行兩次隨機,第1次分組:以1∶4 的比例用隨機數字表法隨機分配空白組18只和造模組74只;第2次分組:根據神經行為學評估,將腦缺血造模失敗大鼠剔除(本實驗造模成功72只大鼠,成功率97.3%),用隨機數字表法隨機分配分為模型組18只、電針組18只、有氧運動組18只、電針+有氧運動組18只,分別于干預后7 d留取標本。
1.4 模型制備 接受模型制備的大鼠禁食12 h后腹腔注射10%水合氯醛(0.3 ml/100 g),待大鼠充分麻醉后將大鼠呈仰臥位固定于實驗架上,剔除頸部毛發,常規消毒術野區域,沿著頸部正中線剪開皮膚,鈍性分離充分暴露左頸總動脈(CCA)、頸內動脈(ICA)、頸外動脈(ECA),從ECA尾端沿著ICA緩慢插入線栓至左側大腦中動脈入口,造成供血區急性缺血,固定線栓后逐層縫合皮膚,常規消毒,2 h后拔出線栓形成缺血再灌注。
1.5 干預方法
1.5.1 有氧運動:本研究中的有氧運動采用跑臺訓練方式進行,運動強度參考文獻[4],具體運動過程如下:大鼠于每日8∶00開始進行跑臺運動,跑臺坡度設置為0°,先將大鼠以10 m/min速度訓練15 min以便大鼠熟悉跑臺環境,隨后以20 m/min的速度運動30 min,連續訓練7 d。訓練結束后對大鼠進行急性腦梗死模型制備。判斷力竭標準[4]:大鼠訓練出現動作僵硬吃力,80%以上的訓練時間呈半臥位跑,降低跑臺速度后大鼠體力未恢復,對外界刺激反應明顯遲鈍。
1.5.2 電針治療:造模24 h后對大鼠進行電針干預,先將大鼠固定于實驗架上,參照李忠仁主編的《實驗針灸學》中曲池穴、足三里穴定位,將30#1寸不銹鋼毫針快速刺入上述穴位,進針深度2 mm,接上 G6805 電針儀,電壓峰值為6 V,以針體輕輕抖動為度,疏密波,頻率1~20 Hz,每次電針 30 min,1次/d,連續干預7 d。
1.6 觀察指標
1.6.1 神經行為學檢測:造模24 h后對大鼠進行神經行為學評分,評分方法參照Bederson等的5級分類法,具體評分內容如下:造模后大鼠未出現神經缺損癥狀(0分);提尾時大鼠右前肢屈曲,伸展不充分(1分);提尾時大鼠右前肢屈曲,置于地面時向右側推動時阻力低于對側(2分);提尾時大鼠右前肢屈曲,步行時向右側轉圈(3分);造模后意識不清,甚至死亡(4分)。
1.6.2 TTC染色:干預后每組隨機選取3只大鼠,腹腔注射10%是水合氯醛(0.3 ml/100 g),待大鼠充分麻醉后脫頸處死,冰上快速將腦組織取出后置于-20 ℃冰凍30 min,用鋒利刀片將腦組織冠狀位方向平均切成5片,每片約2 mm,將腦片置于TTC溶液中,避光染色30 min,期間依照著色程度對腦片進行翻動。正常腦組織經過TTC溶液著色后呈現鮮紅色,梗死區域呈蒼白色。染色結束后利用高清掃描儀對腦片進行掃描,Image J軟件對梗死區域大小進行分析統計。腦梗死體積=腦梗死面積×2 mm/全部腦片體積×100%。
1.6.3 透射電鏡觀察缺血半暗帶超微結構:干預后每組隨機選取3只大鼠,腹腔注射10%水合氯醛(0.3 ml/100 g),待大鼠充分麻醉后腹腔注射4%多聚甲醛對腦組織進行灌流固定,冰上快速取出缺血半暗帶,將組織修切成大小約1 mm3置于后2.5% 戊二醛磷酸緩沖液中24 h,隨后將樣本置于0.1 mol/L 的磷酸緩沖液漂洗3次,5 min/次,再進行常規脫水、包埋后烘干,再制成60 mm的薄切片,充分干燥后透射電子顯微鏡下觀察缺血半暗帶的超微結構。
1.6.4 ELISA檢測外周血cAMP、PKA濃度:干預后每組隨機選取3只大鼠,腹腔注射10%水合氯醛(0.3 ml/100 g),待大鼠充分麻醉后取腹主動脈血10 ml,4 ℃條件下進行3000 g離心5 min后收集上清液,采用酶聯免疫吸附試驗法(ELISA)對樣本進行檢測。利用0.05 mol/L的碳酸鹽包備緩沖液將樣本稀釋至蛋白質含量5 μg/ml,將96孔板中的反應孔中加入0.1 ml,4 ℃靜置5 h后摒棄反應孔溶液,用洗滌緩沖液洗滌反應孔,再將待測樣本加入反應孔中,室溫下靜置60 min后再次洗滌反應孔,分別加入酶標抗體、TMB底物后室溫下靜置30 min,再加入2 mmol/L的硫酸靜止反應后將反應孔置于MTT酶標儀中進行檢測。以空白對照孔調零后測各孔OD值,若大于規定的陰性對照OD值的2.1倍,即為陽性。操作過程嚴格按照試劑盒說明書進行檢測。
2 結 果
2.1 各組大鼠神經行為學評分比較 見表1。造模24 h后,除空白組外,其余四組大鼠神經行為學評分均升高(P<0.05),且四組間差異無統計意義(P>0.05),說明本研究的造模是成功的;經干預7 d,電針組、有氧運動組、電針+有氧運動組的神經行為學評分均較治療前及模型組有所下降(P<0.05);且電針+有氧運動組的神經行為學的改善程度明顯大于電針組、有氧運動組(P<0.05)。

表1 各組大鼠神經行為學評分比較(分)
2.2 各組大鼠腦梗死體積的比較 干預7 d,與空白組比較,模型組、電針組、有氧運動組、電針+有氧運動組大鼠的腦組織均出現不同程度的梗死灶(P<0.05);與模型組比較,電針組、有氧運動組、電針+有氧運動組的腦梗死體積百分比下降(P<0.05),且電針+有氧運動組下降程度大于電針組、有氧運動組(P<0.05)。見圖1。
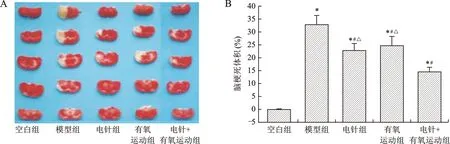
A:各組大鼠腦組織TTC染色情況(n=4);B:各組大鼠腦梗死體積比較;與空白組比較,*P<0.05;
2.3 各組大鼠缺血半暗帶組織超微結構比較 透射電鏡提示空白組大鼠缺血半暗帶的神經元細胞排列整齊,可見完整的細胞膜及細胞器、飽滿的細胞核,模型組大鼠腦組織見排列紊亂的神經元、溶解的細胞器,且無法識別,與模型組比較,電針組、有氧運動組及電針+有氧運動組大鼠神經元細胞結構較模型組明顯改善,細胞膜、細胞器及細胞核完整度明顯改善,且電針+有氧運動組優于電針組、有氧運動組(圖2)。
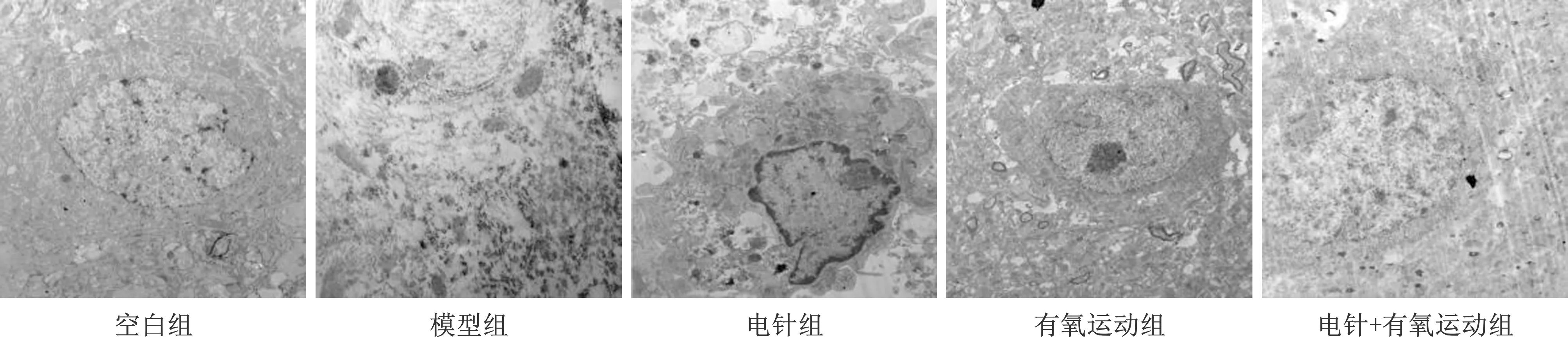
圖2 各組大鼠缺血半暗帶腦組織超微結構比較(n=4,×15000)
2.4 各組大鼠外周血PKA蛋白表達比較 見表2。與空白組比較,模型組大鼠血清cAMP、PKA蛋白表達模型組下降(P<0.05),經治療7 d后,電針組、有氧運動組及電針+有氧運動組大鼠血清cAMP、PKA蛋白表達均增加,與模型組比較差異均有統計學意義(P<0.05),但電針+有氧運動組的cAMP、PKA蛋白表達均高于電針組、有氧運動組(P<0.05)。
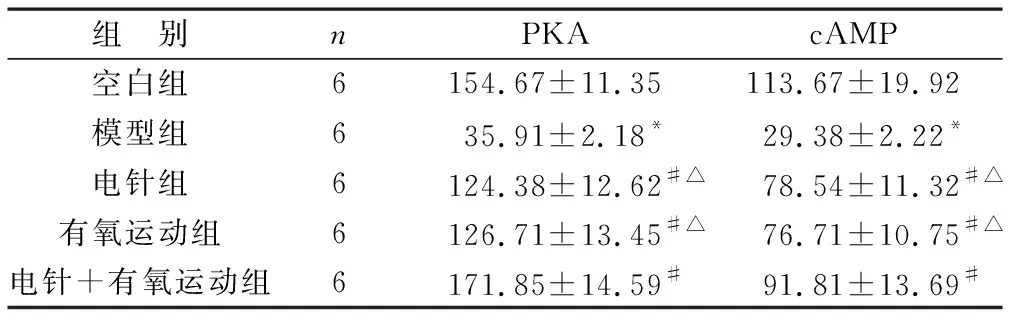
表2 各組大鼠外周血PKA蛋白表達比較(pg/ml)
3 討 論
腦梗死以其高致死率、高發病率、高致殘率的特點成為臨床研究重點[5],隨著醫療水平日益提升,腦梗死患者的生存率及發病率得到明顯改善,但其遺留的運動功能障礙仍是亟待解決的關鍵問題[6-7]。研究表明有規律的有氧運動對腦神經有良好的保護效應[8],有氧訓練可以從行走能力、姿勢反射、肌力、平衡功能等角度促進腦梗死癱瘓肢體的運動功能恢復,本研究結果顯示有氧訓練可明顯降低MCAO模型大鼠的神經行為學評分,縮減其腦梗死體積,這一研究結果與國內外諸多文獻所得數據一致。
針灸作為目前臨床重要的中醫治療手段被廣泛應用于改善腦梗死的功能障礙[9-10]。《靈樞·口問》中云:“夫十二經脈者,內屬于府藏,外絡于支節”,認為刺激特定的穴位可將全身上下、內外、前后、左右形成一個有機整體,從而直達病所。曲池穴是手陽明大腸經合穴,清代吳謙在其《醫宗金鑒》中寫道:“曲池主治中風是”;《針灸資生經》亦明確“刺風疹疼痛冷緩,捉物不得,挽弓不開,屈身難隱,脈風臂肘細無力”,可見歷代醫家均肯定了曲池穴在治療腦卒中引起的運動障礙中的作用。足三里乃足陽明胃經的合穴,陽明經多氣多血,刺激足陽明胃經可調暢氣血、扶助正氣。《針灸逢源》:“半身不遂:此由氣血不周……百會、肩井、肩髃、曲池、手三里、 列缺、風市、絕骨、足三里。以上穴,先針無病手足,后針有病手足”[11-12]。可見刺激曲池穴、足三里穴是促進腦梗死后肢體功能恢復的特定穴。本研究亦發現電針上述穴位后大鼠運動能力較前改善,缺血半暗帶的超微結構亦在一定程度上得到修復,可見曲池穴、足三里穴、可作為腦梗死后康復治療的重要組成部分,且我們還發現大鼠在進一步接受電針聯合有氧運動干預后神經功能修復程度更為凸顯,由此可見電針聯合有氧運動對腦梗死后運動功能障礙的改善確有協同效應。
大量實驗研究結果證實cAMP廣泛參與神經元突觸相關物質的合成、傳遞等環節,對神經元存活及軸突生長發揮調節作用[13-15]。內源性或外源性的刺激引起特定部位神經元細胞的興奮性增加,從而釋放神經遞質,由此導致腺苷酸環化酶AC的活化,AC被激活后可將ATP轉化為cAMP,由此使得特定部位cAMP水平增加,隨后促使更多的cAMP與PKA調節亞基相結合[16-18],由此PKA結構域發生變化,使得催化亞基PKAc解離后發生核移位,進入細胞核的PKAc誘發CREB發生磷酸化,由此引起pCREB蛋白構象產生變化致其酸性增強,隨后引起負電荷增多,據目前研究可知與DNA相結合的組蛋白均帶有正電荷,由此在正負電荷相吸下pCREB與DNA上組蛋白大量結合,由此DNA從組蛋白上分離出來,故組蛋白對DNA的抑制效應被解除,從而促使DNA啟動轉錄程序,實現對基因的轉錄調節[19-20]。本研究我們發現腦梗死發生后大鼠腦組織的cAMP、PKA濃度減少,可見當腦組織急性缺血時該通路被抑制,隨著電針聯合有氧運動的介入,cAMP、PKA表達明顯上調,提示電針聯合有氧運動激活了cAMP/PKA通路,促進缺血神經功能的修復,適應腦組織內環境的變化。
由此可見電針聯合有氧運動可激活腦組織cAMP/PKA通路,實現腦保護效應。

