酵母菌代謝產物對植物乳桿菌AB-1生產苯乳酸的影響
張成林,錢怡霖,劉尊英
(中國海洋大學食品科學與工程學院,山東 青島 266003)
苯乳酸(phenyllactic acid,PLA),也稱 2-羥基-3-苯基丙酸,是一種微生物通過次級代謝產生的新型天然抗菌物質,對多種食源性致病菌和食品腐敗菌有很強的抑制作用,具有安全、高效、廣譜等特點。苯乳酸是傳統發酵食品中植物乳桿菌的代謝產物之一,廣泛存在于各種發酵食品中,在食品工業具有廣闊的應用前景[1-3]。前期研究表明,培養基成分對植物乳桿菌的苯乳酸產量會產生一定的影響,優化培養基組成能夠促進苯乳酸的生成[4-5];另外,酵母菌代謝產物能夠促進植物乳桿菌的生長[6],向植物乳桿菌培養基中添加適量的代謝產物也有利于提高有機酸產量[7]。
本研究以植物乳桿菌AB-1(Lactobacillus plantarum AB-1)為研究對象,使用MRS培養基進行培養,通過優化培養基成分、外源添加酵母菌無細胞發酵上清液(cell-free supernatant,CFS)的方式,探究不同因素對植物乳桿菌AB-1生長代謝以及苯乳酸產量的影響,以期為苯乳酸的生物法高效制備提供基礎性研究數據,為開發新型食品生物防腐劑提供參考。
1 材料與方法
1.1 材料與設備
1.1.1 材料與試劑
植物乳桿菌AB-1:內蒙古農業大學張和平教授團隊饋贈;釀酒酵母Saccharomyces cerevisiae 606(E1)、釀酒酵母 Saccharomyces cerevisiae 626(E2):中國海洋大學水產品高值化利用實驗室保存菌種。苯乳酸標準品(純度≥98%):Sigma公司;苯丙氨酸、α-酮戊二酸、葡萄糖、蛋白胨、吐溫80、牛肉浸粉、KH2PO4(分析純):國藥集團化學試劑有限公司;甲醇、三氟乙酸(色譜純):Merck公司;初始MRS培養基(葡萄糖20.0 g/L、蛋白胨10.0 g/L、牛肉浸粉8.0 g/L、吐溫 80 1.0 g/L、檸檬酸氫二銨2.0 g/L、乙酸鈉5.0 g/L、磷酸氫二鉀2.0 g/L、硫酸鎂0.2 g/L)、酵母浸出粉胨葡萄糖培養基(yeast extract peptone dextrose medium,YPD)(葡萄糖 20.0 g/L、蛋白胨20.0g/L、酵母浸粉10.0 g/L)、LB培養基(蛋白胨10.0g/L、酵母浸粉5.0g/L、氯化鈉10.0g/L):青島海博生物技術有限公司。
1.1.2 儀器設備
SpectrumLabS23A紫外-可見分光光度計:上海棱光技術有限公司;LC-20AT液相色譜儀:日本島津公司;Agilent Zorbax SB-C18反相色譜柱:美國安捷倫公司;TSQ 280恒溫培養箱:上海精宏設備有限公司;SPX型智能生化培養箱:寧波東南儀器有限公司。
1.2 方法
1.2.1 苯乳酸含量測定
采用反相高效液相色譜法(reversed-phase high performance liquid chromatography,RP-HPLC)測定苯乳酸含量,參考楊小院等[8]的方法略作修改。發酵液預處理:發酵液先經過10 000 r/min離心處理10 min,將上清液用微濾膜 (0.22 μm)過膜。色譜柱為Agilent Zorbax SB-C18柱(4.6 mm×150 mm,5 μm);檢測波長210 nm;柱溫 30 ℃;流速 1 mL/min;進樣量 10 μL;流動相:A為0.05%三氟乙酸的甲醇溶液,B為0.05%三氟乙酸的水溶液;梯度洗脫條件:0~20 min(10%A→100%A),20 min~23 min(100%A→100%A),23 min~25 min(100%A→10%A)。
1.2.2 初始MRS培養基成分優化
配制不同含量的葡萄糖(G)(20.0、22.5、25.0、27.5、30.0、35.0、40.0、50.0、60.0、100.0 g/L)、蛋白胨(P)(10.0、15.0、20.0、30.0、35.0、40.0、50.0 g/L)、 吐溫 80(1.0、3.0、6.0、9.0、13.0、15.0、18.0 g/L)、牛肉浸粉(8.0、10.0、12.0、14.0、16.0、18.0、20.0 g/L)的 MRS 培養基,將植物乳桿菌AB-1按照1%接種量接種,37℃靜置培養24 h,測定PLA含量。
根據結果發現,分別增加初始MRS培養基中葡萄糖和蛋白胨的含量均有利于苯乳酸產量的提高,繼續探究同時增加兩種組分對苯乳酸產量的影響,試驗分為4組,以初始MRS培養基作為對照組Ⅰ。試驗過程中其它組分的含量均與對照組Ⅰ相同,僅改變葡萄糖、蛋白胨的含量,不同組別培養基組分添加量見表1。

表1 不同組別培養基組分添加量Table 1 Addition of medium components in different groups
1.2.3 植物乳桿菌AB-1生長曲線繪制
采用光密度法繪制植物乳桿菌AB-1生長曲線。將菌株接種在MRS固體培養基上,37℃靜置培養14 h后,挑取單菌落進行固體平板劃線分離純化,長出單菌落后接種至MRS液體培養基中,培養至穩定期,然后用移液槍吸取50 μL穩定期菌液分別接種至5 mL優化MRS培養基和初始MRS培養基中(組別見表1),靜置培養,每隔2 h測定1次菌液在600 nm下的光密度值(OD600),每組3個平行,以OD值為縱坐標、培養時間為橫坐標(h),繪制生長曲線,以初始MRS培養基作為對照組Ⅰ。
1.2.4 苯丙氨酸含量測定
參照楊立志等[9]的方法并略作修改,檢測器:DAD檢測器;流動相:流動相A為0.6%乙酸水溶液;流動相B為甲醇;柱溫:30℃;流速:0.7 mL/min;進樣體積:20 μL;分離柱型號:C18 Agilent ZORBAX SB-Aq(4.6×250 mm,5 μm); 檢測波長:258 nm。 洗脫程序: 0~12 min(80%A→80%A),12 min~15 min(80%A→40%A),15 min~27 min(40%A→40%A),27 min~30 min(40%A→80%A)。
1.2.5 α-酮戊二酸含量測定
檢測器:紫外吸收檢測器;流動相:采用0.08 mol/L KH2PO4(pH 3.00);柱溫:30℃;流速:0.5 mL/min;進樣體積:10 μL;色譜柱:Atlantis T3色譜柱(4.6 mm×150 mm,5 μm);檢測波長:210 nm。
1.2.6 酵母菌CFS的制備
將酵母菌E1、E2在YPD固體培養基中活化2代,挑取單菌落接種至YPD液體培養基中,30℃振蕩培養20、40h,分別收集發酵液,10000r/min 離心 10min,再經0.22 μm濾菌器過濾除菌,得到酵母菌CFS,于-80℃保存待測[10]。
1.2.7 酵母菌CFS對植物乳桿菌AB-1生產PLA的影響
植物乳桿菌AB-1按照1%的接種量接種至優化后的MRS培養基中,保證初始菌體濃度一致,分別將YPD培養基與發酵20、40 h的兩株酵母菌E1、E2的上清液按照5%、10%、15%、20%、30%的比例添加到優化后的MRS培養基中,同時以YPD培養基作為對照組Ⅱ,測定24 h后苯乳酸含量。
1.2.8 酵母菌CFS對植物乳桿菌AB-1生長的影響
植物乳桿菌AB-1按照1%的接種量接種至優化后的MRS培養基中,保證初始菌體濃度一致,然后外源添加15%經40 h發酵的酵母菌E1 CFS作為CFS組,同時以添加等量的YPD培養基作為對照組Ⅱ,分別測定植物乳桿菌AB-1的生長曲線。
1.3 數據處理
試驗處理3次重復,數據處理分析及作圖采用O-rigin 2017及SPSS 24.0,結果以平均值±標準偏差表示,單因素方差分析采用最小顯著性差異法(least significant difference,LSD),P<0.05 為差異顯著。
2 結果與分析
2.1 植物乳桿菌AB-1培養基優化研究
葡萄糖作為植物乳桿菌生長代謝中的碳源[11],在苯乳酸合成過程中發揮重要作用,因此,研究不同葡萄糖含量的MRS培養基對植物乳桿菌AB-1產生苯乳酸的影響見圖1。
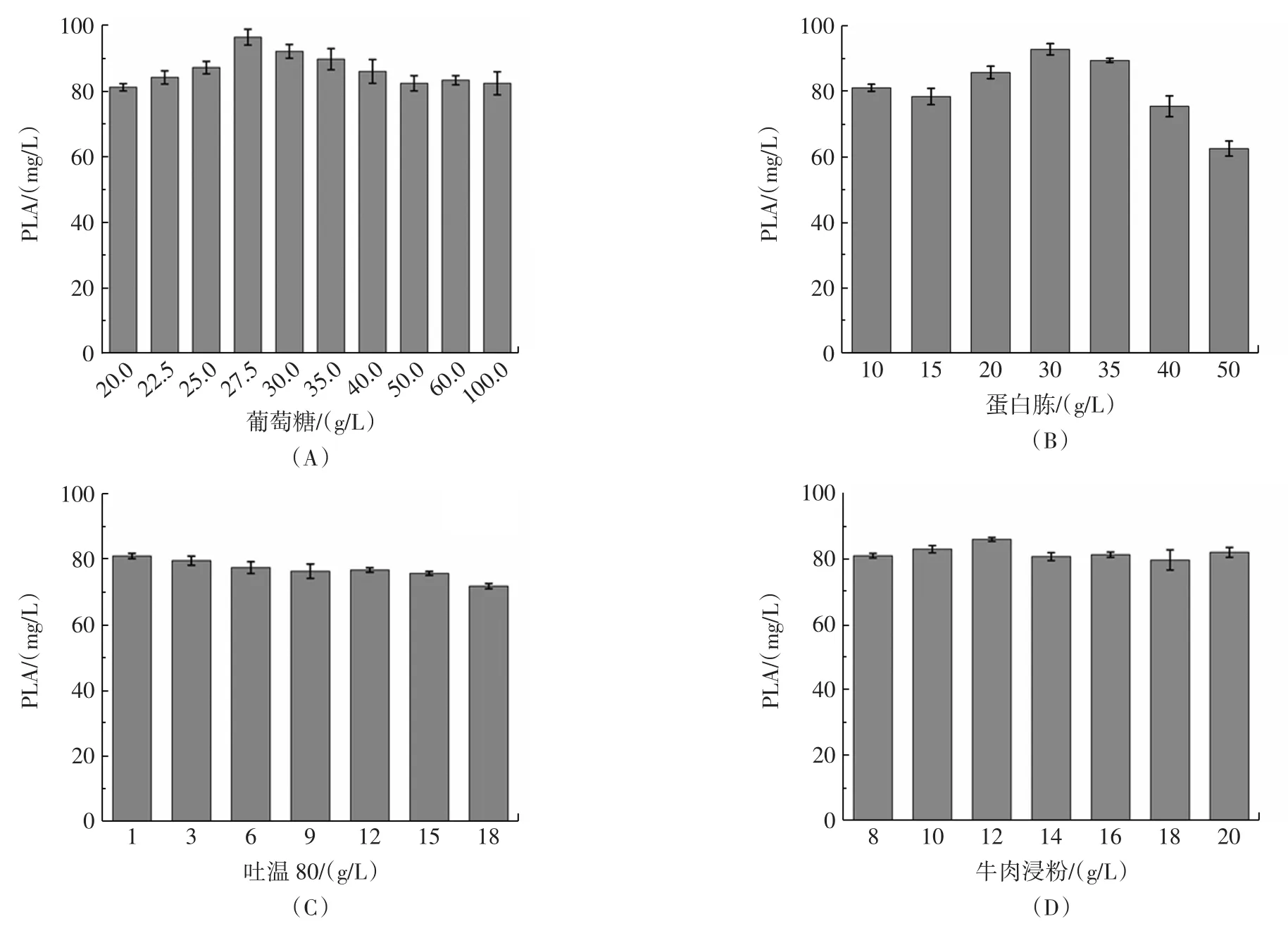
圖1 不同培養基成分對苯乳酸產量的影響Fig.1 Effect of different medium concentrations on the phenyllactic acid production of L.plantarum AB-1
如圖1(A)所示,在一定濃度范圍內,隨初始MRS培養基中葡萄糖含量增加,植物乳桿菌AB-1苯乳酸產量顯著提高,當葡萄糖濃度達到27.5 g/L時,苯乳酸產量達到峰值96.5 mg/L。葡萄糖作為糖酵解的重要底物,適當增加葡萄糖濃度可以促進糖酵解途徑[5],從而產生更多檸檬酸進入三羧酸循環,促進苯乳酸產生。隨著葡萄糖濃度的進一步增加,苯乳酸產量開始降低,產生該結果的原因可能是過高的糖含量并不利于植物乳桿菌AB-1的生長,從而影響其次級代謝途徑。
蛋白胨富含氨基酸,是植物乳桿菌生長代謝中的重要氮源,其中苯丙氨酸可作為苯乳酸合成的底物。如圖1(B)所示,在一定濃度范圍內,隨著蛋白胨添加量的提高,植物乳桿菌AB-1的苯乳酸產量增加,當蛋白胨添加量為30 g/L時,苯乳酸產量達到93.0 mg/L。由此可見,適當增加蛋白胨的濃度,提供更多苯丙氨酸底物[12-13],可促進苯乳酸的產生。
吐溫80作為一種表面活性劑,對培養基成分的均勻分布具有顯著影響。如圖1(C)所示,隨著吐溫80濃度的增加,苯乳酸的產量出現降低的趨勢,該現象可能是由于吐溫80改變了植物乳桿菌AB-1細胞壁的通透性,胞內代謝產物的流出導致苯乳酸無法正常合成[14]。
牛肉浸粉是發酵過程中的有機氮源,但牛肉浸粉濃度的增加對苯乳酸產量并未產生顯著影響。如圖1(D)所示,初始MRS培養基的氮源已基本達到飽和,無需更多氮源的添加。
葡萄糖和蛋白胨聯合添加對植物乳桿菌AB-1生長和苯乳酸產量的影響見圖2。
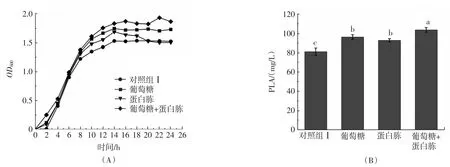
圖2 葡萄糖和蛋白胨聯合添加對植物乳桿菌AB-1生長和苯乳酸產量的影響Fig.2 Effects of combined glucose and peptone on the growth and PLA production of L.plantarum AB-1
如圖2(A)所示,相對于單獨增加葡萄糖、蛋白胨的結果,同時增加兩組分的含量更能顯著促進植物乳桿菌AB-1的生長;圖2(B)所示,兩組分的共同添加進一步提高了植物乳桿菌AB-1的苯乳酸產量,由初始的81.2 mg/L提高至103.8 mg/L,說明同時增加葡萄糖和蛋白胨可促進植物乳桿菌AB-1的生長繁殖、提高細菌總量,從而達到提高苯乳酸產量的目的,此時得到優化MRS培養基(葡萄糖濃度27.5 g/L,蛋白胨濃度30 g/L,其余組分與初始MRS培養基相同)。
2.2 不同發酵時間和酵母菌CFS添加量對植物乳桿菌AB-1生長趨勢及苯乳酸產量的影響
前期研究表明,酵母菌CFS中的代謝產物對植物乳桿菌生成有機酸具有一定的促進作用,但詳細機理尚未表征。在優化MRS培養基基礎上,進一步探究不同培養時間和不同添加量酵母菌CFS對植物乳桿菌AB-1生產苯乳酸的影響見圖3。
由圖3A、圖3B可知,對比相同添加量下不同發酵時間的影響,發酵40 h后的CFS均比發酵20 h的CFS更能提高總PLA含量,說明適當延長酵母菌的培養過程可積累更多的代謝產物,而這些代謝產物進一步促進了植物乳桿菌AB-1代謝生成苯乳酸;當添加量為15%時,酵母菌E1、E2 CFS對苯乳酸的促進作用均顯著優于對照組Ⅱ,此時酵母菌CFS能最好的發揮作用,比例繼續提高時促進作用反而減弱,推測是因為酵母菌CFS的添加稀釋了原本的培養基,使得植物乳桿菌AB-1可直接利用的碳源和氮源減少,從而減少了苯乳酸的生成;由圖3(C)可知,在酵母菌CFS發酵時間為40 h,添加量為15%的條件下,酵母菌E1比E2更能促進植物乳桿菌AB-1生產苯乳酸,說明酵母菌E1可能在培養過程中會產生更多有利的次級代謝產物。綜上,在優化MRS培養基基礎上,以15%的比例添加酵母菌E1發酵40 h的CFS,對植物乳桿菌AB-1苯乳酸的生成產生最大的促進作用,使PLA含量達到130.2 mg/L,相較于不加酵母菌CFS的優化MRS培養基和初始MRS培養基分別提高了25.4%和60.3%。
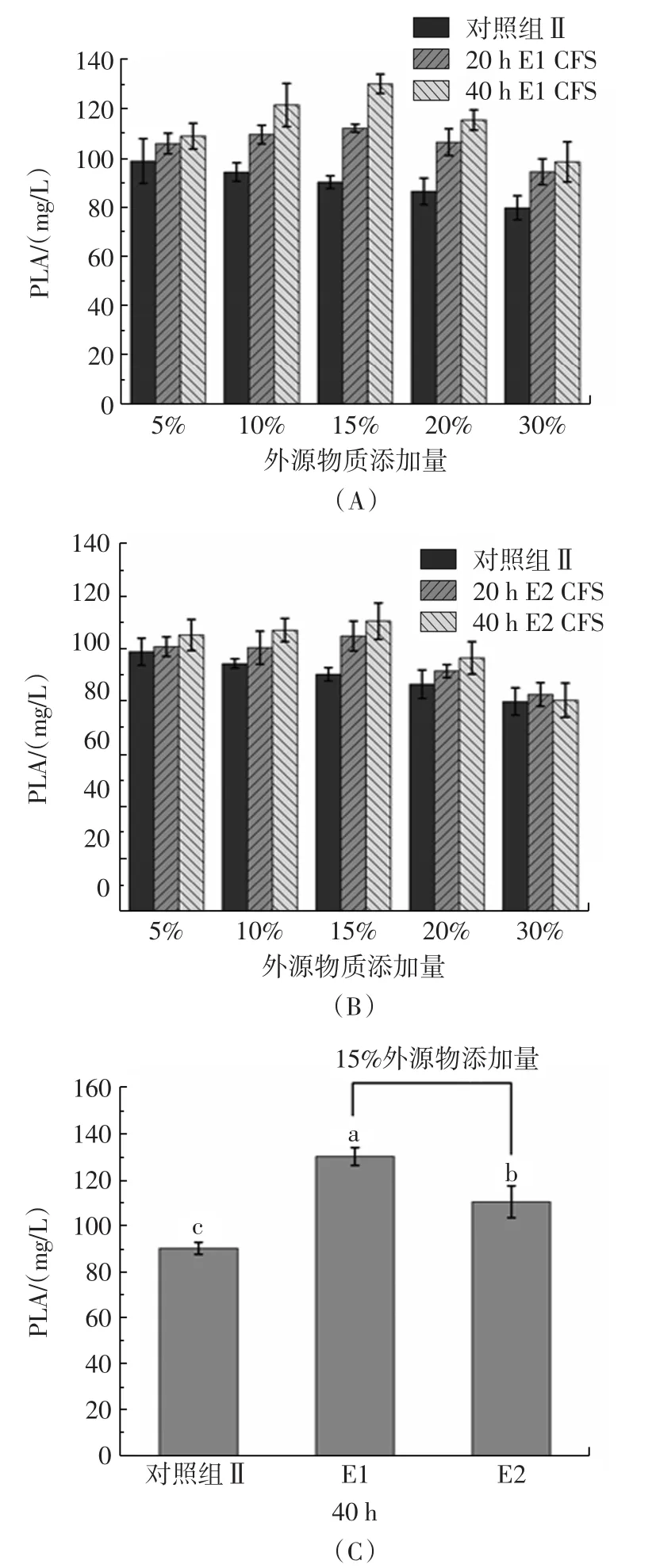
圖3 不同發酵時間和酵母菌CFS添加量對植物乳桿菌AB-1苯乳酸產量的影響Fig.3 Effect of yeast CFS with different fermentation time and content on the production of PLA by L.plantarum AB-1
根據以上結果,在優化MRS培養基的基礎上,以外源物添加15%經40 h發酵的酵母菌E1 CFS作為CFS組,外源添加等量的YPD培養基作為對照組Ⅱ,探究酵母菌CFS對植物乳桿菌AB-1生長趨勢的影響,結果見圖4。
如圖4所示,從12 h起,CFS組與對照組Ⅱ的生長趨勢產生差異,這種差異隨著時間的增長逐漸加大,表明酵母菌CFS可通過促進植物乳桿菌AB-1的生長提高苯乳酸的產量。

圖4 酵母菌CFS對植物乳桿菌AB-1生長趨勢的影響Fig.4 Effects of yeast CFS on the growth of L.plantarum AB-1
2.3 酵母菌CFS促進植物乳桿菌AB-1產苯乳酸的機制探究
利用反相高效液相色譜檢測酵母菌CFS中的苯乳酸,結果見圖5。
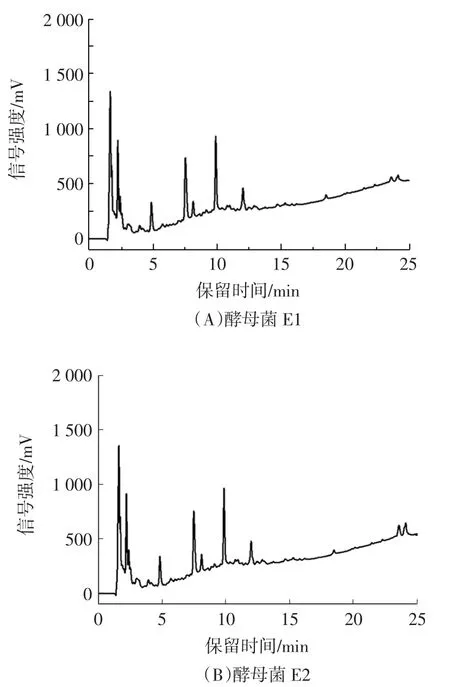
圖5 酵母菌CFS苯乳酸檢測Fig.5 Determination of phenyllactic acid in yeast CFS
結果表明,酵母菌E1、E2 CFS中均未發現苯乳酸在12.25 min處的特征吸收峰,說明酵母菌自身代謝不會產生苯乳酸,植物乳桿菌AB-1培養基內PLA含量的增加并不是外源引入導致的。
排除了外源引入苯乳酸的干擾,對苯乳酸的生物合成過程進行探究。苯乳酸生物合成的核心途徑主要包括兩個步驟:1)苯丙氨酸(phenylalanine,Phe)經過轉氨作用生成苯丙酮酸 (phenylpyruvic acid,PPA),其α-氨基通過轉氨酶轉移到合適的受體,如α-酮戊二酸(α-KG);2)PPA 被乳酸脫氫酶(lactate dehydrogenase,LDH)進一步還原成為 PLA[8]。
TACHIBANAS等通過代謝組學的研究發現,酵母菌代謝產物中含有包括苯丙氨酸、甘氨酸、絲氨酸、谷氨酸、天冬氨酸等多種氨基酸[15],其中Phe是PLA生物合成的重要底物。因此,分別測定了酵母菌E1和E2在發酵40 h的CFS中Phe的含量,見圖6。
如圖6(A)所示,酵母菌E1發酵40 h的CFS中Phe的含量為379.6 mg/L,顯著高于其它3組,由圖6(C)可知,在一定濃度范圍內,Phe的濃度與PLA的產量呈正相關。酵母菌CFS中確實含有Phe,且Phe有促進植物乳桿菌AB-1產生PLA的作用。
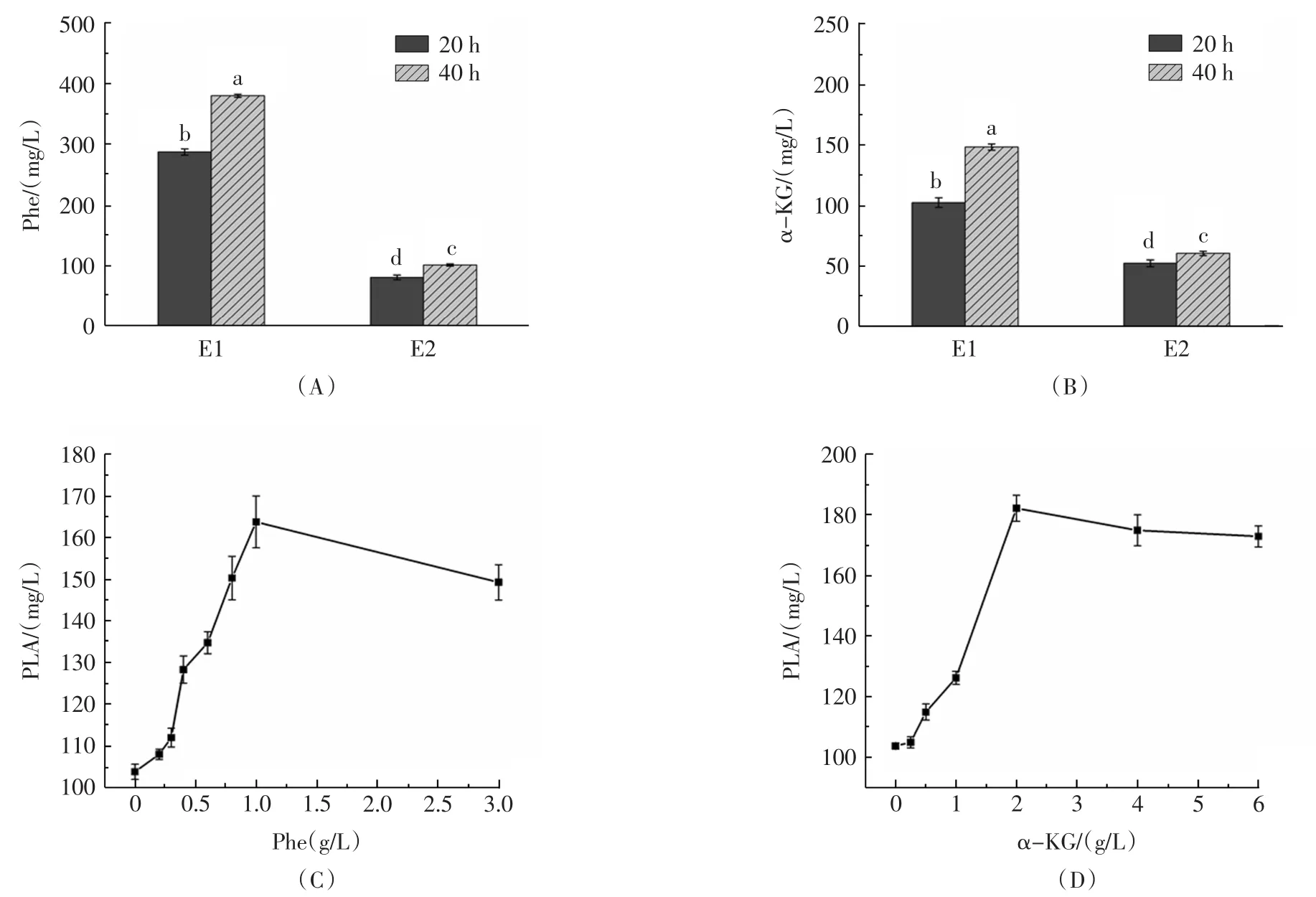
圖6 酵母菌代謝產物成分分析及驗證Fig.6 Analysis and validation of the yeast metabolites
房峻等[16]的研究表明,部分酵母菌具有積累α-KG的能力,累積的α-KG可以作為α-氨基的受體推動苯丙氨酸的轉氨過程,從而加速苯乳酸的產生。因此,分別測定酵母菌E1和E2在發酵40 h的CFS中α-KG的含量。如圖6(B)所示,酵母菌E1發酵40 h的CFS中α-KG的含量為148.3 mg/L,顯著高于其它3組。由圖6(D)可知,在一定濃度范圍內,α-KG的濃度與PLA的產量呈正相關。這些數據表明,酵母菌CFS中確實含有α-KG,且α-KG有促進植物乳桿菌AB-1產生PLA的作用。
綜上,酵母菌CFS中本身并不含有PLA,但含有一定濃度的Phe和α-KG,兩者均是苯乳酸生物合成過程中的重要底物。當酵母菌CFS加入到優化MRS培養基后,Phe和α-KG濃度的增加促進了苯乳酸的快速合成,提高了植物乳桿菌AB-1代謝生成苯乳酸的效率。
3 結論
培養基組成影響植物乳桿菌AB-1生產苯乳酸,優化MRS培養基組分有助于提高苯乳酸產量,當把初始MRS培養基中的葡萄糖濃度由20 g/L提高至27.5 g/L,蛋白胨濃度由10 g/L提高至30 g/L時,植物乳桿菌AB-1的苯乳酸產量可提高27.8%。外源添加酵母菌CFS有助于提高植物乳桿菌AB-1的PLA產量,當以15%的比例向優化后的MRS培養基中添加E1酵母菌發酵40 h的CFS,PLA產量會大幅提高,由初始培養基的81.2 mg/L提高至130.2 mg/L,相較于優化MRS培養基和初始MRS培養基分別增長了25.4%和60.3%。酵母菌CFS包含較高濃度的Phe和α-KG,兩者均是苯乳酸的生物合成過程的重要底物,酵母菌CFS可能通過加快PLA的生物合成過程來促使植物乳桿菌AB-1產生苯乳酸。
綜上所述,本研究通過優化培養條件,顯著的增加了植物乳桿菌AB-1的苯乳酸產量,為工業規模生產苯乳酸提供了參考,也為后續培養條件的優化試驗提供了借鑒。

