補腎強筋膠囊含藥血清對骨關節炎滑膜細胞、軟骨細胞PGE2、NGF基因表達的影響
陳 能,姚 楠
(1.廣州中醫藥大學第二臨床醫學院骨科,廣東 廣州 510120;2.廣州中醫藥大學第二附屬醫院/廣東省中醫院珠海醫院骨科,廣東 珠海 519000;3.廣東省中醫藥工程技術研究院/廣東省中醫藥研究開發重點實驗室,廣東 廣州 510095)
膝關節骨性關節炎(knee osteoarthritis,KOA)是一種發生在膝關節的退行性疾病,病理表現為滑膜炎性增生,軟骨退變等,臨床表現為膝關節疼痛、活動受限等。既往已有多項動物及細胞實驗證實KOA的發生發展受多種細胞因子影響,其中基質金屬蛋白酶(Matrix Metallo Proteinase,MMP)在KOA關節軟骨的破壞中起主要作用;前列腺素E2(Prostaglandin E2,PGE2)是炎性致痛因子;環氧合酶-2(Cyclooxygenase,COX-2)是催化PG的合成的誘導酶,并參與了KOA炎癥反應;神經生長因子(Nerve Growth Factor,NGF)與神經病理性疼痛及炎性疼痛均有關[1-2]。本研究觀察補腎強筋膠囊含藥學清對KOA滑膜細胞、軟骨細胞MMP13、PGE2、COX-2、NGF基因表達的影響,探討治療KOA的作用機制[3]。
1 研究對象及分組
選取在廣東省第二中醫院骨科住院的擬行全膝關節置換手術的KOA患者。西醫診斷參照中華醫學會風濕病學分會2010年制定的膝關節骨性關節炎診斷標準[4]。
2 手術取材
術中取出病變滑膜組織,在完成股骨遠端截骨后取出股骨髁軟骨,軟骨厚度不小于1 mm,盡快轉移至實驗室。
3 實驗材料
主要實驗儀器:SmartSpec plus 核酸蛋白測定儀(Bio-Rad公司);Varioskan Flash多功能酶標儀(Thermo Fisher Scientific公司),IQTM5型RT-qPCR儀(Bio-Rad公司)。
藥物和試劑:補腎強筋膠囊(廣東省第二中醫院制劑室);重組人IL-1β試劑(Peprotech公司);First Strand cDNA Synthesis Kit(Thermo公司);MaximaTM SYBR Green/Fluorescein qPCR Master Mix(2×)(Thermo Fisher Scientific公司);PCR特異性引物(上海英濰捷基貿易有限公司)。
4 實驗方法
原代滑膜細胞培養。滑膜組織剪切碎放入培養皿中,DPBS溶液清洗棄上清液后加0.25%胰酶1 mL,靜置于37℃,5%CO2培養箱60 min,取出棄胰酶,加入10%FBS的DMEM 2mL,然后靜置于37℃,5%CO2培養箱中培養。待細胞生長達瓶底90%以上后,用0.25%胰酶進行消化傳代,然后繼續用10%FBS的DMEM培養。
原代軟骨細胞培養。軟骨組織剪切成碎塊放入培養皿,DPBS溶液清洗棄上清液后加入0.25%胰酶1mL,靜置于37℃,5%CO2培養箱30min,然后棄上清液,加入0.02%II型膠原酶,靜置于37℃,5%CO2培養箱內過夜后,用100μm濾網過濾,加入10%FBS的DMEM,1600rpm離心5min,棄上清,細胞沉淀用10%FBS的DMEM培養,待細胞生長達瓶底90%以上后,用0.25%胰酶消化傳代,然后繼續用10%FBS的DMEM培養[5-7]。
含藥血清制備[5-7]。SPF級別SD雌性大鼠10只,體質量為180~220g。把大鼠分成空白組、含藥血清組,每組5只。根據動物與人之間藥物劑量換算,補腎強筋組每1kg予以0.243g生藥補腎強筋膠囊溶液灌胃,空白組予生理鹽水灌胃。所有大鼠連續7天每天灌胃1次,然后行腹主動脈取血,然后按3000rpm離心5min,棄上清液,56℃水浴30min滅活,經0.45μm濾膜抽濾,分裝,置于-80℃冰箱保存,即為空白血清和含藥血清。
細胞造模及分組[4]。將第3代細胞按每孔1×105個細胞密度種植于6孔板(n=6),培養至融合度約達80%時,棄培養基,用DPBS清洗后,進行分組處理。正常組為DMEM培養基+10%空白血清;OA組為DMEM培養基+10%空白血清,加入50ng/mL IL-1β;含藥血清組為DMEM培養基+10%含藥血清,加入50ng/mL IL-1β。連續培養24h后收集細胞。
RT-qPCR檢測細胞PGE2、COX-2、NGF、MMP-13的基因表達。首先采用Trigol、異丙醇和氯仿等試劑提取滑膜細胞、軟骨細胞總RNA。用First Strand cDNA Synthesis Kit提供的實驗方法進行反轉錄操作,加入上述提取的總RNA,合成First-Strand cDNA。基因引物設計利用Primer6.0生物軟件。然后在定量PCR儀進行擴增和熔解曲線分析,反應結束后記錄Ct值,運用2-△△Ct法分析各組基因相對表達量。
5 結 果
滑膜細胞基因表達比較。與OA組比較,正常組、含藥血清組PGE2、NGF、COX-2、MMP-13基因表達比較差異均有統計學意義(P<0.05)。與正常組比較,含藥血清組PGE2、NGF、COX-2、MMP-13基因表達差異均有統計學意義(P<0.05)。
表1 各組滑膜細胞因子基因表達比較 (n=6,±s)

表1 各組滑膜細胞因子基因表達比較 (n=6,±s)
注:與OA組比較,*P<0.05;與正常組比較,△P<0.05。
組別 PGE2 NGF COX-2 MMP-13正常組 1.00±0.40*1.00±0.42*1.00±0.40*1.00±0.44*OA組 5.36±1.81 4.59±0.99 4.32±0.81 6.43±1.79含藥血清組2.42±0.39*△2.53±0.40*△2.36±0.56*△ 2.87±0.73*△
軟骨細胞基因表達比較。與OA組比較,正常組、含藥血清組PGE2、COX-2、、MMP-13基因表達比較差異均有統計學意義(P<0.05),與正常組比較,含藥血清組PGE2、COX-2、、MMP-13基因表達比較差異均有統計學意義(P<0.05)。3組軟骨細胞NGF表達比較差異無統計學意義(P>0.05)。
表2 各組軟骨細胞因子基因表達比較 (n=6,±s)
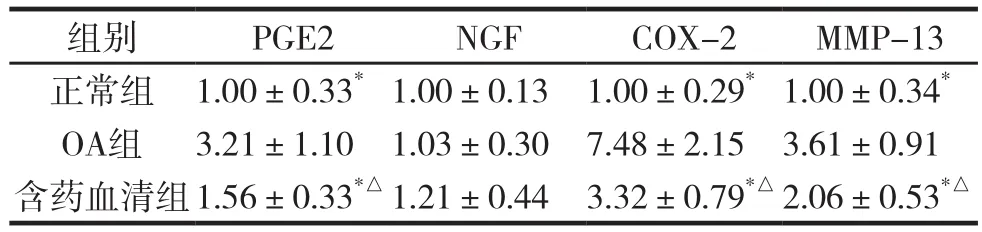
表2 各組軟骨細胞因子基因表達比較 (n=6,±s)
注:與OA組比較,*P<0.05;與正常組比較,△P<0.05。
組別 PGE2 NGF COX-2 MMP-13正常組 1.00±0.33*1.00±0.13 1.00±0.29*1.00±0.34*OA組 3.21±1.10 1.03±0.30 7.48±2.15 3.61±0.91含藥血清組1.56±0.33*△1.21±0.44 3.32±0.79*△2.06±0.53*△
6 討 論
正常狀態下,膝關節滑膜可產生滑液,滑液主要發揮潤滑關節腔及吞噬物質的作用,軟骨由軟骨細胞、纖維和細胞外基質構成,細胞外基質能保護軟骨細胞使其不與關節腔直接接觸。KOA發生時,關節滑膜發生炎癥反應,釋放出炎性介質、細胞因子等物質[8],使膝關節腔內環境處于炎性狀態,導致軟骨細胞外基質持續性地發生降解,當達到一定程度時軟骨細胞暴露于炎性環境中,使軟骨細胞逐漸失去活性,甚至死亡,最終軟骨破損。此外,KOA關節腔內物質中不乏多種致痛因子,這些因子刺激神經感受器,引起了疼痛[9-10]。研究表明,KOA膝關節滑膜、軟骨中一些細胞因子水平的升高影響了病情,王培等[11]研究表明COX-2mRNA在膝關節骨性關節炎病變初期滑膜細胞中表達水平較高。StoppielloLA等[12]發現KOA患者膝關節滑膜中NGF的表達升高,且與疼痛相關,而PecchiE等[13]研究采用炎性因子刺激軟骨細胞時,也會使NGF表達升高。本研究使用重組人IL-1β刺激復制滑膜細胞和軟骨細胞OA模型,結果表明上述因子基因表達確實有不同程度的升高,這與以往研究結果相符。
KOA屬中醫“痹證”范疇。潘建科等[14]通過數據挖掘分析表明具有補腎、活血功效的中藥是治療KOA內服處方的主要成分。補腎強筋膠囊由補益肝腎、活血通絡中藥組成,既能補肝腎之不足以滋養筋骨,也能通局部之淤阻以順暢氣血,從而發揮緩解膝關節疼痛,改善關節活動功能的功效。研究表明,補腎強筋膠囊能有效改善膝關節滑液中IL-1β、TNF-α、PGE2水平以及血清PGE2水平[15],補腎強筋膠囊含藥血清可顯著降低軟骨細胞上清液NO和PGE2水平,并顯著降低軟骨細胞COX-2、iNOS、MMP-1、MMP-13 mRNA表達[5]。研究對該藥治療KOA的作用機制進行了補充,結果表明補腎強筋膠囊含藥血清對滑膜細胞PGE2、COX-2、MMP-13、NGF基因表達,對軟骨細胞PGE2、COX-2、MMP-13基因表達均有一定程度調節作用,但對于軟骨細胞NGF基因表達無明顯調節作用。
因此,補腎強筋膠囊治療KOA的作用可能與調節滑膜細胞PGE2、COX-2、MMP-13、NGF以及軟骨細胞PGE2、COX-2、MMP-13的基因表達有關。對于滑膜細胞,研究使用重組人IL-1β刺激,可使NGF基因表達顯著升高,而采用含藥血清干預能使NGF基因表達顯著下調,但對于軟骨細胞,無論用采取何種干預方式對NGF基因表達均無明顯調節作用。研究表明,膝關節滑膜中神經分布更為密集,但關節軟骨無神經支配,由于NGF分布可能與神經分布有關,因此軟骨細胞NGF基因表達未發生顯著變化[16]。

