熒光染料對短須裂腹魚早期魚苗的浸泡標記研究
李茂華,李天才,曾如奎,趙宇航,宋昭彬,楊 坤
(1.四川大學生命科學學院,生物資源與生態環境教育部重點實驗室,成都 610065; 2.雅礱江流域水電開發有限公司,成都 610051; 3.西華師范大學生態研究院,西南野生動植物資源保護教育部重點實驗室,四川南充 637002)
魚類人工增殖放流是保護或恢復天然漁業資源的重要措施之一。國際上對魚類增殖放流多持謹慎態度,提出了“負責任的增殖放流”概念,提倡先進行實驗性放流,持續監測放流群體,避免發生無意義甚至有害的增殖放流[1-3]。我國魚類資源非常豐富,特有種類多,但受過度捕撈、水體污染和水利水電工程修建等影響,漁業資源嚴重衰退,魚類瀕危物種數逐年升高[4-5]。為依法保護和合理利用水生生物資源,實施可持續發展戰略,我國已將人工增殖放流作為一項長期的基本政策,每年放流苗種數百億尾(粒)。不過,我國大部分增殖放流活動沒有對放流魚類進行標記,也缺少對魚類放流后的長期跟蹤監測[6-7]。
耳石熒光標記是一類在魚類增殖放流中已經大量應用的批量標記方法,適用于魚類仔、稚、幼魚等早期生長階段或小型魚類[8]。通常,將一些易與鈣離子結合的熒光物質,通過溶液浸泡或加入餌料投喂的方式進入魚體,沉積在耳石上形成熒光標記。常用的熒光物質有四環素類(tetracycline)、茜素絡合物(alizarin complexone,AC)、茜素紅(alizarin Red S,ARS)和鈣黃綠素(calcein,CAL)等,其中AC和ARS的標記效果較好[8]。但耳石熒光標記也存著一些缺點,如安全濃度不高(通常為50~200 mg/L)、容易對魚體造成損傷,因而需在實施前開展大量實驗弄清合適條件[9-11]。此外,該方法提供標記信息的模式很少,通常只能重復標記,而重復次數是極其有限的[10]。如果能尋找到更多熒光物質標記并組合使用,則可在一定程度上增加標記信息。
短須裂腹魚(Schizothoraxwangchiachii)為鯉科(Cyprinidae)裂腹魚亞科(Schizothoracinae)裂腹魚屬的魚類,主要分布于金沙江及其支流雅礱江、烏江等水系[12]。過去的二十年間,由于受水利水電工程修建、過度捕撈等影響,短須裂腹魚野外資源量衰退明顯[13-15]。為彌補人類活動造成的不利影響,近年來金沙江、雅礱江流域修建了許多魚類增殖放流站,采用當年人工繁殖當年放流的方式,陸續開展了大規模的魚類人工增殖放流[15-17]。短須裂腹魚放流苗種一般為全長4~12 cm的幼魚,規格較小。目前,迫切需要使用合適的方法標記短須裂腹魚放流群體,進行“標記-重捕”研究,科學評估增殖放流效果,以及時調整、優化放流策略,使人工增殖放流達到資源增殖和物種保護的目的。鑒于此,本研究使用鹽酸四環素(tetracycline hydrochloride,TC)、AC、ARS和CAL浸泡標記短須裂腹魚早期魚苗(仔、稚魚),并探討與茜素絡合物同屬蒽醌類化合物的酸性茜素藍B(acid alizarin blue B,AAB)、茜素黃GG(alizarin yellow GG,AYG)浸泡標記短須裂腹魚的可行性,以期為短須裂腹魚大規模標記和放流效果評估提供參考。
1 材料與方法
1.1 魚苗來源與管理
研究所用短須裂腹魚早期魚苗均由雅礱江錦屏·官地水電站魚類增殖放流站人工繁殖和培育。用于繁殖的親魚為2011-2012年捕撈自雅礱江大河灣江段的野生個體。實驗所需魚苗根據標記方案從該站隨機選取,但確保同一次實驗的魚苗日齡、規格基本一致。實驗過程中,魚苗飼養在21.5 cm(長)×13.5 cm(寬)×6.5 cm(高)的白色塑料水槽中,貯潔凈的養殖水1 L。每天8:00、12:00、16:00、20:00分別飽食投喂浮性顆粒飼料(鳳凰牌);每天吸取污物一次并換水1/3,每兩天徹底換水一次并清洗水槽;每天8:00、14:00、20:00測量水溫并記錄。每次浸泡標記開始前,饑餓24 h。浸泡標記結束后徹底清洗水槽并換上潔凈的養殖水,然后根據實驗方案繼續飼養。
1.2 試劑與配制
本研究所用的熒光物質為AC、ARS、AAB、AYG、TC和CAL,均為分析純的粉劑(合肥博美生物科技有限責任公司)。用潔凈的養殖水,根據實驗方案配制成不同濃度的溶液,每個空白對照組及實驗組溶液均為1 L。魚苗取樣或測量時使用MS-222溶液(約100 mg/L)麻醉處理。
1.3 標記方案
1.3.1 AC標記
隨機選取8日齡短須裂腹魚570尾,全長(15.23±0.88)mm(n=20),平均分成19組,每組30尾。其中一組作為空白對照,其余18組使用AC溶液浸泡標記,每組實驗條件由浸泡濃度50、100、150、200、250、300 mg/L和浸泡時間6、12、24 h兩兩組合,水溫為(14.7±0.9)℃。20、55日齡短須裂腹魚浸泡標記實驗與此相同,魚苗全長分別為(16.51±0.71)、(25.58±1.43)mm,水溫分別為(15.3±1.5)、(15.2±0.8)℃。不過,55日齡魚苗規格較大,僅使用190尾,每組10尾。為評估AC標記對魚體生長的影響,在20日齡短須裂腹魚浸泡標記結束16 d之后,使用游標卡尺測量各組魚體全長(精確至0.01 mm),然后將魚體保存在99.7%的酒精中。8日齡和55日齡實驗組則在浸泡結束10 d后,直接將魚體全部保存在99.7%的酒精中,以待摘取耳石。
1.3.2 AC或ARS重復標記
隨機選取50日齡短須裂腹魚稚魚340尾,全長(25.58 ± 1.24) mm(n=20),均分為17組,每組20尾,其中1組作空白對照組, 8組作AC重復標記實驗組,剩余8組作ARS重復標記實驗組。(1)AC重復標記實驗:按照表1的方案,使用100、200、300、400 mg/L的AC溶液浸泡標記其中8組,每個濃度按浸泡時間分2組,水溫(14.7±1.0)℃,第一次浸泡結束后繼續飼養至83日齡,全長(35.02 ± 1.62) mm(n=10),使用同樣的條件重復標記各組尚存活的魚體一次,水溫(16.0 ± 0.8)℃,但將原浸泡時間為12 h的組延長至48 h。(2)ARS重復標記實驗:使用ARS溶液浸泡標記其余8組,標記過程與AC重復標記相同,方案見表1。第二次浸泡標記結束10 d后,將魚體全部保存在99.7%的酒精中,以待摘取耳石。
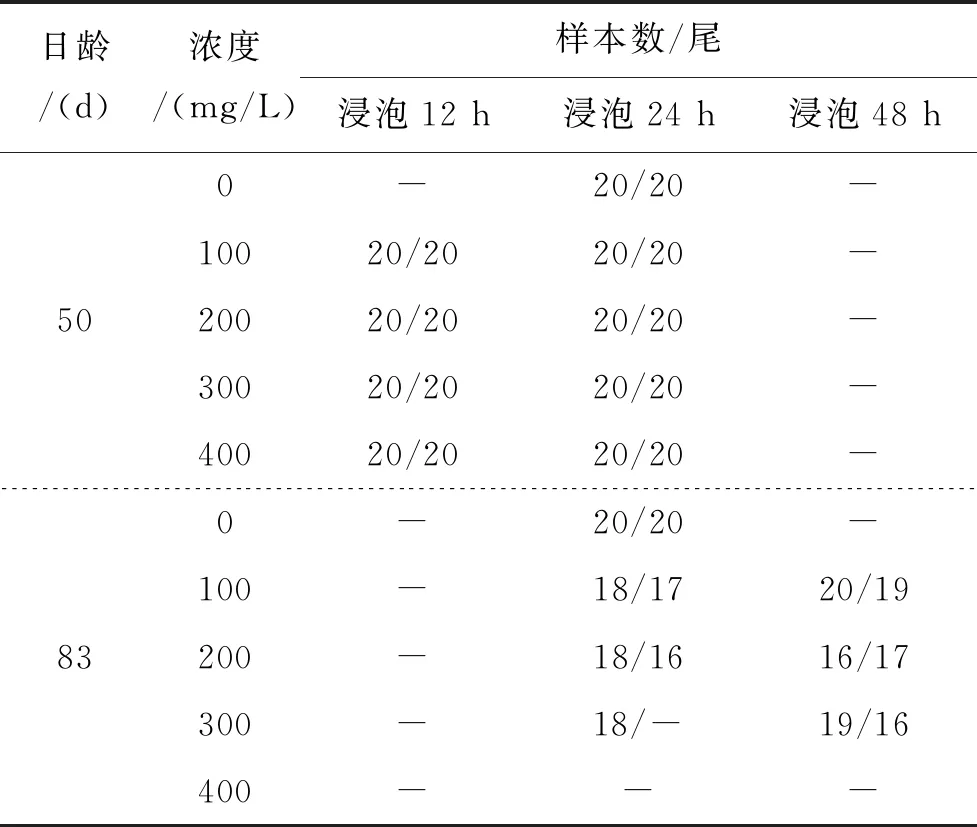
表1 使用AC或ARS重復標記短須裂腹魚實驗方案
1.3.3 TC標記
隨機選取8日齡短須裂腹魚仔魚210尾,全長(15.23±0.88)mm(n=20),平均分成7組,每組30尾。然后分別使用0(空白對照組)、50、100、150、200、250、300 mg/L的TC溶液浸泡24 h,水溫(14.7±0.9)℃。浸泡結束30 d后,將魚體全部保存在99.7%的酒精中。
1.3.4 其他熒光染料的標記
隨機選取22日齡短須裂腹魚仔魚390尾,全長(16.27±0.34)mm(n=20),平均分成13組,每組30尾,其中一組作為空白對照組。熒光物質CAL溶液濃度依次為100、200、400、800 mg/L,AYG及AAB溶液濃度依次為50、100、150、200 mg/L,分別使用相應濃度的染料浸泡魚體24 h,水溫(16.3±0.3)℃。浸泡結束40 d后,將魚體全部保存在99.7%的酒精中。
1.4 耳石摘取與標記檢測
在解剖鏡下,用解剖針剖開短須裂腹魚頭骨,取出3對耳石(微耳石、矢耳石和星耳石), 依次用清水、99.7%酒精清洗、晾干,再用中性樹膠封固于載玻片上,最后貼上標簽,放置在無塵干燥處晾干。在Olympus BX40熒光顯微鏡下,使用10×物鏡,分別在普通白光、綠光(濾光片WG,主波長546 nm)、藍光(濾光片WB,主波長495 nm)、紫外光(濾光片WU,主波長365 nm)四種光下觀察熒光標記的耳石。根據初步觀察結果,選擇其中一種熒光效果最好的激發光,用于評價耳石熒光標記質量。為量化分析,依據Yang等[10]的方法,將標記質量分為六個等級。當標記質量 ≥ 3時定為優質標記。檢測分兩次獨立進行,當兩次結果出現不一致時,再進行第三次檢測,以確定一個唯一的檢測結果。使用顯微鏡連接的Q-Imaging MicroPublisher 5.0 RTV CCD為耳石拍照。
1.5 數據分析
實驗數據使用Excel 2013初步整理后,使用SPSS 19.0對AC標記的死亡率、標記質量進行方差分析和線性回歸分析,20日齡AC標記實驗的短須裂腹魚全長比較也采用方差分析。以P<0.05為差異顯著,P<0.01為差異極顯著。
2 結果
2.1 熒光標記的檢測光
在四種光下的觀察結果顯示:AC、ARS標記的短須裂腹魚耳石在普通白光下可觀察到深淺不一的紫紅色,在其他三種光源下則均可觀察到明顯的橘紅色標記環,綠光下最明顯,藍光次之,紫外光最弱;TC、AYG、AAB和CAL標記的耳石沒有觀察到標記;所有空白對照組的耳石也沒有觀察到標記(圖1)。因而,選用綠光檢測AC和ARS的標記質量。
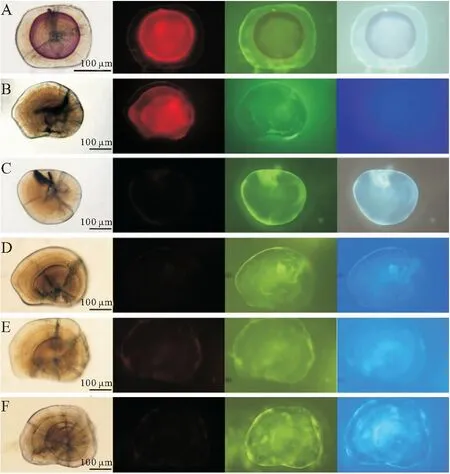
圖1 不同激發光下熒光標記的短須裂腹魚微耳石
2.2 AC標記
AC標記的耳石在綠光下均能夠觀察到橘紅色標記,標記率100%;標記條件不同,標記質量存在差異(圖2)。因8日齡時短須裂腹魚仔魚僅有部分個體的星耳石原基形成,故這里沒有對星耳石分析。方差分析(Four-way-ANOVA:只考慮主效應,事后檢驗Turkey HSD)結果表明:標記質量受魚體全長、AC溶液濃度和浸泡時間的顯著影響;微耳石和矢耳石之間的標記質量無明顯差異(表2)。線性回歸分析的結果顯示:Q=-0.605x+0.013y+0.053z+10.872(R2=0.667,Q為標記質量,x為全長,y為溶液濃度,z為浸泡時間)。表明標記質量隨著AC溶液濃度和浸泡時間的升高而提高,隨著魚體全長的增加而降低。
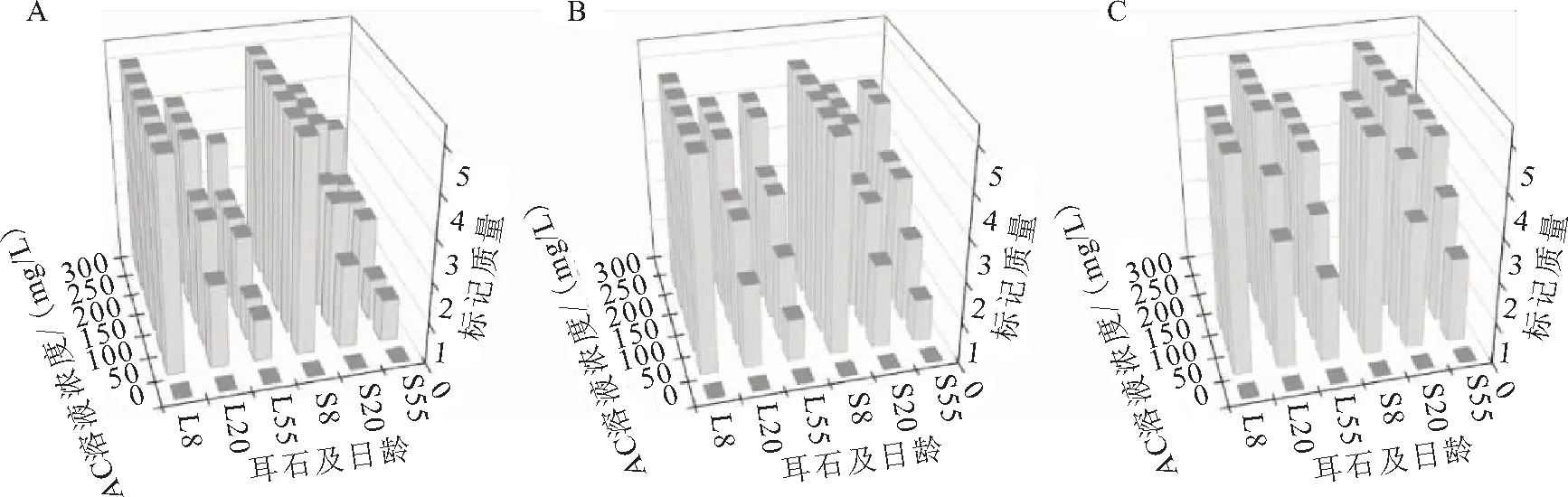
圖2 AC標記短須裂腹魚的標記質量
不同實驗條件下短須裂腹魚死亡率存在差異(表2)。方差分析(Three-way-ANOVA:只考慮主效應,事后檢驗Turkey HSD)結果表明:死亡率受到魚體全長和AC溶液濃度顯著影響,受浸泡時間的影響不顯著(表3)。線性回歸分析的結果顯示:M=-0.088x+0.001y+0.007z+1.304(R2=0.434,M為死亡率,x為全長,y為溶液濃度,z為浸泡時間)。表明死亡率隨著AC溶液濃度和浸泡時間的增加而升高,隨著全長的增長而降低。
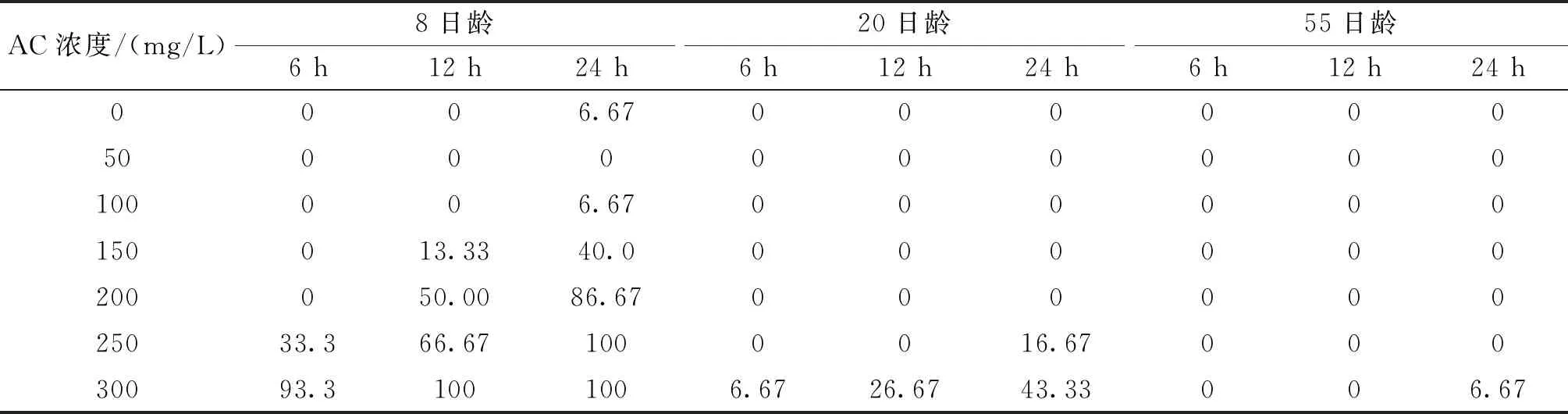
表2 AC標記短須裂腹魚的死亡率
20日齡短須裂腹魚AC浸泡標記結束16 d后,與空白對照組相比(One-Way-ANOVA:事后檢驗Dunnett),除AC溶液濃度300 mg/L、浸泡時間24 h的這組魚體全長顯著較低外(P<0.05),其他各組魚體全長沒有顯著差異(P>0.05,表3)。
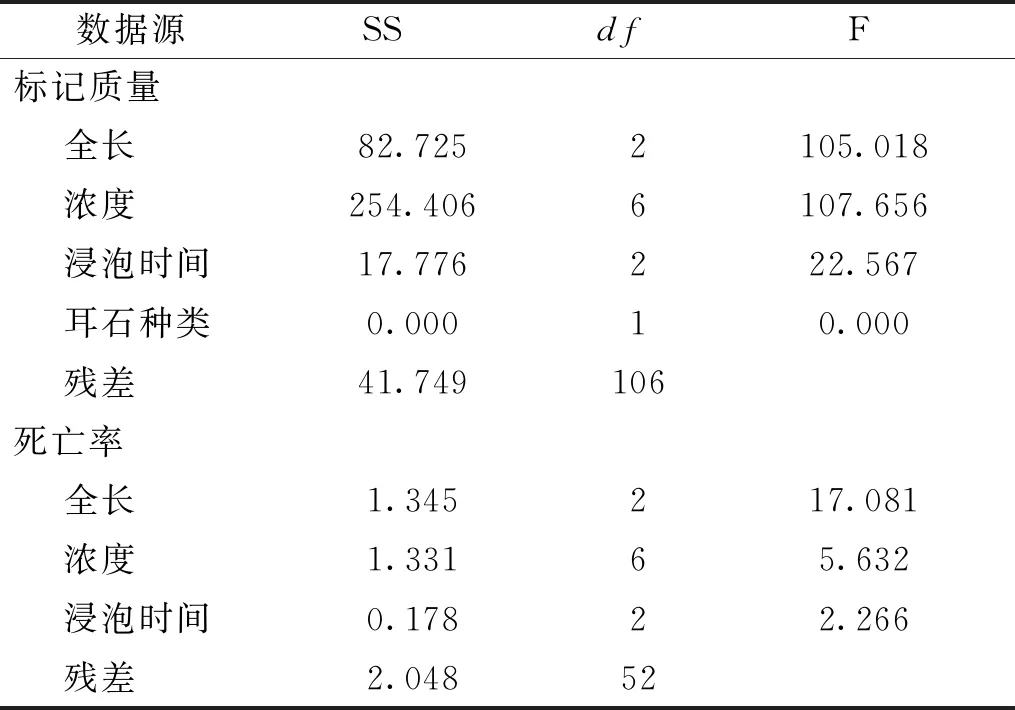
表3 AC標記短須裂腹魚的標記質量和死亡率方差分析結果
2.3 AC重復標記
AC重復標記的耳石在綠光下均能觀察到兩個區分明顯的橘紅色標記環(圖3,A),標記率100%。相同的標記條件,微耳石標記質量最高,矢耳石次之,星耳石最低(圖4);首次標記和再次標記的標記質量差異很小。浸泡時間12 h的組,100~300 mg/L的AC溶液首次標記沒有造成50日齡魚體死亡;83日齡重復標記時將浸泡時間延長至48 h,100 mg/L組仍沒發生死亡,但200、300 mg/L組的死亡率均為100%(表4)。浸泡時間24 h的組,100~300 mg/L的AC溶液在首次標記時除300 mg/L組和空白對照組各死亡1尾外,其他組均沒有出現魚體死亡;在83日齡重復標記時,100 mg/L組仍沒有死亡,但200、300 mg/L組死亡率均為100%(表4)。400 mg/L的AC溶液造成的死亡率極高,第一次標記時已接近100%。
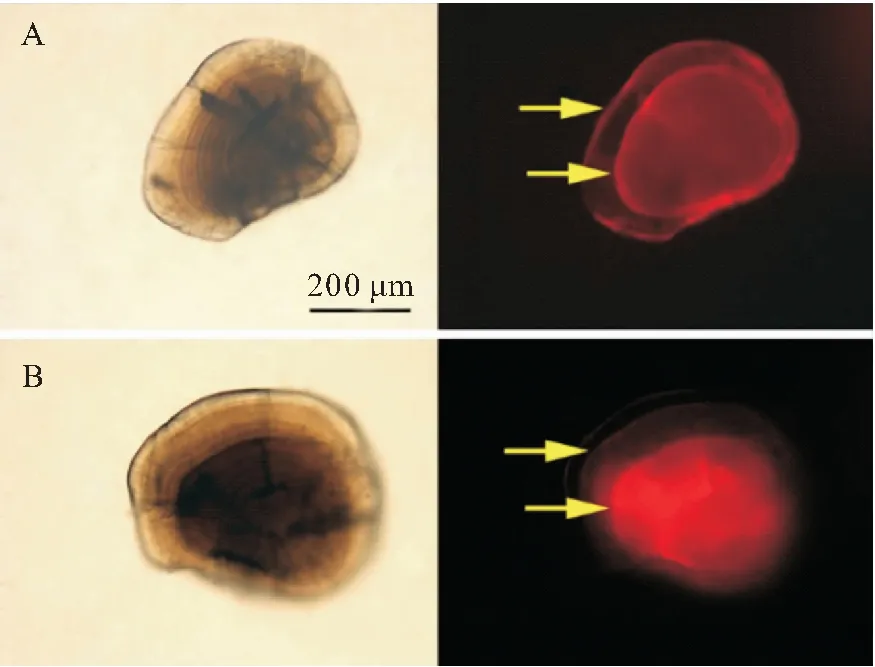
圖3 AC和ARS重復標記的短須裂腹魚微耳石

圖4 AC重復標記短須裂腹魚的標記質量
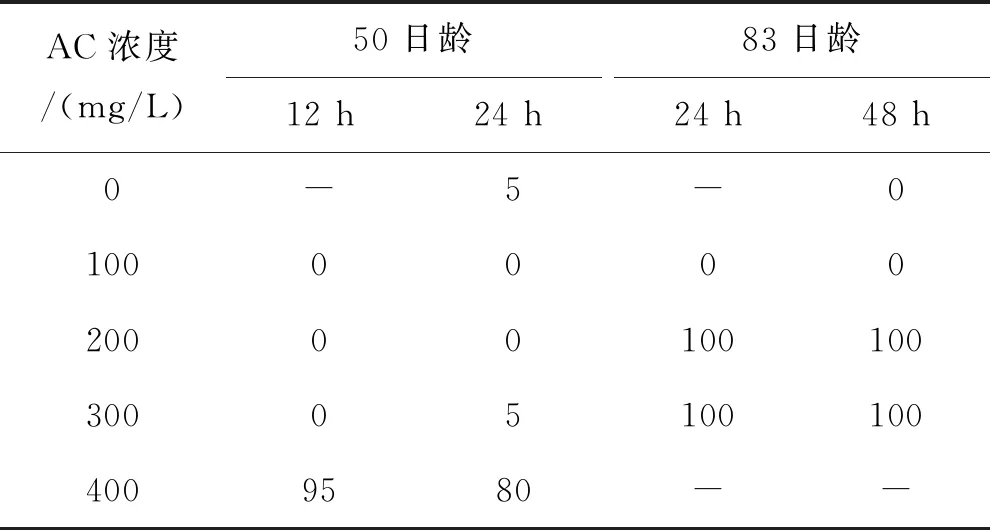
表4 AC重復標記短須裂腹魚稚魚的死亡率
2.4 ARS重復標記
ARS重復標記的耳石在綠光下均能觀察到兩個橘紅色標記環(圖3,B),標記率100%;同樣的標記條件,微耳石和星耳石的標記質量較高,矢耳石次之(圖5);首次標記和再次標記的標記質量差異很小。浸泡時間12 h的組,100~300 mg/L的ARS溶液造成的死亡率與空白對照組相同(均為1尾),400 mg/L 的ARS造成的死亡率則為100%;83日齡重復標記時將浸泡時間延長為48 h,100 mg/L組死亡率僅為5.88%(死亡1尾),但200、300 mg/L組的死亡率明顯升高,分別為41.18%、100%。浸泡時間24 h的組,100和200 mg/L的ARS溶液在首次標記和重復標記均沒有造成魚體死亡,300、400 mg/L組則在首次標記時就表出現極高死亡率(表5)。

圖5 ARS重復標記短須裂腹魚的標記質量
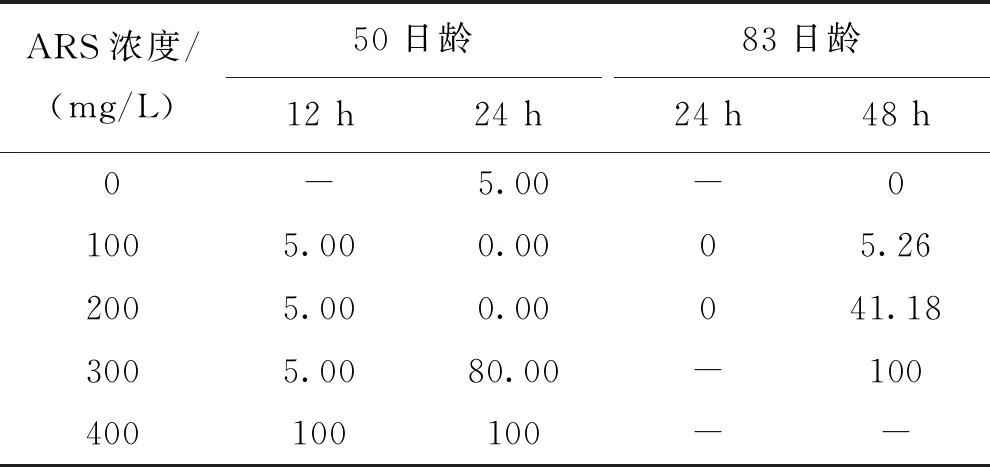
表5 ARS重復標記短須裂腹魚稚魚的死亡率
2.5 TC、CAL、AYG和AAB標記
使用TC、CAL、AYG和AAB浸泡的短須裂腹魚均沒有在耳石觀察到熒光標記(圖1)。50~300 mg/L的TC溶液浸泡標記8日齡短須裂腹魚仔魚造成的死亡率極低,僅300 mg/L這組為3.33%(1尾),低于空白對照組的6.67%(2尾)(表6)。CAL造成的死亡率較低,直至800 mg/L才造成死亡率激增。相比之下,AYG、AAB則分別在50、100 mg/L時即已出現較高死亡率(表6)。
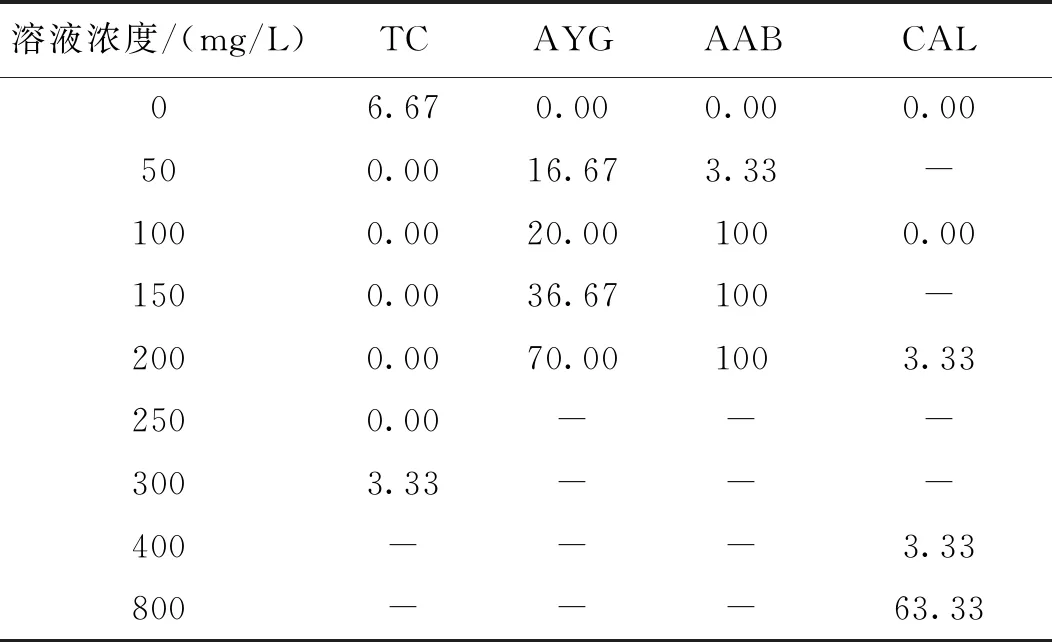
表6 其他熒光染料浸泡標記短須裂腹魚的死亡率
3 討論
3.1 6種熒光染料標記效果分析
本研究結果表明,使用TC、CAL、AYG和AAB溶液浸泡短須裂腹魚,均未在其耳石上形成有效的熒光標記,僅AC和ARS形成了非常明顯的熒光標記。四環素及其多種鹽類實際上是一類抗生素,能與堿土金屬離子形成有熒光的配合物,在醫學檢驗中常被用作熒光標記物,也是水產養殖常見用藥,其中較早應用于魚類熒光標記放流研究的是土霉素(oxytetracycline,OTC)、TC[18]。通過浸泡或者投喂的方式,OTC、TC被魚體吸收代謝后沉積在鰭條、脊椎骨、耳石等部位,在紫外光下可觀察到黃色熒光[19-20]。但一些研究發現四環素類的熒光標記容易受組織自體熒光的影響,會造成標記識別率降低[19,21-22]。為了獲得優質標記,有時溶液濃度需要很高(500~600 mg/L以上),而高濃度又會造成高死亡率[19-21]。TC標記胭脂魚(Myxocyprinusasiaticus)[23]的效果很差、標記率很低,標記重口裂腹魚(Schizothoraxdavidi)[24]時則和本研究結果類似,檢測不到標記。出現這種情況,可能是由于四環素類標記易受水中鈣、鎂等離子螯合和酸堿度的影響,以及所用四環素種類和物種差異。對比已發表的研究結果發現,與AC、ARS的橘紅色熒光相比,四環素類的黃色熒光不明顯,在識別時容易造成誤判,再加之人們對于抗生素的擔憂,OTC、TC很難在魚類標記放流中大規模應用。
在使用CAL浸泡標記孔雀魚(Poeciliareticulata)[25]、許氏平鲉(Sebastesschlegelii)[26]等魚類的研究中,標記部位在藍光下發出綠色熒光。本研究卻沒有在耳石上觀察到標記,分析可能有兩種原因:一是用于標記和養殖的水槽透光性較好,陽光照射使CAL降解“褪色”;二是實驗結束后魚體保存在酒精中較長時間才摘取耳石檢測,而CAL溶于酒精,詳細原因有待更多實驗分析確證。不過,一些研究表明,CAL標記不是很穩定,易衰減,而且與TC標記有著類似缺點,即熒光較弱且易受背景熒光影響,讀取較為困難,因而在一定程度上限制了它的應用[25,27]。
AYG、AAB是茜素的衍生物,常被用作生化分析中的染色劑[28-29]。這兩種染料不僅沒有形成有效的熒光標記,而且對短須裂腹魚表現出很大的毒性。在本研究中,使用100mg/L的AAB浸泡短須裂腹魚在最初的幾個小時內就全部死亡。推測可能是因為AAB、AYG溶液呈酸性,導致魚體應激反應過于強烈造成死亡。
ARS、AC主要通過與鈣離子形成絡合物經魚體代謝吸收沉積在骨骼、鰭條等組織上,標記部位在綠光下(波長)呈鮮艷的橘紅色,與背景熒光區分非常明顯[8]。ARS、AC沉積在骨性材料中后較為穩定,再加上耳石受頭骨保護和不被重吸收的特性[30],因而ARS、AC耳石標記可以保持很長時間(通常可達數年),或可伴隨魚類終生[9,31-33]。使用較低濃度的AC或ARS就可以獲得優質標記,甚至在可見光下也能觀察到標記。不過,在同樣的條件下,ARS不僅比AC標記質量更高,而且其價格僅為AC的十分之一左右,因此更適宜推廣使用。
3.2 AC和ARS對短須裂腹魚早期魚苗存活、生長的影響及適宜標記條件
AC和ARS已經在布氏棘鯛(Acanthopagrusbutcheri)[9]、歐洲鰻鱺(Anguillaanguilla)[34]等魚類的大規模標記放流中應用。但這兩種熒光物質均對魚體有一定毒性,浸泡過程中魚體可能會因熒光物質的脅迫作用而產生氧化應激反應,造成機體損傷,甚至出現死亡[11,35]。許多研究表明,熒光物質的種類、溶液濃度、浸泡時間、魚類種類和魚體規格等多種因素,均不同程度地影響著死亡率及標記質量[9-10,19,35-38]。一般情況下,對于同種熒光物質,標記造成的死亡率和標記質量與溶液濃度、浸泡時間成正相關,與魚體規格大小成負相關[10,36,38-39]。王臣等[40]曾對ARS標記大麻哈魚胚胎的數據進行曲線擬合,并結合安全評估,得出適宜的標記條件是濃度25.9~40 mg/L、浸泡時間15.6~24 h。AC或ARS溶液濃度和浸泡時間合適,不會對魚類生存、生長造成明顯負面影響[26,34,39]。在本研究中,使用50~300 mg/L的AC標記20日齡短須裂腹魚16 d后,除300 mg/L、24 h組的全長明顯低于空白對照組外,其他各組與空白對照組均無顯著差異,但200 mg/L及以下的濃度更不易造成魚苗死亡。
AC和ARS化學性質相近,但本研究結果表明ARS浸泡標記造成的魚體死亡率略高于AC,在Beckman等[41]、Yang等[10]研究中也有類似發現。50日齡短須裂腹魚在首次標記時,AC組在400 mg/L才出現大量死亡,ARS則是在300 mg/L。這可能是由于AC溶于水對pH影響較小,ARS溶液卻呈弱酸性,再加之魚苗弱小,容易出現急性應激性死亡[9,11]。然而,一個月后(83日齡)以同樣的條件再次標記時,濃度200 mg/L、浸泡24h的AC組魚苗全部死亡,而ARS組卻沒有出現死亡。霍來江[11]用100~400mg/L的ARS標記中華倒刺鲃幼魚時發現,ARS造成的組織損傷10 d后基本恢復,500 mg/L時造成的損傷則很難恢復。由此可以推測,濃度200 mg/L時,AC造成短須裂腹魚早期魚苗出現急性應激性死亡的可能性低于ARS,但對魚苗機體損傷程度可能略高于ARS,需要較長時間恢復。
魚類在早期生長階段代謝快,規格小,便于集中,是實施標記的理想時期,但此時魚體抵抗力也很弱。尤其是大規模應用時,魚苗生長水平和健康水平不可能完全一致,選擇標記條件需要格外謹慎。綜合本研究和其他研究的結果,本研究推薦的浸泡標記短須裂腹魚早期魚苗(仔魚、稚魚及規格較小的幼魚)的安全的條件為AC或ARS溶液50~100 mg/L,浸泡12~24 h。并且,在魚苗規格較小、體質較弱時盡量采用該條件的低限,在魚苗規格較大、抵抗力較強時可采用高限。為進一步確認條件是否合適,在大規模應用之前,還必須隨機抽樣對待標記群體進行預試驗。按照這種方式,Yang等[42]曾在2014年使用ARS濃度70 mg/L、浸泡24 h的條件標記了7 000尾短須裂腹魚(全長23.52 mm±1.50 mm),2015年使用ARS濃度30~50 mg/L、浸泡24 h的條件標記60萬尾(全長20.85 mm±1.41 mm),標記質量均在3以上,魚苗死亡率低且沒有明顯升高,也沒有對其后續生長造成明顯負面影響。
4 結論
本研究表明ARS和AC是目前標記短須裂腹魚耳石效果很好的熒光物質,標記早期魚苗的合適條件為50~100 mg/L濃度浸泡12~24 h,不會對魚體存活、生長造成明顯影響。而TC、CAL、AYG、AAB等熒光物質則沒有在耳石上產生有效的熒光標記,不適于標記短須裂腹魚。

