通心絡膠囊對大鼠低壓低氧暴露后炎癥反應和腦組織水腫及認知功能的影響
劉鵬飛胡艷婷姜靜雯趙 晟鄧 會薛新穎潘 磊崔 磊王 勇喬 輝李天佐趙斌江*
(1.首都醫科大學附屬北京世紀壇醫院,北京 100038;2.北京急救中心,北京 100038)
低壓低氧導致的認知障礙及腦水腫是高原環境急性期一種常見的表現類型,也是高原相關性腦病的病理基礎[1]。 大腦對缺氧的耐受力差,低氧會出現形態學異常,炎癥與應激反應,代謝紊亂[2]。部分患者可以出現神經心理障礙,包括焦慮、抑郁、睡眠障礙,認知損傷,反射遲鈍等[3]。 既往研究表明,高海拔暴露引起的氧化應激及炎癥反應是高原腦病發生、發展的關鍵因素[4-5]。 嚴重的炎癥導致炎癥因子的過度釋放,包括白細胞介素(IL-1β)、腫瘤壞死因子(TNF-α)、IL-6[5-6]。 這些介質可進一步誘發血腦屏障損傷、腦水腫和細胞凋亡。 這些細胞因子受到 TLR-4/MyD88/NF-κB 信號通路的調控[7],所以本研究選擇 TLR-4/MyD88/NF-κB 信號通路與高原腦病之間的關系。
通心絡是一種廣泛應用于臨床的中藥制劑,主要成分包括人參,水蛭,全蝎等[8]。 近年來研究發現通心絡可以抗氧化應激,抗炎,改善內皮功能,目前臨床中廣泛應用于心腦血管疾病[9-10]。 但是其對低壓低氧導致的腦水腫及認知障礙并無明確報道。 因而本研究擬建立低壓低氧環境模擬高原模型,從TLR-4/MyD88/NF-κB角度揭示可能的作用機制,為臨床高原腦病的防治提供一定的實驗依據。
1 材料和方法
1.1 實驗動物
成年雄性 Sprague-Dawley 大鼠 64 只(8 周齡,180~220 g,清潔級)購置于北京維通利華實驗動物技術有限公司[SCXK(京)2016-0006]。 所有大鼠飼養于北京世紀壇醫院動物實驗室,所有操作均在世紀壇醫院動物屏障設施內進行[SYXK(京)2017-0025]。 本實驗已經通過北京世紀壇醫院動物實驗倫理委員會批準(2019 年科研倫審第(49)號)。 本實驗方案符合中國衛生部《動物管理規定》(2001 年第55 號文),并且按照實驗動物“3R”原則執行。
1.2 主要試劑與儀器
通心絡購置于石家莊以嶺藥業股份有限公司(批號為090226),經高效液相色譜(HPLC)和氣相色譜(GC)分析鑒定,通心絡的主要化學成分為人參皂苷Rg1、人參皂苷b1、異龍腦、冰片、芍藥苷、紅棗苷A、紅棗苷B,具有多種生物活性。 兔抗TLR-4 多克隆抗體(ab217274,Abcam,英國);兔抗 MyD88(ab2064,Abcam,英國);兔抗 p-NF-κB p65 多克隆抗 體 ( ab16502, Abcam, 英 國 ); 兔 抗-IκB-α(ab32518,Abcam,英國)單克隆抗體;兔抗-AQP4 多克隆抗體(ab125049,Abcam,英國);兔抗-MMP9-單克隆抗體(ab58803,Abcam,英國);β-actin 一抗(ab8227,Abcam,英國);白介素(IL)-1β、IL-6 和腫瘤壞死因子(TNF)-α 酶聯免疫吸附實驗(ELISA)試劑盒購置于武漢伊萊瑞特生物科技股份有限公司(批號:E-EL-R0012c,E-EL-R0896c,E-EL-R2856c);光學顯微鏡(Olympus,徠卡,德國)。
1.3 實驗方法
1.3.1 實驗分組
實驗開始前,64 只成年雄性Sprague-Dawley 大鼠在溫度(23±2)℃、濕度(55%~60%)、光照/暗循環12 h 的空調環境中適應性飼養7 d,并飼喂實驗室標準飼料和水。 適應期結束后,所有大鼠在水迷宮(morris water maze,MWM)中進行5 d 的定位航行訓練,形成記憶。 然后隨機分為四組,每組16 只。正常組(C):飼養在常壓常氧環境中,給予0.9%生理鹽水灌胃 7 d,每天1 次,作為對照;通心絡組(TXL):飼養在常壓常氧環境中,予1.6 g/(kg·d)通心絡灌胃7 d,每天1 次;低壓低氧組(HH):飼養在低壓低氧環境中,予0.9%生理鹽水灌胃7 d,每天1 次;低壓低氧+通心絡組(HH-TXL):飼養在低壓低氧環境中,予1.6 g/(kg·d)通心絡灌胃7 d,每天1 次。 低壓低氧暴露7 d 后,每組隨機取6 只大鼠進行腦水含量測定,其余大鼠大鼠進行曠場實驗和水迷宮空間探索實驗。
1.3.2 低壓低氧環境建立
通過動物減壓艙模擬海拔6000 m 高空,保持光照/黑暗循環12 h,氣壓為50 kPa,含氧量為10%(與海拔6000 m 相同)的環境,溫度和濕度保持在25℃~27℃,55%~60%。 用新鮮空氣(5~6 L/min)持續沖洗,補充大鼠消耗的O2,去除大鼠產生的CO2。 在30 min 的時間內,開始上升到目標高度的速率為 3 m/s。 每天上午 10 ∶00 打開腔室 1 h,補充食物、水、填充物和通心絡處理。 大鼠連續7 d 暴露于6000 m 的環境中。
1.3.3 曠場實驗
將大鼠置于曠場(100 cm×100 cm×50 cm)中央(上海玉研科學儀器有限公司,上海),內壁涂成黑色。 活動由視頻跟蹤系統自動記錄,曠場分為中心區域和周圍區域。 所有大鼠在曠場內探索5 min,記錄大鼠走行的全程距離,記錄大鼠在中心區域停留的時間。 每只大鼠在測試結束時,用75%的乙醇擦拭曠場,以避免嗅覺線索的出現。
1.3.4 水迷宮實驗
水迷宮實驗包括兩部分,定位航行和空間探索實驗。 采用Morris 水迷宮(上海玉研科學儀器有限公司,上海)(MWM)進行定位航行和空間探索測試。 圓形水池直徑180 cm,深度60 cm,注水至50 cm 高度(溫度22℃~24℃)。 水迷宮在概念上被平均劃分為四個象限,標記為:I,II,III,IV。 在第III 象限中心,水面以下2 cm 處有一逃生平臺。 水迷宮裝置上方設置了攝像頭和視頻跟蹤系統,監控并記錄大鼠的游泳軌跡。 在低壓低氧環境暴露前,所有大鼠均進行5 d 的定位航行實驗。 在每次實驗中,大鼠面對池壁,被隨機放置在四個象限之一的水中。在每次實驗中,初始象限的順序是不同的。 所有老鼠允許在60 s 內找到隱藏的平臺。 如果老鼠在60 s內沒有找到平臺,則引導大鼠到達平臺,并在平臺上停留10 s。 記錄并計算大鼠的逃逸潛伏期(s)、游泳距離(cm)和平均速度(mm/s)。 在每個實驗結束時,將大鼠擦干放進籠子里。 在7 d 低壓低氧環境暴露結束后,進行空間探索實驗。 撤掉平臺,將大鼠面向池壁,從第I 象限放入池中,跟蹤60 s。 記錄大鼠通過原平臺區域的次數,原平臺所在象限停留的時間(s),及游泳速度(mm/s)。
1.3.5 腦水含量測定
采用干濕重法測定大鼠大腦含水量。 每組隨機取6 只,處死,然后完整游離出兩個大腦半球,稱重記錄濕重。 然后在100℃電熱鼓風烘箱中烘干24 h,測定干重。 腦含水量(%)的計算公式為:(濕重-干重)/濕重×100%。
1.3.6 蛋白印跡
在行為學測試結束后,大鼠處死,然后完整游離海馬組織,置于-80℃備用。 取部分海馬組織駕馭組織裂解液,研磨,12000 r/min×5 min 離心,取上清。 采用Bradford 法檢測相對蛋白濃度。 然后加入緩沖液,取50 μg 蛋白質樣品采用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)進行分離,轉移至PVDF 膜。 然后用5%脫脂奶粉封閉,TBST 漂洗,加入兔抗 TLR-4 多克隆抗體(1 ∶500,Abcam,英國),兔抗 MyD88(1 ∶1000,Abcam,英國),兔抗 p-NF-κB p65 多克隆抗體(1 ∶2000,Abcam,英國),兔抗-IκB-α(1 ∶2000,Abcam,英國)單克隆抗體,兔抗-AQP4 多克隆抗體(1 ∶2000,Abcam,英國),兔抗-MMP9-多克隆抗體(1 ∶1000,Abcam,英國)以及 β-actin 一抗(l:1000,Abcam,英國)。 然后與膜在4℃孵育過夜。 再用辣根過氧化物酶結合山羊抗兔IgG 抗體(1 ∶500,Abcam,英國)或辣根過氧化物酶偶聯兔抗小鼠IgG抗體(1 ∶500,Abcam,英國)二抗孵育膜,用含0.1%Tween 20(TBST)的Tris 緩沖鹽水洗三次后1 h。 使用凝膠成像和分析系統(Amersham 公司,美國)捕獲和分析波段的化學發光信號(ECL kit,Thermo Fisher Scientific,美國)進行曝光,拍照。 研究中采用Image J 軟件分析條帶,將目的條帶灰度值與內參βactin 條帶灰度值比值反映目的蛋白的表達水平。
1.3.7 腦組織病理染色
行為學實驗后,每組取2 只大鼠,麻醉后,暴露心臟,在右心耳剪切一小口,依次用0.9%生理鹽水和4%多聚甲醛經升主動脈進行灌注,清除組織中血液。 然后迅速游離大腦并置于4%多聚甲醛固定,經100%、90%、70%分級乙醇脫水,二甲苯玻璃化,石蠟包埋,制成5 μm 厚的石蠟切片備用。 石蠟切片經二甲苯脫蠟,分級乙醇浸泡,蘇木精染色5 min,伊紅染色2 min,脫水。 在×400 放大倍數的光學顯微鏡下觀察海馬CA1 區形態。
1.3.8 酶聯免疫吸附實驗
行為學實驗后采集血液2 mL,海馬30 mg。 應用特異性酶聯免疫吸附測定試劑盒檢測血液及海馬組織中的白介素(IL-1β)、腫瘤壞死因子(TNF-α)和IL-6 水平。 具體操作依照試劑盒中的說明執行。
1.4 統計學方法
采用SPSS 22.0 軟件進行統計分析。 數據以平均數±標準差()形式記錄。 行為學實驗各項指標、腦水含量及炎癥相關蛋白水平組間比較比較采用單因素方差分析,組間兩兩比較采用Bonferroni多重檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 通心絡干預及低壓低氧暴露對大鼠體重的影響
四組大鼠實驗前體重比較,無統計學差異(P>0.05),低壓低氧暴露7 d 后,四組大鼠組間比較體重無明顯統計學差異(P>0.05)。 見表1。
表1 四組大鼠實驗前后體重的變化(n=16, )Table 1 Body weight of rats in the four groups before and after the HH exposure
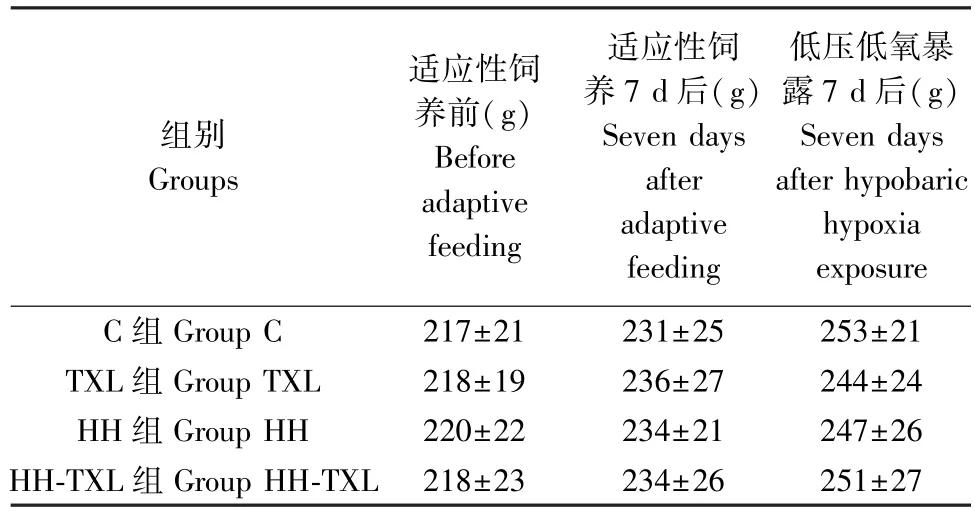
表1 四組大鼠實驗前后體重的變化(n=16, )Table 1 Body weight of rats in the four groups before and after the HH exposure
注:C:對照組;TXL:1.6 g/(kg·d)通心絡干預;HH:低壓低氧組;HHTXL:低壓低氧+1.6 g/(kg·d)通心絡組。 下同。Note. C, Control group. TXL, TXL treatment with the dose of 1.6 g/(kg·d). HH, Hypobaric hypoxia exposure. HH-TXL, Hypobaric hypoxia exposure and TXL treatment with the dose of 1.6 g/(kg·d). The same as below.
組別Groups適應性飼養前(g)Before adaptive feeding適應性飼養7 d 后(g)Seven days after adaptive feeding低壓低氧暴露7 d 后(g)Seven days after hypobaric hypoxia exposure C 組 Group C 217±21 231±25 253±21 TXL 組 Group TXL 218±19 236±27 244±24 HH 組 Group HH 220±22 234±21 247±26 HH-TXL 組 Group HH-TXL 218±23 234±26 251±27
2.2 通心絡干預及低壓低氧暴露對大鼠一般行為的影響
低壓低氧暴露7 d 后,大鼠進行曠場實驗,評價其一般行為表現的變化。 四組間比較,低壓低氧暴露對大鼠運動的整體距離和中心區域停留時間無明顯影響(P>0.05)。 通心絡干預后,對正常組及低氧低氧組大鼠,均不影響曠場實驗中大鼠運動的整體距離和中心區域停留時間(P>0.05),見表2。
表2 四組大鼠曠場實驗的結果(n=10, )Table 2 Results of open field test in the four groups
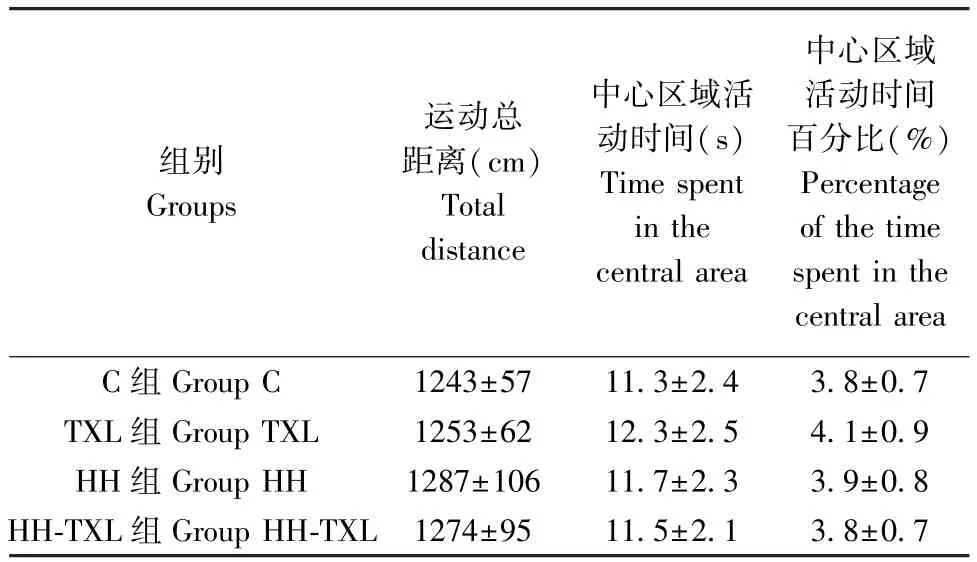
表2 四組大鼠曠場實驗的結果(n=10, )Table 2 Results of open field test in the four groups
組別Groups運動總距離(cm)Total distance中心區域活動時間(s)Time spent in the central area中心區域活動時間百分比(%)Percentage of the time spent in the central area C 組 Group C 1243±57 11.3±2.4 3.8±0.7 TXL 組 Group TXL 1253±62 12.3±2.5 4.1±0.9 HH 組 Group HH 1287±106 11.7±2.3 3.9±0.8 HH-TXL 組 Group HH-TXL 1274±95 11.5±2.1 3.8±0.7
2.3 對大鼠空間記憶的影響
采用Morris 水迷宮(Morris water maze, MWM)測試評價大鼠海馬相關的空間記憶能力。 低壓低氧暴露前進行訓練實驗。 四組在同一時間點的逃避潛伏期比較,差異無統計學意義(P>0.05)。 訓練第5 天的潛伏期明顯短于第1 天時的潛伏期,提示通過訓練大鼠行成記憶(P<0.05),見表3。
表3 四組大鼠定位航行實驗結果(n=10, )Table 3 Results of navigation experiments in the MWM test of the rats
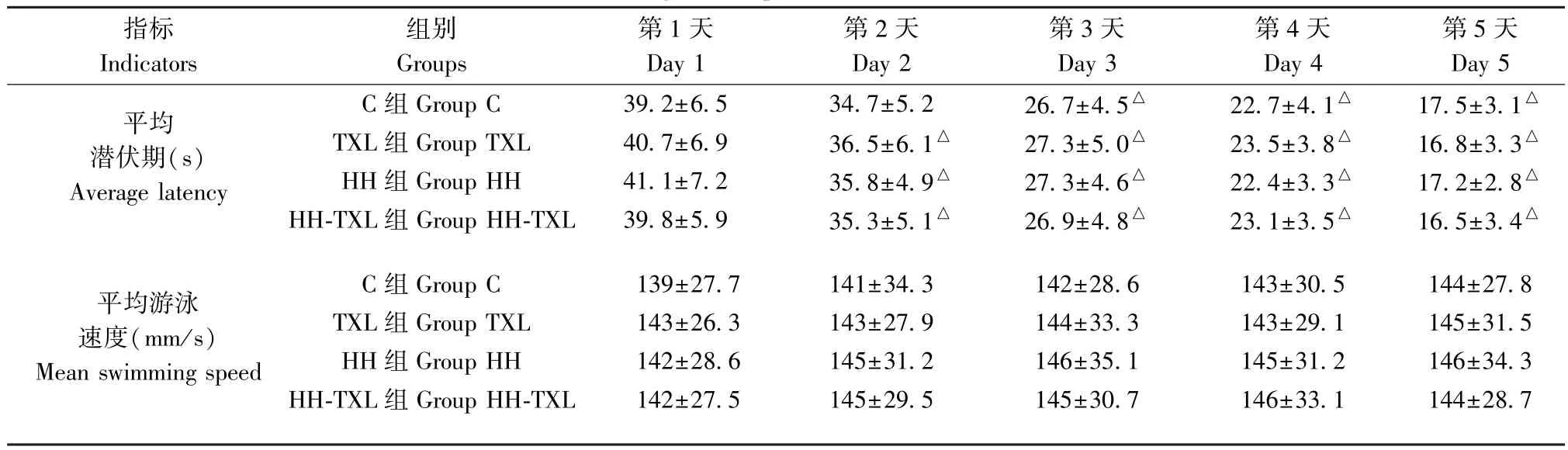
表3 四組大鼠定位航行實驗結果(n=10, )Table 3 Results of navigation experiments in the MWM test of the rats
注:與 C 組相比,*P<0.05;HH-TXL 與 HH 組比較,#P<0.05;與 T1 時間點比較,△P<0.05。 下同。Note. Compared with group C,*P<0.05.Group HH-TXL compared with group HH,#P<0.05.Compared with the time of T1,△P<0.05. The same as below.
指標Indicators組別Groups第1 天Day 1第2 天Day 2第3 天Day 3第4 天Day 4第5 天Day 5平均潛伏期(s)Average latency C 組 Group C 39.2±6.5 34.7±5.2 26.7±4.5△ 22.7±4.1△ 17.5±3.1△TXL 組 Group TXL 40.7±6.9 36.5±6.1△ 27.3±5.0△ 23.5±3.8△ 16.8±3.3△HH 組 Group HH 41.1±7.2 35.8±4.9△ 27.3±4.6△ 22.4±3.3△ 17.2±2.8△HH-TXL 組 Group HH-TXL 39.8±5.9 35.3±5.1△ 26.9±4.8△ 23.1±3.5△ 16.5±3.4△平均游泳速度(mm/s)Mean swimming speed C 組 Group C 139±27.7 141±34.3 142±28.6 143±30.5 144±27.8 TXL 組 Group TXL 143±26.3 143±27.9 144±33.3 143±29.1 145±31.5 HH 組 Group HH 142±28.6 145±31.2 146±35.1 145±31.2 146±34.3 HH-TXL 組 Group HH-TXL 142±27.5 145±29.5 145±30.7 146±33.1 144±28.7
在低壓低氧暴露結束后的空間探索實驗中,與正常組比較,低壓低氧暴露可顯著減少大鼠穿越平臺次數和在目標象限的停留時間(P<0.05)。 而1.6 g/(kg·d)通心絡干預后,大鼠穿越平臺次數和在目標象限的停留時間明顯長于低壓低氧組大鼠(P<0.05);但通心絡對正常組大鼠空間探索實驗無明顯影響(P>0.05),見表4。
表4 四組大鼠空間探索實驗結果(n=10, )Table 4 Results of probe trial in the MWM test of the rats

表4 四組大鼠空間探索實驗結果(n=10, )Table 4 Results of probe trial in the MWM test of the rats
組別Groups原平臺所在象限停留時間(s)The time spent in the quadrant with the original platform經過原平臺次數(次數)Number of crossings (time)平均游泳速度(cm/s)Mean swimming speed C 組 Group C 36.5±6.6 5.3±1.2 143±26.8 TXL 組 Group TXL 37.1±7.1 5.1±0.8 145±31.2 HH 組 Group HH 19.7±4.1* 1.2±0.8* 143±29.7 HH-TXL 組 Group HH-TXL 28.1±4.8*# 3.3±0.9*# 147±27.3
2.4 對大鼠腦組織水腫的影響
與正常組比較,低壓低氧組大鼠腦水含量明顯升高,海馬組織水通道蛋白4(AQP4)及基質金屬蛋白酶-9(matrix metalloproteinases-9,MMP-9)表達明顯增強(P<0.05);1.6 g/(kg·d)通心絡干預后,大鼠腦水含量、海馬組織AQP4 及MMP-9 表達明顯低于低壓低氧組大鼠(P<0.05)。 而對正常組大鼠,通心絡干預后,大鼠腦水含量、海馬組織 AQP4 及MMP-9 表達無明顯變化(P>0.05),見表5 及圖1。
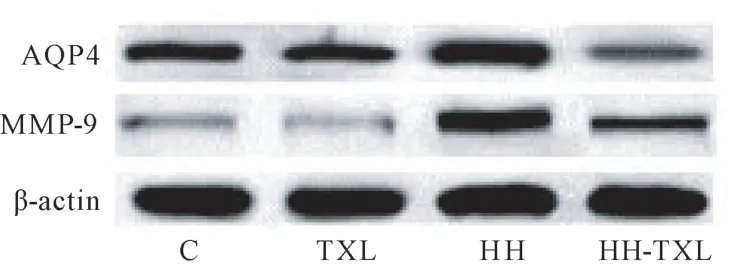
圖1 Western blot 檢測大鼠海馬AQP4 及MMP-9 的表達Figure 1 Immunoblots of AQP4 and MMP-9 proteins in the hippocampus of the rats
表5 四組大鼠腦水含量及海馬組織AQP4 和MMP-9 蛋白的表達( )Table 5 The brain water content, and the expression of AQP4 and MMP-9 protein inhippocampus of the rats
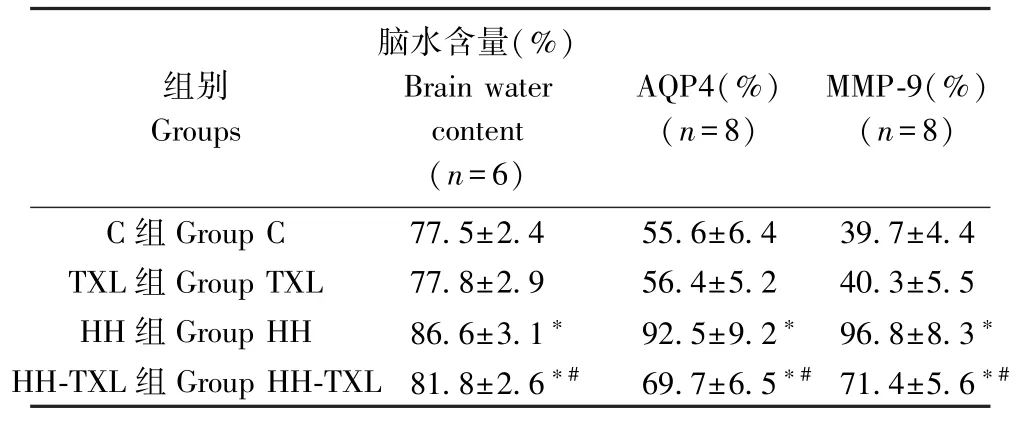
表5 四組大鼠腦水含量及海馬組織AQP4 和MMP-9 蛋白的表達( )Table 5 The brain water content, and the expression of AQP4 and MMP-9 protein inhippocampus of the rats
C 組 Group C 77.5±2.4 55.6±6.4 39.7±4.4 TXL 組 Group TXL 77.8±2.9 56.4±5.2 40.3±5.5 HH 組 Group HH 86.6±3.1* 92.5±9.2* 96.8±8.3*HH-TXL 組 Group HH-TXL 81.8±2.6*# 69.7±6.5*# 71.4±5.6*#
病理染色提示,正常組及單純通心絡組海馬區細胞排列整齊,邊界清晰,數量多,層次分明。 而低壓低氧組海馬區細胞稀疏,排列不規則,邊界模糊,細胞腫脹明顯。 通心絡干預后,神經元數目層次增多,邊界相對清晰,見圖2。
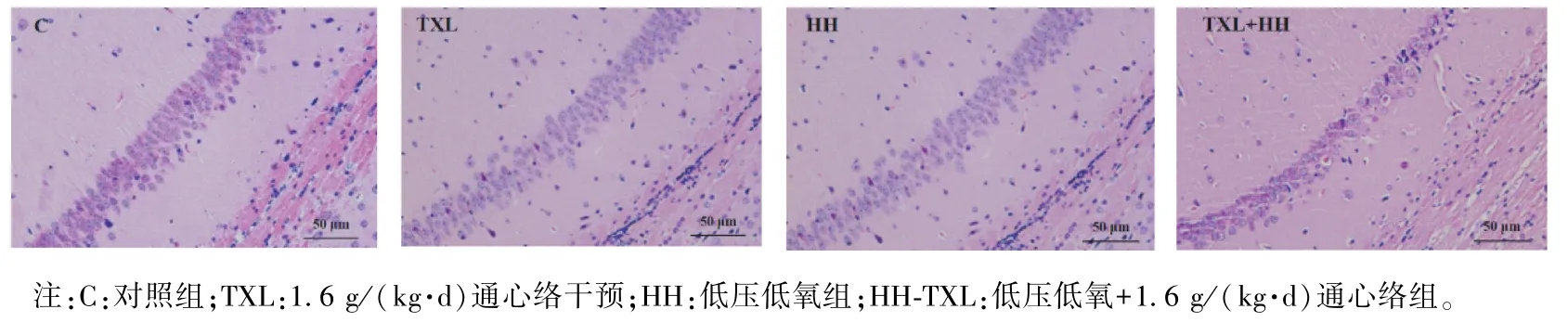
圖2 大鼠海馬組織蘇木精-伊紅染色Note. C, Control group. TXL,TXL treatment with the dose of 1.6 g/(kg·d). HH,Hypobaric hypoxia exposure. HH-TXL,Hypobaric hypoxia exposure and TXL treatment with the dose of 1.6 g/(kg·d).Figure 2 Hematoxylin-eosinstaining of rat hippocampus
2.5 對大鼠海馬 TLR-4/MyD88/NF-κB p65 通路的影響
與正常組比較,低壓低氧組大鼠海馬組織TLR-4、MyD88、p-NF-κB p65 蛋白的表達明顯升高(P<0.05),Iκ-Bα 的水平明顯降低(P<0.05);通心絡干預后,大鼠海馬組織 Iκ-Bα 的水平明顯升高(P<0.05),TLR-4、MyD88、p-NF-κB p65 蛋白的表達明顯降低(P<0.05)。 但是單純通心絡干預對TLR-4/MyD88/NF-κB p65 通路無明顯影響(P>0.05),見表 6 及圖3。
表6 四組大鼠海馬TLR-4、MyD88 和p-NF-κB p65 的表達(n=8, )Table 6 Expression of TLR-4、MyD88 and p-NF-κB p65 in hippocampus of rats
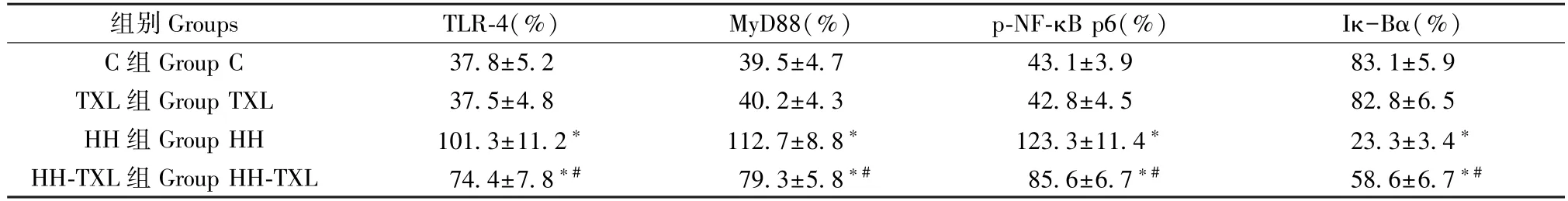
表6 四組大鼠海馬TLR-4、MyD88 和p-NF-κB p65 的表達(n=8, )Table 6 Expression of TLR-4、MyD88 and p-NF-κB p65 in hippocampus of rats
組別 Groups TLR-4(%) MyD88(%) p-NF-κB p6(%) Iκ-Bα(%)C 組 Group C 37.8±5.2 39.5±4.7 43.1±3.9 83.1±5.9 TXL 組 Group TXL 37.5±4.8 40.2±4.3 42.8±4.5 82.8±6.5 HH 組 Group HH 101.3±11.2* 112.7±8.8* 123.3±11.4* 23.3±3.4*HH-TXL 組 Group HH-TXL 74.4±7.8*# 79.3±5.8*# 85.6±6.7*# 58.6±6.7*#
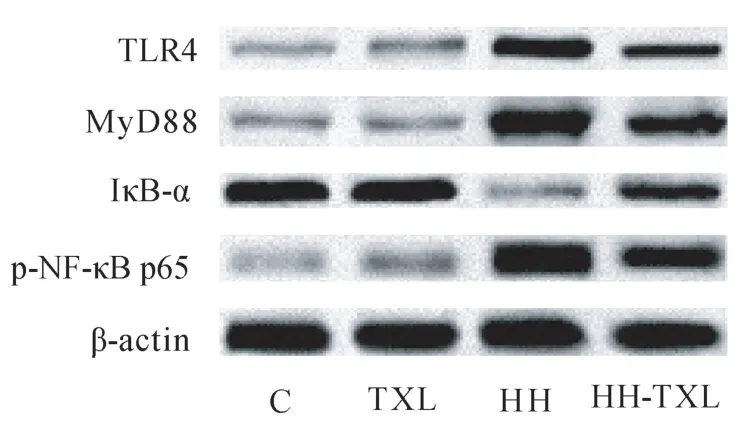
圖3 Western blot 檢測大鼠海馬TLR-4、MyD88、NF-κB p65 和 IκB-α 的表達Figure 3 Immunoblots of TLR-4、MyD88、NF-κB p65 and IκB-α proteins in the hippocampus of the rats
2.6 對大鼠外周血及海馬炎癥因子水平的影響
與正常組比較,低壓低氧暴露后大鼠海馬及血清 IL-1β,TNF-α 及 IL-6 的 水 平 明 顯 升 高 (P<0.05);1.6 g/(kg·d)通心絡干預后,大鼠血清及海馬組織的IL-1β, TNF-α 及IL-6 的水平較低壓低氧組明顯降低(P<0.05)。 單純通心絡干預對大鼠外周血及海馬炎癥因子水平無明顯影響(P>0.05),見表7。
表7 大鼠外周血及海馬組織IL-1β,TNF-α 和IL-6 的表達(n=8, )Table 7 Expression of IL-1β,TNF-α and IL-6 in hippocampus and serum of rats
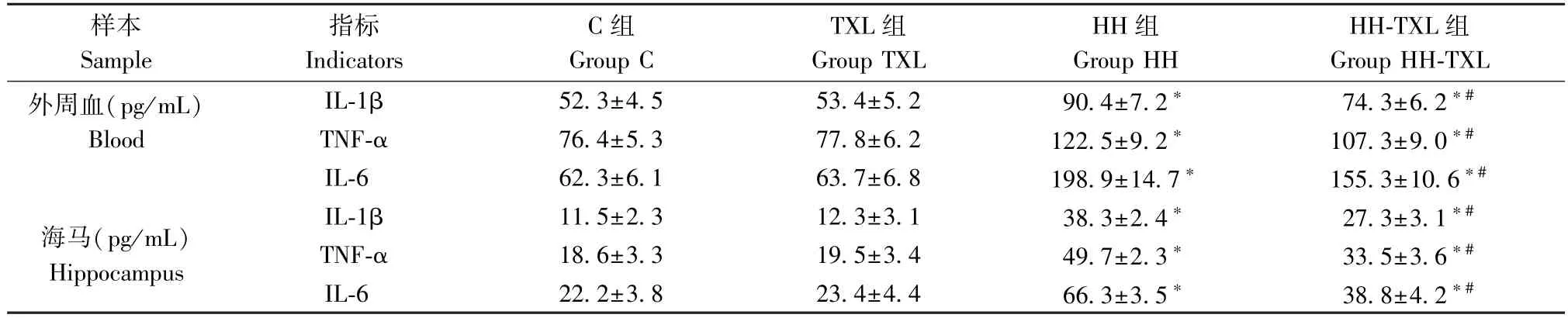
表7 大鼠外周血及海馬組織IL-1β,TNF-α 和IL-6 的表達(n=8, )Table 7 Expression of IL-1β,TNF-α and IL-6 in hippocampus and serum of rats
樣本Sample指標Indicators C 組Group C TXL 組Group TXL HH 組Group HH HH-TXL 組Group HH-TXL外周血(pg/mL)Blood IL-1β 52.3±4.5 53.4±5.2 90.4±7.2* 74.3±6.2*#TNF-α 76.4±5.3 77.8±6.2 122.5±9.2* 107.3±9.0*#IL-6 62.3±6.1 63.7±6.8 198.9±14.7* 155.3±10.6*#海馬(pg/mL)Hippocampus IL-1β 11.5±2.3 12.3±3.1 38.3±2.4* 27.3±3.1*#TNF-α 18.6±3.3 19.5±3.4 49.7±2.3* 33.5±3.6*#IL-6 22.2±3.8 23.4±4.4 66.3±3.5* 38.8±4.2*#
3 討論
隨著西部大開發的推進,越來越多的人因工作,旅游或其他原因暴露于高原環境下。 高原屬于低壓低氧環境,因而短期或長期暴露會引起不同程度的高原反應。 其中急性高原反應是指在高原暴露后數小時或數天內發生高原缺氧而引起的一系列臨床綜合征,包括輕度高原反應、急性腦水腫、急性肺水腫等[1-2];而高原腦水腫多屬于高原病的終末階段,患者表現為頭痛,惡心嘔吐,嚴重者可出現共濟失調,精神及認知、意識的改變。 因而如何有效的緩解高原反應,降低高原病的發生,具有重要的現實意義。
本研究中將大鼠置于低壓低氧環境中7 d,作為急性高原暴露模型[3-5]。 結果發現,與正常組比較,低壓低氧暴露7 d 后,腦水含量明顯增加,病理染色提示海馬區細胞腫脹,邊界模糊不清,細胞數量明顯減少。 提示低壓低氧暴露7 d 后,出現了明顯的腦組織水腫,同時行為學測試發現,大鼠認知功能明顯減退,這與既往研究結果相符。 早期研究同樣發現低壓缺氧暴露3 d、7 d 甚至14 d 后,大鼠出現明顯的腦組織水腫及認知功能障礙[11]。 同時研究檢測了海馬組織AQP4 及MMP9 的表達,發現低壓低氧暴露后,海馬組織AQP4 及MMP-9 水平明顯升高。 AQP4 廣泛分布于腦組織膠質細胞,血管內皮細胞等,在維持腦水平衡,穩定細胞微環境等方面發揮重要作用。 任何創傷,應激,低氧均可以導致AQP4 的異常表達,腦水腫發生[12]。 而 MMP-9 能夠有效降解細胞外基質,抑制血管基底膜蛋白表達,導致血腦屏障受損[12]。 因此,進一步證明低壓低氧暴露7 d 導致明顯的腦組織水腫。
對于高原導致的腦水腫如何有效的防治,目前尚無明確統一的定論。 前期有研究相繼報道了紅景天,七葉皂苷鈉等的保護作用。 同樣,通心絡也是中藥復方,由12 種中藥成分組成,在國內廣泛應用于動脈粥樣硬化、心絞痛、心肌梗死、缺血性中風等心腦血管疾病患者[13]。 多項研究表明,通心絡具有明顯的抗氧化、抗炎和抗血栓形成作用。 在腦缺血再灌注損傷模型等基礎研究中證實了通心絡可改善內皮功能,減少細胞凋亡,保護血腦屏障[8,14]。但是該藥物是否能在急性低壓低氧暴露的大鼠中發揮神經保護作用尚不清楚。 因而,本研究選擇通心絡作為干預方案。 研究顯示,與低壓低氧組相比,通心絡干預后,大鼠的空間參考記憶有明顯改善,同時海馬AQP4 及MMP-9 表達下降,腦含水量同樣明顯低于低壓低氧組。 以上結果提示,通心絡能夠有效緩解低壓低氧導致的腦組織水腫和認知功能障礙。 另外,在整個實驗過程中,所有大鼠未發生通心絡的肝、腎毒性,也未發生不良反應導致大鼠死亡,證明1.6 g/(kg·d)通心絡干預是安全可行的。
而對于高原腦水腫發生的分子機制尚未明確。近年來相繼有研究從形態學、生理學、生物化學及分子生物學的角度討論了急性高原腦水腫的發生機理[3-5]。 其中炎癥反應與氧化應激是較為認可的機制[5-6]。 早期研究報道急性低壓低氧暴露可促進NK 細胞的激活,血清細胞因子(包括 IL-6、IL-1β 和CRP)濃度升高[15]。 本研究同樣發現,急性低壓低氧暴露明顯上調海馬和血清中TNF-α、IL-1β 和IL-6的水平,提示低壓低氧急性暴露可導致顯著的外周及中樞炎癥反應。 而在通心絡干預后,外周血及海馬組織 TNF-α、IL-1β 和 IL-6 的水平明顯下降,證明通心絡具有有效的抗炎作用。
目前已發現有多種信號通路參與機體炎癥反應的調控。 其中 Toll 樣受體(Toll like receptor,TLR)是一種天然免疫受體,廣泛分布于巨噬細胞,淋巴細胞,單核細胞等[16]。 TLR4 是人類發現的第一個TLR 相關蛋白,其是介導內毒素/脂多糖應答反映的主要受體[17]。 TLR-4 作為LPS 的重要受體,通過MyD88 依賴的通路上調NF-κB 的表達,激活炎癥介質[18-19]。 MyD88 作為TLR-4 信號轉導的關鍵調控蛋白,可與 TLR-4 相互作用,激活 NF-κB。 同時反過來促進 IκB-α(NF-kappa-B 抑制劑 α)的磷酸化[20]。 IκB-α 與 REL 二聚體相互作用,抑制 NF-κB/REL 復合物參與炎癥反應[20]。 磷酸化 NF-κB(p-NF-κB)可誘導 IL-6、TNF-α 和 IL-1β 等細胞因子的表達[21]。 在一項缺血再灌注損傷研究中發現,TLR4 突變小鼠進行腦缺血再灌注損傷(I/R)造模時,其神經行為、腦水腫程度和促炎細胞因子分泌水平均有所緩解[17]。 同樣TLR-4 在應激下的大腦氧化和炎癥損傷中發揮重要作用[18]。 因而本研究選擇TLR4/MyD88/NF-κB 信號通路,探討通心絡可能的作用機制。 本研究發現,低壓低氧暴露后,海馬組織中 TLR-4、MyD88 和 p-NF-κB 的表達明顯增加,而 IκB-α 表達水平明顯下降。 通心絡干預后,能夠明顯抑制低壓低氧誘導的TLR4/MyD88/NF-κB通路活化。 對于正常組大鼠,通心絡干預后對TLR4/MyD88/NF-κB 通路相關蛋白的表達無明顯影響。 以上結果證實通心絡能夠有效抑制低壓低氧環境下TLR4/MyD88/NF-κB 信號通路的激活及海馬的炎癥反應,進一步降低腦水腫和認知功能障礙的發生,發揮腦保護作用。
同時,本研究也存在一定的局限性。 首先,本研究討論了通心絡干預對大鼠低壓低氧暴露7 d 時腦水腫及認知功能的影響。 而低壓低氧環境中不同暴露時間(例如 第 3、7、14、21、28 天)下腦組織的變化情況尚未探討。 其次研究初步探討了通心絡的腦保護作用。 在后續的研究中,將進一步探討不同劑量通心絡干預對腦功能的影響,提供更高質量的證據。 另外,本研究初步從神經炎癥角度探討了低壓低氧導致認知障礙,腦水腫的可能機制,及通心絡發揮腦保護作用的抗炎機制。 但炎癥,血腦屏障,腦水腫這三部分之間如何相互作用還有待進一步探討。
綜上所述,低壓低氧可激活TLR4-MyD88-NF-κB 信號通路,引起外周及海馬炎癥,最終導致腦水腫及認知障礙的發生;而通心絡干預可以有效抑制TLR4-MyD88-NF-κB 通路的活化,減輕外周和中樞炎癥反應,最終改善急性低壓低氧暴露導致的腦組織水腫及認知障礙。

