綠僵菌信息素基因(MAT1)功能研究
張二豪 趙潤東 祿亞洲
摘要 以綠僵菌為試驗材料,通過同源重組的方法構建信息素基因(MaMAT1)敲除和回復載體,利用農桿菌介導轉化法獲得MaMAT1基因敲除和回復菌株,并對ΔMaMAT1菌株孢子萌發率、產孢量、抗濕熱、抗紫外及毒力進行分析。結果表明,與WT菌株相比,ΔMaMAT1菌株的萌發率、抗濕熱和抗紫外能力無顯著差異,但其產孢量、毒力顯著降低。
關鍵詞 蝗綠僵菌;信息素;敲除;毒力
中圖分類號 S-476? 文獻標識碼 A? 文章編號 0517-6611(2021)12-0094-04
doi:10.3969/j.issn.0517-6611.2021.12.024
開放科學(資源服務)標識碼(OSID):
Functional Study of MaMAT1 in Metarhizium acridum
ZHANG Er hao, ZHAO Run dong, LU Ya zhou
(Food Science College, Tibet Agriculture and Animal Husbandry University, Linzhi, Tibet 860000)
Abstract Using Metarhizium acridum as the experimental material, the function of MaMAT1, knock down and complementation of MaMAT1 were constructed by homologous recombination, ΔMaMAT1 and CP strains were obtained by Agrobacterium tumefaciens mediated transformation, and the germination, sporulation, UV B, heat shock tolerance and virulence of MaMAT1 were analyzed. The results showed that the disruption of MaMAT1 did not affect the germination, UV B and heat shock tolerance, however, the sporulation and virulence significantly decreased compared to WT.
Key words Metarhizium acridum;MAT1;Knock down;Virulence
昆蟲病原真菌作為一類潛在生防微生物,在害蟲防治過程中扮演著重要角色。截至2017年,已有200多種昆蟲病原真菌被注冊并用于害蟲防治[1]。蝗綠僵菌(Metarhizium acridum)作為一種重要的昆蟲病原真菌,在亞洲、非洲和澳洲已被廣泛用于蝗蟲和蚱蜢的防治[2-4]。蝗綠僵菌作為昆蟲病原真菌的模式生物,其侵染致病過程具有明顯的特征,即孢子萌發、菌絲發育、附著孢分化、浸染釘的形成及昆蟲體內定殖[5-7]。但其較高的生產成本、較長的致死時間限制其大規模應用,因此提高昆蟲病原真菌產孢量,增強毒力、縮短發酵時間成為人們研究的熱點。
“信息素(荷爾蒙)”在真核生物中是遠距離作用的化學物質。普遍認為“信息素”是性別因子,控制性別和形態形成[8]。真菌中,雌性或雄性菌絲產生甾醇類信息刺激雄性或雌性器官的產生[9]。在植物病原真菌Phytophthora 和 Pythium上,甾醇類信息調節有性生殖和無性生殖。如在Pythium sylvaticum上可擴散的信息分別控制異宗配合或非自我兼容的交配器官的形成[10]。信息誘導是玉米黑粉病菌(Ustilago maydis)侵染的必需階段[11],信息首先誘導交配型菌絲結合,然后在tubulin基因的作用下形成具有侵染性的雙核菌絲,誘導細胞核的形成[12-13]。在昆蟲病原真菌Lagenidium giganteum中有相類似的信息行為。在Allomyces species中,雌性和雄性孢子形成絲狀結合體參與有性生殖。在Zygomycota中,大多數菌絲是異宗配合的,它們通過同宗配合和異宗配合實現有性生殖,在這一過程中信息調控了菌絲從無性到有性的轉換[14-15]。在子囊菌的Neurospora crassa上也觀察到了性信息的作用痕跡,但沒有分離出相應的化合物[16-17]。在擔子菌中,脂肽類信息參與雙核的形成和子實體的發育[18]。研究者普遍意識到真菌的內源性信息和動物類信息具有同源性[9,19]。它們在真菌的生長和發育過程中扮演著重要角色[20]。
蝗綠僵菌不同產孢時期轉錄組分析發現信息素基因顯著上調表達,而信息素(MAT)基因在綠僵菌的產孢、抗性、侵染、定殖和致病力方面的功能尚不清楚。因此探索信息基因在蝗綠僵菌產孢、抗性、侵染、定殖和致病力方面的功能,為提高蝗綠僵菌孢子生產和害蟲防治提供理論依據和技術途徑。
1 材料與方法
1.1 試驗材料
供試蝗綠僵菌CQMa102(Metarhizium acridum102)菌株分離于被感染的竹脊飛蝗僵蟲尸體上。大腸桿菌(Escherichia coli)和根癌農桿菌感受態(Agrobacterium tumefaciens)均由西藏農牧學院生物技術實驗室制備。毒力生測中所用的東亞飛蝗由西藏農牧學院生物技術實驗室提供,其飼養條件:光照周期16 h∶8 h(光∶暗),溫度為(28±2)℃,相對濕度70%[21]。
1.2 試驗方法
1.2.1 蝗綠僵菌MaMAT1基因的敲除。
提取蝗綠僵菌基因組DNA,分別擴增MaMAT1基因上游(左臂)和下游(右臂)序列,根據同源重組的原理將左右臂序列分別連接到pK2-PB敲除載體上,將構建好的載體轉化至大腸桿菌感受細胞中,并涂布于LB固體培養基上(含50 μg/mL的卡那霉素),37 ℃恒溫培養箱中倒置培養12 h,挑取單菌落并PCR驗證,將構建好的pK2-PB-MaMAT1-L/R敲除載體轉化至根癌農桿菌感受態細胞[22],與綠僵菌共培養以獲得MaMat1基因敲除菌株。
1.2.2 蝗綠僵菌孢子萌發率的測定。
取在1/4 SDA培養基上培養14 d的新鮮成熟孢子,將100 μL 1×107個/mL的孢懸液均勻涂布于1/4 SDA平板上,在28 ℃恒溫培養箱中倒置培養12 h,期間每3 h觀察一次,當孢子出芽長度等于或大于孢子直徑50%時視為萌發,每組3次重復。計算公式:萌發率=萌發孢子總數/總孢子數×100%。
1.2.3 蝗綠僵菌產孢量的測定。
取在1/4 SDA培養基上培養14 d的新鮮成熟孢子,并配制1×107個/mL的孢懸液,取5 μL 孢懸液于含有1/4 SDA培養基的24孔板中,28 ℃倒置培養,每隔3 d觀察一次,并在顯微鏡下統計孢子數,每組3次重復。產孢量=孢子數/孔面積。
1.2.4 蝗綠僵菌孢子抗濕熱、抗紫外能力測定[21]。
(1)抗濕熱能力測定。取培養14 d的新鮮成熟蝗綠僵菌孢子,取50 μL經45 ℃處理0、2、4、6、8 h濃度為1×107個/mL 的孢懸液均勻涂布于1/4 SDA固體培養基上,在28 ℃恒溫培養箱中倒置培養20 h,顯微鏡下統計萌發孢子數,每組設3次重復。計算公式同“1.2.2”。
(2)抗紫外能力測定。取培養14 d的新鮮成熟蝗綠僵菌孢子,取100 μL濃度為1×107個/mL的孢懸液均勻涂布于1/4 SDA固體培養基上,在1 350 mW/m2紫外條件下,28 ℃倒置培養,每2 h觀察一次,連續觀察8 h,顯微鏡下統計孢子萌發率。每組設3個重復。計算公式同“1.2.2”。
1.2.5 蝗綠僵菌毒力測定[21]。
(1)體表侵染。配制1×107個/mL的石蠟油孢懸液,取5 μL孢懸液點滴于5齡東亞飛蝗幼蟲的背板上,每組40頭,每12 h統計一次,直至蝗蟲全部死亡,蝗蟲死亡率=死亡數/總頭數×100%。以點滴不含孢子的石蠟油試驗組為陰性對照。每組設3個重復。
(2)體內注射。配制1×106個/mL的孢子水懸液,于5齡東亞飛蝗幼蟲腹部第二、三腹節處注射5 μL孢懸液,每組40頭,每12 h統計一次,直至蝗蟲全部死亡,蝗蟲死亡率=死亡數/總頭數×100%。以注射5 μL ddH2O的試驗組為陰性對照組。每組設3個重復。
1.3 數據分析
用Excel 2019對試驗數據進行處理,GraphPad.Prism5.02軟件作圖,用SPSS 20.0進行差異顯著性分析(P<0.05)。
2 結果與分析
2.1 MaMAT1基因生物信息學分析
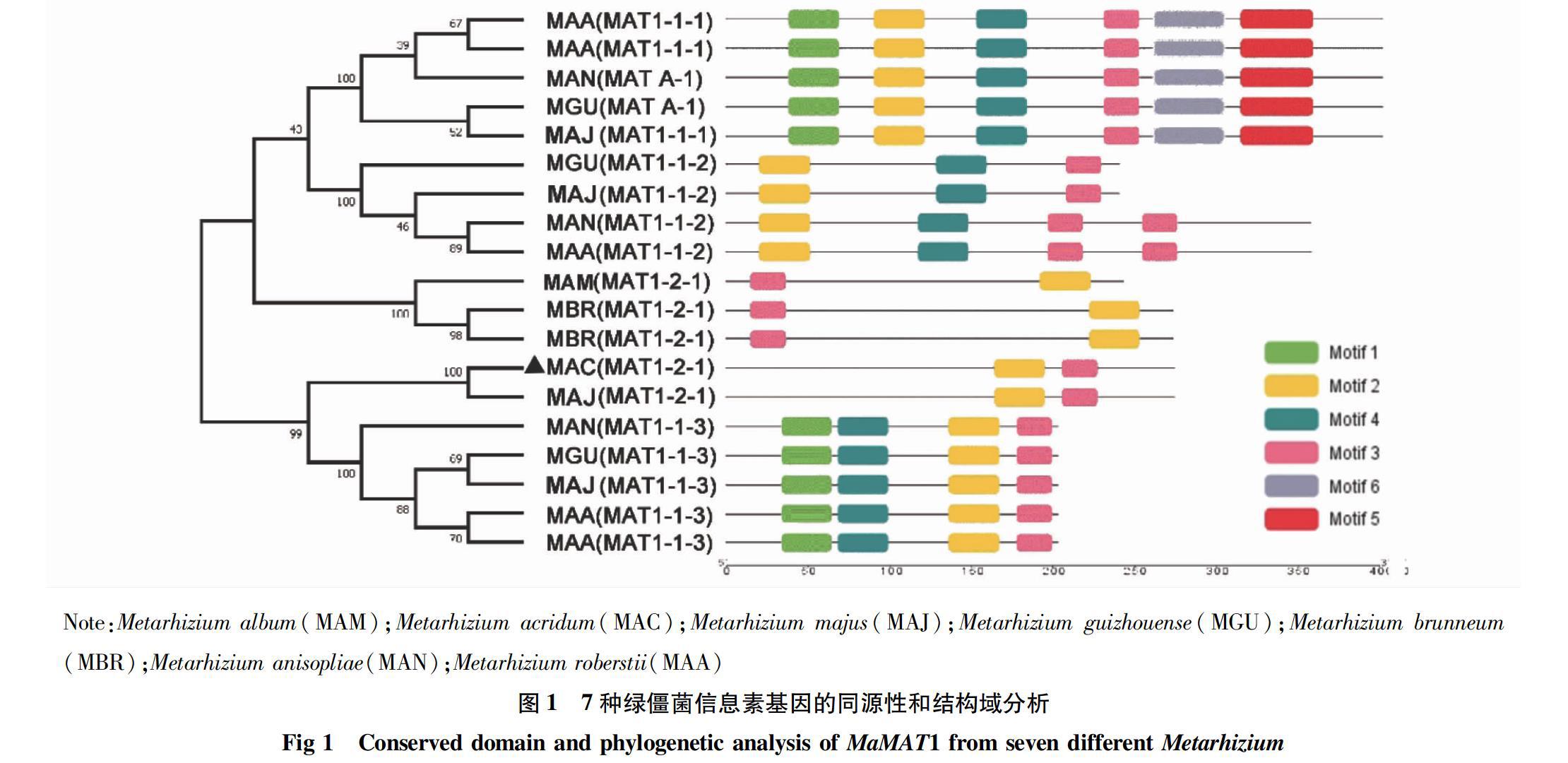
生物信息學分析表明,MaMAT1 cDNA ORF 全長為741 bp,編碼246個氨基酸。在線預測分析發現MaMAT1蛋白分子量(Mw)為28.1 kD,等電點(pI)是9.51。通過NCBI數據庫找出其他7種綠僵菌MAT1蛋白序列,通過同源比對及系統發育樹分析表明,蝗綠僵菌MaMAT1基因位點僅含有MAT1-2-1基因,且與大孢綠僵菌(Metarhizium majus,MAJ)MAT1-2-1基因聚為一支,其相似性高達94.72%(圖1)。
2.2 MaMAT1基因敲除和回復驗證
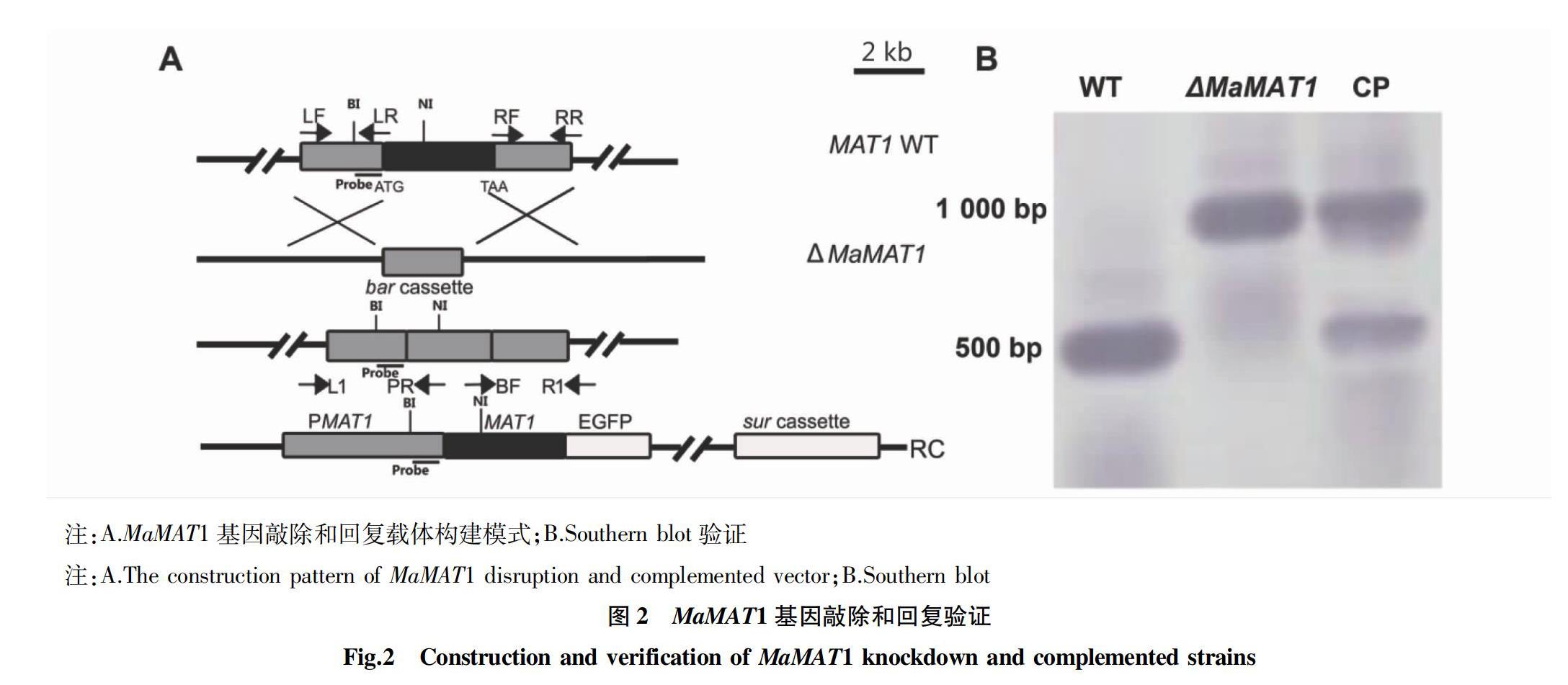
根據同源重組原理,利用根癌農桿菌介導轉化法獲得ΔMaMAT1和CP菌株,其載體構建原理見圖2A。提取WT、ΔMaMAT1和CP菌株基因組DNA,用BfrBI和Nsp7121I限制性內切酶進行酶切并Southern blot驗證(圖2B),結果表明,WT和ΔMaMAT1菌株僅有一條條帶,其大小分別為500和1 000 bp,而CP菌株含有2條條帶(500和1 000 bp),其大小分別與WT和CP菌株一致。綜上所述,該試驗所獲得的ΔMaMAT1和CP菌株均為陽性轉化子。
2.3 MaMAT1基因對蝗綠僵菌孢子萌發率和產孢量的影響
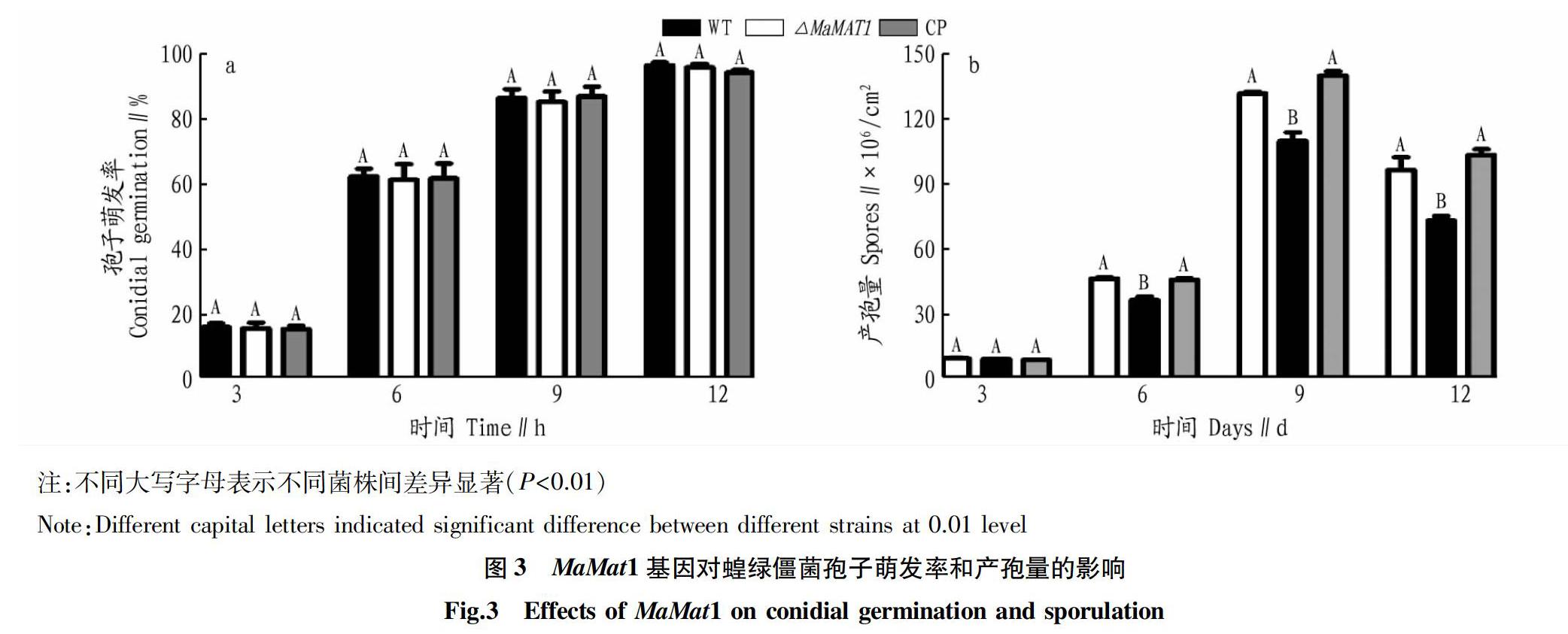
為分析MaMAT1 基因缺失對蝗綠僵菌孢子萌發率和產孢量的影響,分別對ΔMaMAT1、WT和回復(CP)菌株的萌發率和產孢量進行研究。結果表明,MaMAT1基因缺失不影響孢子萌發率,與WT和CP菌株相比,差異不顯著(圖3A),但其產孢量顯著低于WT和CP菌株(圖3B)。綜上所述,MaMAT1基因不影響蝗綠僵菌孢子萌發率,但顯著影響其產孢量。
2.4 MaMAT1基因對蝗綠僵菌孢子抗濕熱和抗紫外能力的影響
為分析MaMAT1對蝗綠僵菌孢子抗濕熱和抗紫外能力的影響,分別對ΔMaMAT1、WT和CP菌株的抗濕熱和抗紫外能力進行了研究。結果表明,與WT和CP菌株相比,ΔMaMAT1菌株抗濕熱和抗紫外能力無顯著差異(圖4)。綜上所述,MaMAT1基因的缺失不影響蝗綠僵菌的抗逆境能力。
2.5 MaMAT1基因對毒力的影響
以東亞飛蝗5齡幼蟲為試驗材料,采用體內注射和體表接種2種方法研究MaMAT1基因缺失對蝗綠僵菌孢子毒力的影響。點滴試驗結果表明,ΔMaMAT1菌株毒力顯著低于WT和CP(P<0.05),與WT相比,其半致死時間推遲了1.49 d(圖5A、B)。注射試驗結果表明,ΔMaMAT1菌株的毒力降低,差異顯著(P<0.05),與WT相比,其半致死時間推遲了0.72 d(圖5C、D)。綜上所述,MaMAT1基因影響綠僵菌對體表的穿透能力和在蝗蟲體內免疫應答。
3 討論
信息素在真核生物中作為一類調節類物質,在其生長發育過程中扮演著重要角色[20]。MAT1-1和MAT1-2是控制真菌交配的關鍵基因,即使親緣關系較近的物種,其MAT1-1和MAT1-2 位點所含的基因數量也不同,如羅伯茨綠僵菌、球孢白僵菌和蛹蟲草[23]。生物信息學分析表明蝗綠僵菌中僅含有信息素基因MAT1-2。
研究表明,在擔子菌中,信息類物質參與雙核的形成和子實體的發育[18]。該試驗研究表明,MaMAT1基因不影響蝗綠僵菌孢子萌發率,但其產孢量顯著降低,可能是由于MaMAT1基因的缺失影響了綠僵菌孢子的發育過程。抗逆境試驗分析表明,MaMAT1基因的缺失不影響綠僵菌抗濕熱和抗紫外能力,說明MaMAT1基因的缺失基本不影響綠僵菌細胞壁的結構和厚度。真菌中的信息素類似于植物中的生長調節因子(生長素、赤霉素、脫落酸和乙烯),在植物病原菌赤霉菌(Gibberella fujikuroi)中,其產生赤霉素參與宿主的致病過程。白色念珠菌中信息受體系統參與了宿主的附著作用[24]。蝗綠僵菌MAT1基因的缺失導致其毒力顯著降低,這與前人研究結果一致,說明MAT1基因可能參與了宿主附著作用和致病過程。
蝗綠僵菌作為一種重要昆蟲病原真菌,在害蟲防治方面扮演著重要角色,其產孢量和毒力是限制其大規模應用的關鍵因素。從該試驗結果可知,MaMAT1基因參與蝗綠僵菌產孢和毒力有關。這一研究結果為提高孢子產量和毒力提供理論依據。
參考文獻
[1] KUMAR K K,SRIDHAR J,MURALI BASKARAN R K,et al.Microbial biopesticides for insect pest management in India:Current status and future prospects[J].J Invertebr Pathol,2019,165:74-81.
[2] LOMER C J,BATEMAN R P,JOHNSON D L,et al.Biological control of locusts and grasshoppers[J].Annu Rev Entomol,2001,46:667-702.
[3] HUNTER D M,MILNER R J,SPURGIN P A.Aerial treatment of the Australian plague locust,Chortoicetes terminifera(Orthoptera:Acrididae)with Metarhizium anisopliae(Deuteromycotina:Hyphomycetes)[J].Bull Entomol Res,2001,91(2):93-99.
[4] PENG G X,WANG Z K,YIN Y P,et al.Field trials of Metarhizium anisopliae var.acridum(Ascomycota:Hypocreales)against oriental migratory locusts,Locusta migratoria manilensis(Meyen)in Northern China[J].Crop Prot,2008,27(9):1244-1250.
[5] ST LEGER R J.Metarhizium anisopliae as a model for studying bioinsecticidal host pathogen interactions [M]//VURRO M,GRESSEL J.Novel biotechnologies for biocontrol agentenhancement and management.Dordrecht:Springer Verlag,2007:179-204.
[6] GAO Q,JIN K,YING S H,et al.Genome sequencing and comparative transcriptomics of the model entomopathogenic fungi Metarhizium anisopliae and M.acridum[J].PLos Genet,2011,7(1):1-18.
[7] ST LEGER R J S,WANG C S.Genetic engineering of fungal biocontrol agents to achieve greater efficacy against insect pests[J].Appl Microbiol Biotechnol,2010,85(4):901-907.
[8] DYER P S.Evolutionary biology:Genomic clues to original sex in fungi [J].Curr Biol,2008,18(5):R207-R209.
[9] GOODAY G W,ADAMS D? J.Sex hormones and fungi [J].Adv Microb Physiol,1993,34:69-145.
[10] GALL A M,ELLIOTT C G.Control of sexual reproduction in Pythium sylvaticum[J].Trans Br Mycol Soc,1985,84(4):629-636.
[11] FELDBRGGE M,KMPER J,STEINBERG G,et al.Regulation of mating and pathogenic development in Ustilago maydis[J].Curr Opin Microbiol,2004,7(6):666-672.
[12] FUCHS U,MANNS I,STEINBERG G.Microtubules are dispensable for the initial pathogenic development but required for long distance hyphal growth in the corn smut fungus Ustilago maydis[J].Mol Biol Cell,2005,16(6):2746-2758.
[13]
ZHANG J,JIN K,XIA Y X.Contributions of β tubulin to cellular morphology,sporulation and virulence in the insect fungal pathogen,Metarhizium acridum[J].Fungal Genet Biol,2017,103:16-24.
[14] VAN DEN E H.Sexual interactions in the lower filamentous fungi[M]//LINSKENS H F,HESLOP HARRISON J.Cellular interactions.Berlin:Springer Verlag,1984.
[15] VAN DEN ENDE H.Sexual factor of the Mucorales [J].Nature,1967,215(5097):211-212.
[16] BISTIS G N.Chemotropic interactions between trichogynes and conidia of opposite mating type in Neurospora crassa[J].Mycologia,1981,73(5):959-975.
[17] BISTIS G N.Evidence for diffusible,mating type specific trichogyne attractants in Neurospora crassa[J].Exp Mycol,1983,7(3):292-295.
[18] DYER P S,INGRAM D S,JOHNSTONE K.The control of sexual morphogenesis in the ascomycotina[J].Biol Rev,1992,67(4):421-458.
[19] LENARD J.Mammalian hormones in microbial cells [J].Trends Biochem Sci,1992,17(4):147-150.
[20] KOLE H K,SMITH D R,LENARD J.Characterization and partial purification of an insulinase from Neurospora crassa[J].Arch Biochem Biophys,1992,297(2):199-204.
[21] 張二豪.綠僵菌乙醇脫氫酶1基因功能及其啟動子結構與功能研究[D].重慶:重慶大學,2016.
[22] BUNDOCK P,MRCZEK K,WINKLER A A,et al.T DNA from Agrobacterium tumefaciens as an efficient tool for gene targeting in Kluyveromyces lactis[J].Mol Gen Genet,1999,261(1):115-121.
[23] ZHENG P,XIA Y L,ZHANG S W,et al.Genetics of Cordyceps and related fungi[J].Appl Microbiol Biotechnol,2013,97(7):2797-2804.
[24] KRAVTSOV E G,ANOKHINA I V,RYBAS Y A,et al.Effects of female sex hormones on adhesion of Candida albicans yeast like fungi to the buccal epithelium [J].Bull Exp Biol Med,2014,157(2):246-248.

