貝類致敏原抗原表位及交叉反應的研究進展
桓 霏,云 肖,李夢思,韓天嬌,劉 萌,楊 陽,曹敏杰,劉光明,*
(1.集美大學食品與生物工程學院,福建廈門 361021;2.水產品深加工技術國家地方聯合工程研究中心,廈門市海洋功能食品重點實驗室,福建廈門 361021)
食物過敏(Food allergy)是由免疫球蛋白(Immunoglobulin,Ig)E 介導的速發型超敏反應,其發病迅速,臨床癥狀多樣,病情嚴重時甚至會出現休克或死亡,成為各國政府和公眾廣泛關注的食品安全問題之一。調查統計表明,英國食物過敏發病率為19.2%[1]、美國為10.9%[2]。過去的幾十年里,發展中國家患病率呈現上升趨勢,其中,中國過敏性疾病發病率從3.5%上升至7.7%[3],而中國兒童的自報食物過敏率高達8.4%[4]。流行病學調查發現,貝類是引起美國居民過敏的第三大常見食物(16.1%),僅次于花生(23.1%)和堅果(21.6%)[5],法國兒童的貝類過敏發病率達5.5%[6];而在中國、新加坡和泰國等亞洲國家,貝類則是引起食物過敏的主要原因[7],中國香港地區的貝類過敏占食物過敏疾病總發生率的35%左右[8]。貝類(Shellfish)包括甲殼類及軟體類[9],其風味鮮美,營養價值高,是人們最喜愛的水產品之一。不同于牛奶、雞蛋等好發于嬰幼兒的致敏食物,由貝類引起的食物過敏好發于成人,容易引起皮膚紅腫、鼻炎、哮喘等癥狀[10]。
食品致敏原指的是能夠誘導機體產生IgE 抗體并與之結合,進一步激活機體免疫系統,從而引發食物過敏癥狀的物質[10]。抗原表位是致敏原中決定抗原特異性的特殊化學基團,是致敏原發揮功能作用的基礎[11]。根據自身結構不同,抗原表位可分為線性表位和構象表位。線性表位是指一級結構上連續的,可與抗體特異性結合的一類短肽,主要用重疊肽技術確定[12]。構象表位指在一級結構上不連續,但其經過進一步的盤曲折疊,在三級結構上相互靠近而形成的特異性結合位點,噬菌體展示技術則是構象表位分析的有力工具[11]。
研究發現貝類致敏原的抗原表位與物種間交叉反應性有明顯的相關性,不同貝類物種間具有相同或相似的抗原表位為其交叉反應提供基礎[13]。食品致敏原有特定的空間結構及抗原表位,利用不同加工方法或脫敏技術處理會破壞致敏原的空間結構或抗原表位,從而影響致敏性。大多數貝類都需經過加熱后攝食,故熱加工技術被廣泛應用于消減貝類致敏性。但由于熱加工主要通過破壞致敏原構象表位而影響致敏原致敏性,對線性表位影響較小,因此非熱加工方法如酶法交聯、超高壓、輻照等被應用于貝類食品的加工消減[14]。本文介紹了貝類致敏原及抗原表位、交叉反應性及致敏性消減等領域的研究進展。
1 貝類常見致敏原及抗原表位
目前報道的貝類主要致敏原有原肌球蛋白(Tropomyosin,TM)、精氨酸激酶(Arginine kinase,AK)、次要致敏原肌質鈣結合蛋白(Sarcoplasmiccalcium-binding protein,SCP)、肌球蛋白輕鏈(Myosin light chain,MLC),以及新型致敏原磷酸丙糖異構酶(Triosephosphate isomerase,TIM)、細絲蛋白C(Filamin C,FLN c)等[9]。
1.1 原肌球蛋白
TM 作為肌鈣蛋白的復合物存在,參與機體肌肉收縮,是無脊椎動物中的一種泛致敏原,也是貝類的主要致敏原之一[15]。TM 的相對分子質量為34~40 kDa,約由281 個氨基酸組成,等電點為4.5,其三級結構是由兩個相同的α螺旋構型的多肽鏈相互纏繞而形成的超螺旋結構[16]。
甲殼類水產品中TM 的相關研究已較為廣泛,1981年,TM 首次被鑒定為褐蝦(Penaeus aztecus)的一種致敏原[17],隨后在斑節對蝦(Penaeus monodon)[18]、克氏原螯蝦(Procambarus clarkii)[19]、雪蟹(Chinopecetes opilio)[20]等物種中陸續被發現。相對于甲殼類動物而言,軟體類致敏原的研究較少,Masaru 等[21]鑒定TM 為太平洋牡蠣(Crassostrea gigas)的主要致敏原,除此之外,有學者克隆了北太平洋魷魚(Todarodes pacificus)[22]、華貴櫛孔扇貝(Chlamys nobilis)和翡翠貽貝(Perna viridis)[23]等軟體類動物的基因序列,發現與甲殼類TM 有較高的同源性。
重疊肽技術被廣泛應用于鑒定致敏原線性表位,Ayuso 等[24]合成褐蝦TM 的46 條肽段,結合血清學驗證并鑒定出5 個線性表位。Zhang 等[25]鑒定了秀麗白蝦(Exopalaemon modestus)TM 的5 個線性表位。除此之外,Ayuso 等[26]分析得到凡納濱對蝦(Litopenaeus vannamei)TM 的5 個線性表位。Leung等[12]利用OBOC(One-bead-one-compound)技術鑒定刀額新對蝦(Metapenaeus ensis)TM 的6 個線性表位。Liu 等[27]利用噬菌體展示技術篩選得到擬穴青蟹(Scylla paramamosain)TM 的8 個線性表位及7 個構象表位。目前軟體動物致敏原的研究尚未豐富,其抗原表位大多數都由預測得到,國內外陸續有學者采用生物信息學軟件預測章魚(Octopodidae vulgaris)[28]、太平洋牡蠣[29]TM 的抗原表位。已報道的貝類TM 構象表位見表1,線性表位定位見圖1。圖中不同顏色的橫線表示不同物種間TM 的抗原表位,橫線重合處越多表明表位的保守性也越高,通過對已報道的TM 抗原表位的整理分析,發現AA45-55、AA80-110、AA254-263 為貝類TM 抗原表位的保守區域。
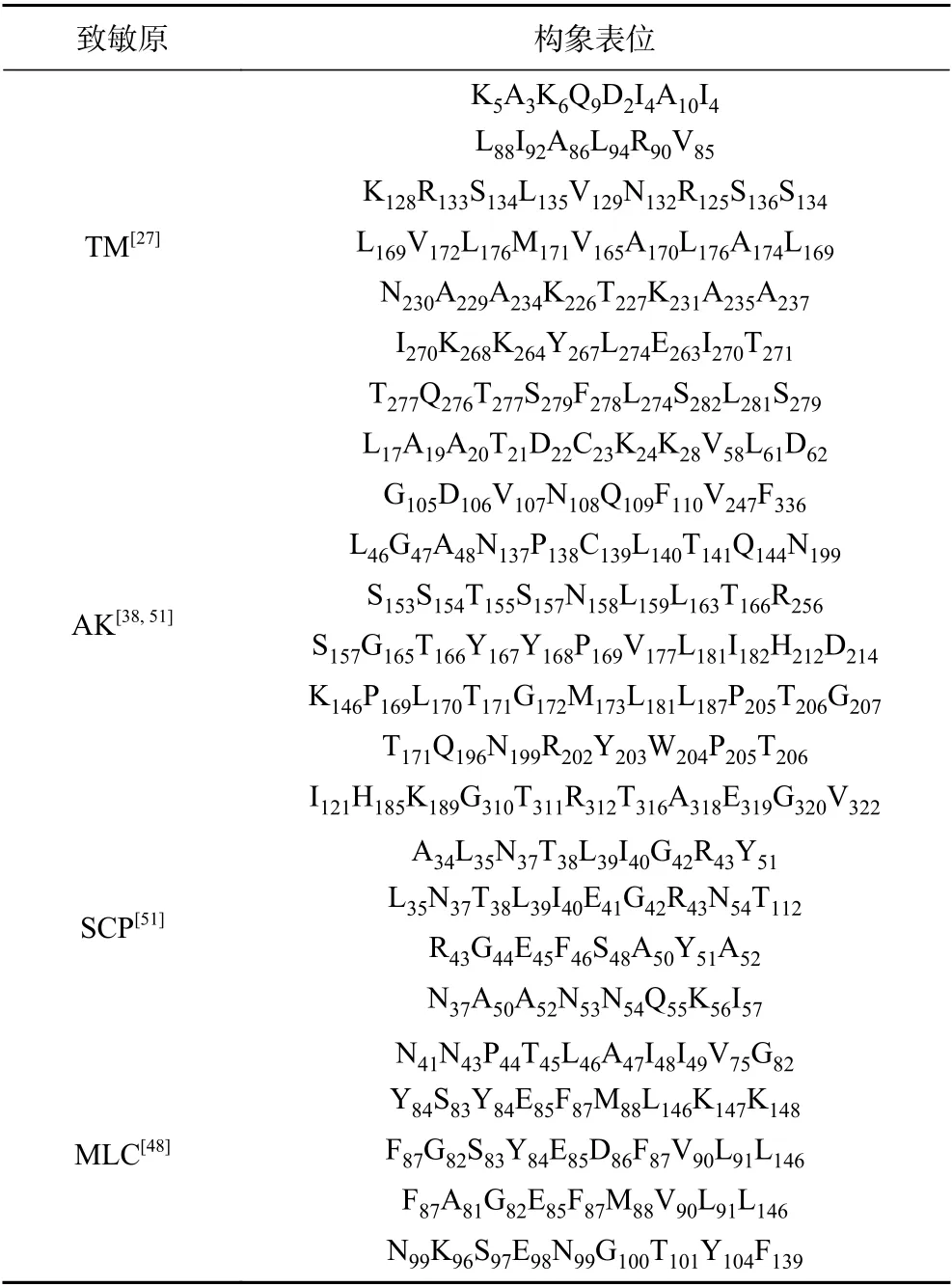
表1 貝類四種常見致敏原的構象表位Table 1 Conformational epitopes of four commonly shellfish allergens
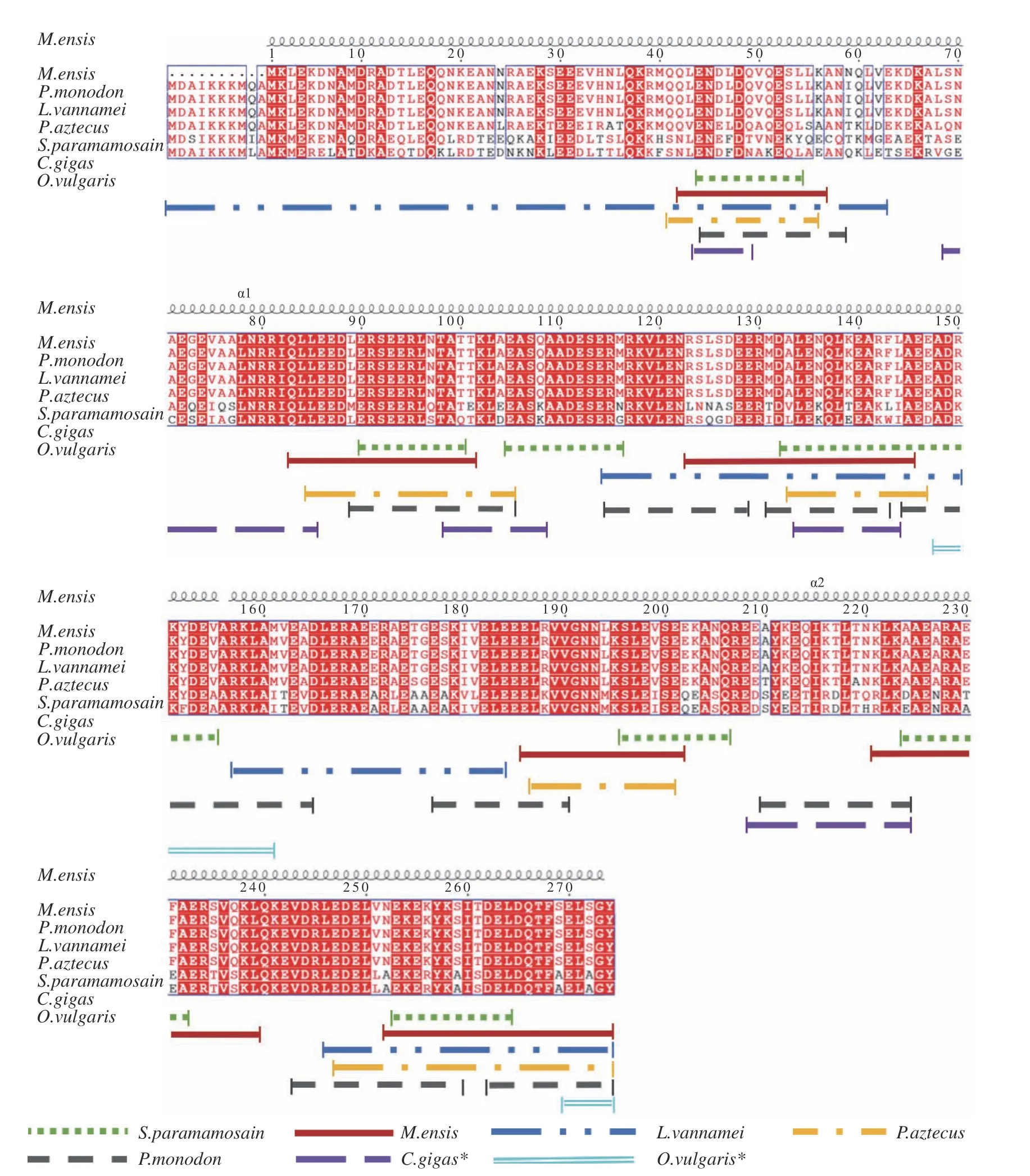
圖1 貝類TM 線性表位定位[12,24?29]Fig.1 Linear epitopes location of shellfish TM[12,24?29]
1.2 精氨酸激酶
AK 是一種廣泛存在于無脊椎動物體內的磷酸原激酶,可調節能量代謝[30],由359 個氨基酸殘基組成,分子量為40 kDa 左右,等電點為6.0,其空間結構包含一個N 端的α螺旋結構域和C 端的α-β結構域[31]。
甲殼類水產品中,雪蟹、克氏原螯蝦等物種中的AK 相繼被鑒定報道[32],同時凡納濱對蝦[33]、擬穴青蟹[34]等物種中AK 的晶體結構也已經被解析。在軟體動物中,僅有少量AK 被報道,Shen 等[35]首次在章魚中發現AK,采用生物信息學軟件預測結果表明,在章魚及蝦、蟹等甲殼類物種中AK 一級序列的同源性達到54%左右,此外,預測結果也表明二者的三級結構高度相似。
作為貝類中的主要致敏原,AK 的抗原表位也陸續被鑒定報道。利用重疊肽技術,Mao 等[36]得到擬穴青蟹AK 的3 個線性表位。Ayuso 等[37]鑒定了凡納濱對蝦AK 的8 個線性表位;Yang 等[38]利用噬菌體展示等技術得到擬穴青蟹AK 的4 個線性表位及8 個構象表位。Fu 等[39]利用生物信息學分析軟件結合免疫組學方法驗證了中國對蝦(Penaeus chinensis)AK 的線性表位。其他軟體動物中,有研究預測得到章魚AK 的線性表位[35]。已報道的貝類AK 構象表位見表1,線性表位定位見圖2。不同物種間AK 的抗原表位相似度較高,且其主要分布在α 螺旋及β 折疊部分,其中AA113-156 處的表位高度保守,該區域對AK 發揮致敏性的重要性值得深入研究。太平洋牡蠣AK 的酶動力學性質已見報道,但其免疫學特性未見研究,而AK 作為泛致敏原,在軟體類動物中可能為潛在致敏原,因此其在軟體動物中的致敏性有待研究。
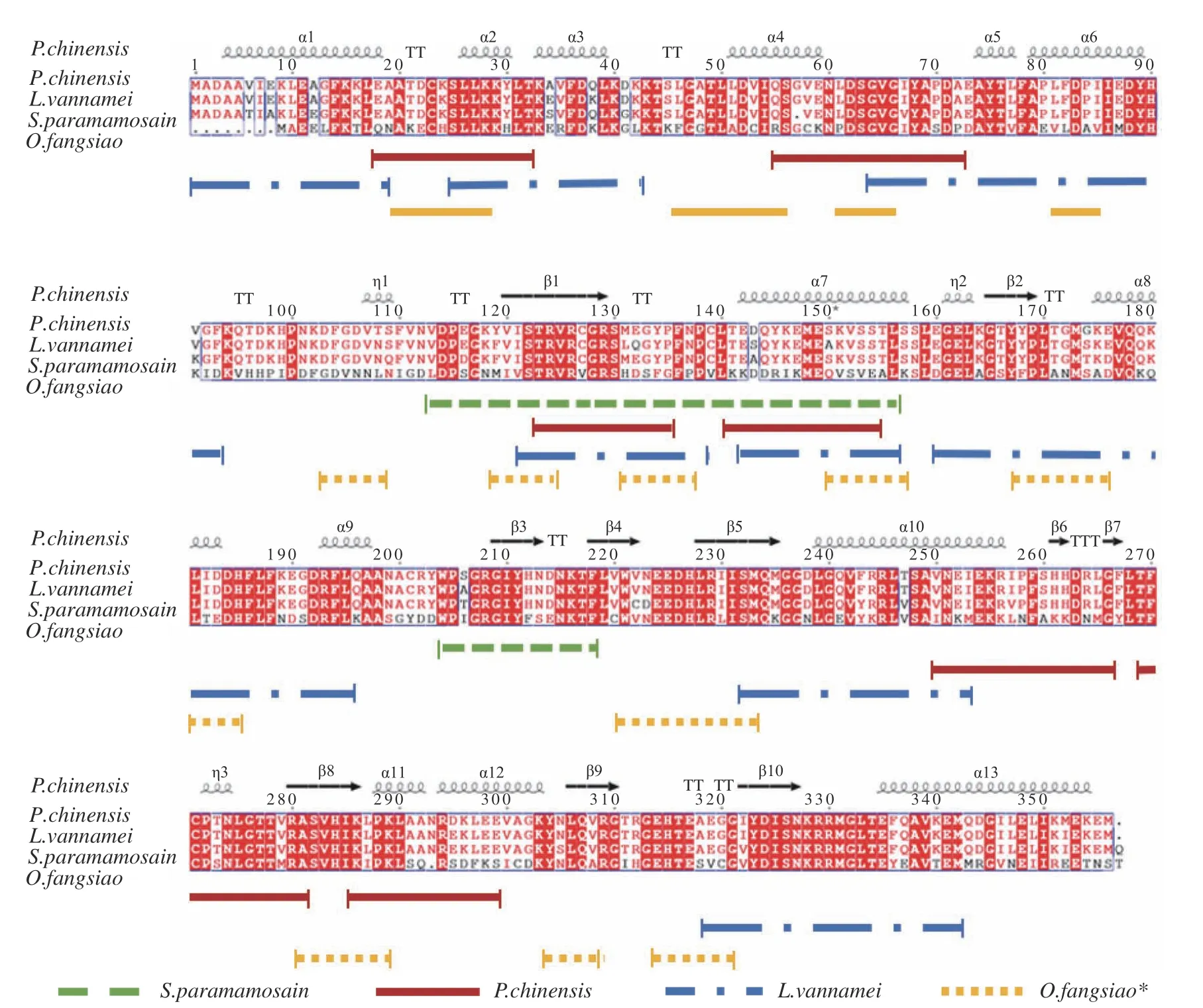
圖2 貝類AK 線性表位定位[35?39]Fig.2 Linear epitopes location of shellfish AK[35?39]
1.3 肌質鈣結合蛋白
SCP 是存在于無脊椎動物肌肉和神經組織的EF 手性鈣離子緩沖蛋白,分子量約為20 kDa,等電點為 4.6 左右,在無脊椎動物體內起調節肌肉收縮的功能。
Shiomi 等[40]采用鹽析法、陰離子交換色譜法結合反相高效液相色譜法從斑節對蝦中分離純化出20 kDa致敏原SCP。隨后在日本對蝦(Penaeus japonicus)、美國螯龍蝦(Homarus americanus)、粉蝦(Pandalus eous),克氏原螯蝦[41]中也分別檢測到SCP,與已報道的甲殼類SCP 序列同源性超過80%。Hu 等[42]重組表達了擬穴青蟹SCP,并發現其理化性質和免疫學特性與天然SCP 相似,青蟹SCP 與其他甲殼類水產品SCP 存在明顯的交叉反應性。在軟體動物中,Han 等[43]純化了葡萄牙牡蠣(Crassostrea angulata)SCP,并發現其與太平洋牡蠣同源性較高。
通過重疊肽技術,Ayuso 等[37]鑒定了凡納濱對蝦SCP 的3 個線性表位。Morii 等[44]合成斑節對蝦SCP 中的18 個重疊肽,結合血清學研究表明,斑節對蝦SCP 線性表位對致敏性的影響較小。學者們發現SCP 主要以構象表位為主,同樣地,通過噬菌體展示技術,Yang 等[51]等人也在擬穴青蟹SCP 中相繼鑒定出了6 個構象表位。此外,國內學者預測得到克氏原螯蝦SCP 的3 個線性表位[41]。已報道的貝類SCP 構象表位見表1,線性表位見圖3。從線性表位角度來看,凡納濱對蝦及克氏原螯蝦SCP 抗原表位的保守性較低,但由于貝類中關于SCP 抗原表位的研究較少,仍無法全面探究其表位的保守性。
1.4 肌球蛋白輕鏈
MLC 是肌球蛋白大分子復合體的一部分,構成功能型肌肉蛋白結構,通過EF 手型結構域結合Ca2+,對熱較穩定,在強酸和強堿性條件下也具有良好的穩定性[45]。
Ayuso 等[46]首次從凡納濱對蝦中純化出MLC,免疫組學方法驗證其有IgE 結合活性。克氏原螯蝦[45]、擬穴青蟹[47]也有鑒定出MLC,且有研究表明,貝類過敏患者對MLC 的識別率達到50%以上[37],僅次于主要致敏原TM,因此需要全面鑒定貝類其他物種間MLC,進一步解釋其豐度較低但致敏率較高的原因。
在MLC 抗原表位研究方面,有學者預測得到克氏原螯蝦MLC1 有4 個構象表位和3 個線性表位,而MLC2 則有1 個構象表位和3 個線性表位[48]。Yang等[48]通過噬菌體展示技術鑒定克氏原螯蝦MLC1的5 個構象表位,擬穴青蟹中預測得到7 個MLC 線性表位并通過肥大細胞脫顆粒等實驗鑒定了5 個關鍵的表位區域[47]。在凡納濱對蝦中也預測到MLC的線性表位[37]。已報道的貝類MLC 構象表位見表1,線性表位見圖4。
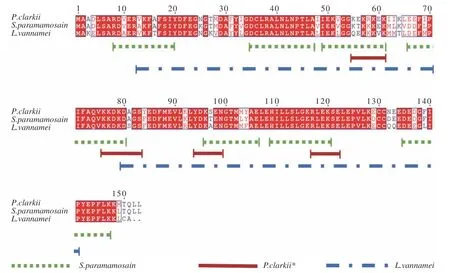
圖4 貝類MLC 線性表位定位[37,47-48]Fig.4 Linear epitopes location of shellfish MLC
1.5 新型致敏原
除了以上常見致敏原以外,隨著國內外學者對食物過敏的重視,越來越多的新型貝類致敏原也陸續被發現。
Lee 等[49]發現凡納濱對蝦中63 kDa 的組分可特異性結合對蝦過敏患者的血清,隨后該蛋白被鑒定為丙酮酸激酶。Yang 等[50]首次從章魚中分離鑒定出28 kDa 的新型致敏原TIM,隨后,甲殼類中的TIM 也被鑒定[51]。
雖然大部分已被鑒定報道的過敏原分子量均較低,但鑒定為過敏原與蛋白質的分子量之間并沒有顯著相關性。Yang 等[52]從克氏原螯蝦中發現并鑒定90 kDa 組分的新型致敏原FLN c;此外,Suzuki 等[53]從皺紋盤鮑中純化出100 kDa 左右的組分,經鑒定為副肌球蛋白,與TM 表現出較高的序列同源性。
國內學者普遍通過生物信息學軟件來分析預測新型致敏原的抗原表位,章魚TIM 的8 個線性表位、克氏原螯蝦FLN c 的9 個線性表位及10 個構象表位[52]相繼被報道。此外,也有學者采用噬菌體展示技術確定了章魚TIM 的1 個構象表位[50];擬穴青蟹TIM 的5 個線性表位以及3 個構象表位區域[51]。由于貝類水產品致敏原結構、抗原表位等方面的研究尚不系統,這些新型致敏原是否具有共同的結構特征和抗原表位也尚未可知,進一步的深入探究對于過敏性疾病的防控和治療具有重要意義。
2 貝類致敏原的交叉反應性及加工消減
2.1 貝類致敏原的交叉反應
研究表明,約有38%的受試者對甲殼類過敏,其中14%的人同時對甲殼類及軟體類過敏[54],說明貝類間存在較高的交叉反應,盡管這一臨床現象被普遍關注,但相關原因的研究還略有不足。
已有的研究表明貝類過敏原是甲殼類動物和其他物種間存在交叉反應的基礎,其高度保守的氨基酸序列可能是交叉反應的主要原因。臨床病例報道由于意外接觸塵螨、昆蟲等,貝類過敏患者出現了嚴重的臨床癥狀,其主要原因是塵螨等與貝類中TM具有高度的序列同源性,其中對蝦與塵螨TM 的氨基酸序列相似度為81%,與蟑螂的氨基酸序列相似度為82%。TM 是引起無脊椎動物間交叉反應的泛致敏原,其在甲殼類動物中具有高度保守的氨基酸序列,同源性高達91%~100%[55]。此外,與TM 相似,AK 的氨基酸序列也較為保守,甲殼類及軟體動物間AK 氨基酸序列同源性達55%左右,這也是AK在無脊椎動物間存在較高的交叉反應的主要原因[56]。同樣地,研究表明蝦夷扇貝(Mizuhopecten yessoensis)、斑節對蝦和凡納濱對蝦等均可特異性結合葡萄牙牡蠣中的SCP 多克隆抗體,其主要原因是這些軟體動物中的SCP 同源性達到了50%~96%[43]。
同時,也有證據表明具有相似的IgE 表位可能是貝類及無脊椎動物間出現較高交叉反應的分子基礎。在圖1~圖4中定位的貝類主要致敏原的表位中,發現除SCP 外,貝類致敏原的抗原表位均高度保守,這可能是貝類物種間交叉反應性發生率較高的原因。此外,Nugraha 等[57]在鑒定出的97 個蝦TM的IgE 結合表位中,進一步識別出了22 個甲殼類動物、軟體動物、蟑螂和螨蟲共有的表位,這為解釋貝類食品廣泛存在的交叉反應提供了新思路一個新的角度新思路。Yang 等[48]發現克氏原螯蝦MLC 與白蟻、蟑螂、蠶蛹等無脊椎動物的抗原表位區域保守性高,可能存在明顯的交叉反應性。此外,主要結構相似或具有相同的構象表位也可能是引起不同家族過敏原出現交叉反應的原因之一。克氏原螯蝦中非同族新型致敏原TIM 與FLN c 可識別相同的過敏原多克隆抗體,具有明顯的交叉反應性,二者氨基酸序列同源性較低,但經噬菌體展示技術識別出其具有相同的抗原表位區域,且二者在空間結構上存在一定的相似性[50]。當前對軟體動物中的新型過敏原研究較少,其交叉反應性仍有待深入。
2.2 貝類致敏原的加工消減
基于致敏原序列同源性和表位的研究,加工定向消減貝類食品致敏性逐漸成為國內外研究的熱點。常用的定向改造致敏原的方法,包括酶法交聯、美拉德反應等,已陸續被應用于不同致敏原的脫敏。
酶法交聯,主要是酶催化使致敏原與致敏原之間或致敏原與其他蛋白之間發生交聯,從而將致敏原的抗原表位隱藏在蛋白內部,降低致敏原的致敏性[58]。Liu 等[59]將辣根過氧化物酶與擬穴青蟹TM交聯,發現兩種酶交聯產物均可改善小鼠的致敏癥狀,顯著降低其體內的特異性IgE 水平;其主要原因是添加的酶可通過影響蛋白的結構形態,改變抗原的遞呈方式,誘導致敏小鼠產生對TM 的口服耐受性,因而改變交聯產物的致敏性。Yuan 等[60]發現谷氨酰胺轉胺酶可改變刀額對蝦TM 的空間結構,定向修飾抗原表位,進而有效降低蝦TM 的致敏性。Fei 等[61]采用外加酪氨酸酶的方式,結合免疫組學與蛋白質組學方法對擬穴青蟹AK 進行了酶法交聯,交聯產物的二級結構發生改變,表面疏水性增強,通過小鼠模型驗證發現其致敏性較天然AK 明顯降低。
美拉德反應是食品加工過程中普遍存在的一種現象,主要是指氨基酸殘基與還原糖在一定溫度下發生的非酶褐變[62]。Zhang 等[63]發現TM 與葡萄糖在37 ℃經糖化反應18 h 后,致敏原α-螺旋含量大幅下降,且賴氨酸的含量降低了55%左右,致敏原結構的改變致使其致敏性顯著降低。Han 等[64]發現阿拉伯糖可定向修飾擬穴青蟹TM 的IgE 表位上關鍵氨基酸(K112、R125、R133),進而減緩小鼠的過敏癥狀,降低TM 的致敏性。Hu 等[42]等研究表明,擬穴青蟹SCP 與木糖在100 ℃下的混合產物,經N 端糖基化定向修飾抗原表位后,其與血清IgE 的特異性結合能力顯著降低。除此之外,由于MLC、TIM、FLN c 等致敏原起步較晚,其致敏性消減方面研究未見報道。
致敏原與體內IgE 的特異性結合是引起機體食物過敏的主要原因,抗原表位決定了致敏原與IgE 的結合能力[1]。修飾或破壞致敏原結構及其抗原表位是降低貝類食物致敏性的關鍵,可定向消減致敏原致敏性的加工方法的探究勢在必行。
3 貝類致敏原研究的發展趨勢
國內外學者針對貝類致敏原的鑒定、抗原表位的識別、交叉反應和致敏性消減的加工方式等研究均取得了一定的進展。但相比于其它致敏食物,關于貝類致敏原及致敏性的相關研究仍需深入。首先,目前針對貝類致敏原的研究主要集中在豐度較高的甲殼類致敏原TM、AK 中,而研究表明貝類中豐度低的致敏原如MLC 等,也有較高的致敏率,故應加強對軟體動物致敏原及次要致敏原的研究。其次,已報道的常用表位鑒定方式,效率低、且成本高,而近幾年OBOC 及生物信息學預測結合免疫學鑒定方式具有高效可靠等特點,可期廣泛應用于致敏原表位鑒定。同時,基于致敏原序列同源性及表位相似性,深入探究貝類食品致敏原之間及其與其它無脊椎動物之間的交叉反應性,進一步完善貝類食品致敏原廣泛存在交叉反應性的原因。最后,探究多種不同的加工方式聯用,定向修飾貝類食品致敏原,以期在保留食物營養成分的前提下,最大程度降低或者消除食物致敏性,以豐富我國低致敏性食品市場。

