不同藥劑處理對西瓜連作土壤的影響
孟佳麗 吳紹軍 沈虹 周玲玲 張黎杰 余翔

摘要: 以未經任何處理的種植1年西瓜的土壤為對照,采用高通量測序技術分析生石灰、敵克松、根寶、枯草芽孢桿菌、甲霜噁霉靈處理對西瓜連作土壤微生物群落的影響,并揭示土壤微生物群落與土壤養分含量及理化性質的相關性。結果表明,連作后土壤中的細菌菌群相對豐度降低,真菌菌群相對豐度增加。經過枯草芽孢桿菌處理的土壤中芽孢桿菌屬菌群相對豐度提高。經過敵克松處理的土壤中水小桿菌屬菌群相對豐度明顯高于其他處理。連作后土壤中鐮刀菌屬真菌的比例上升。敵克松和根寶處理后,土壤中紅菇屬、曲霉屬菌群相對豐度升高,鐮刀菌屬菌群相對豐度降低。芽孢桿菌屬菌群相對豐度與銨態氮含量呈顯著正相關,與土壤EC值呈顯著負相關。類諾卡氏菌屬菌群的相對豐度與土壤EC值呈極顯著負相關。相對細菌菌群而言,真菌菌群受土壤理化性質影響較小。鐮刀菌屬真菌與土壤EC值呈顯著正相關。說明,西瓜連作土壤采用殺菌劑處理或適量添加生物有機肥和微生物菌劑有利于土壤微生態環境的改善。
關鍵詞: 土壤處理;連作障礙;微生物群落;西瓜
中圖分類號: S651 文獻標識碼: A 文章編號: 1000-4440(2021)03-0651-09
Effects of different chemical treatments on continuous cropping soil of watermelon
MENG Jia-li, WU Shao-jun, SHEN Hong, ZHOU Ling-ling, ZHANG Li-jie, YU Xiang
(Suqian Institute of Agricultural Sciences, Jiangsu Academy of Agricultural Sciences, Suqian 223800, China)
Abstract: Taking the untreated soil in which watermelons were cultivated continuously for one-year as control, the effects of quicklime, Dixon, Genbo, Bacillus subtilis and metalaxyl-hymexazol on the microbial community in soils of continuous cropping watermelon were analyzed by high-throughput sequencing technology, and correlations between soil microbial community and soil nutrient content, physical and chemical properties were revealed. The results showed that, the relative abundance of bacterial flora in the soils decreased after continuous cropping, and the relative abundance of fungal flora increased. The relative abundance of Bacillus flora in the soils treated with Bacillus subtilis increased. The relative abundance of Aquabacterium flora in soils treated with Dixon was significantly higher than other treatments. The proportion of Fusarium fungi in the soil increased after continuous cropping. The relative abundance of Russula and Aspergillus floras increased and the relative abundance of Fusarium flora decreased in the soils treated with Dixon and Genbo. The relative abundance of Bacillus flora in the soils was in significant positive correlation with ammonium nitrogen content, and was in significant negative correlation with soil EC value. The relative abundance of Nocardioides flora was in extreme significant negative correlation with soil EC value. Compared with the bacterial flora, the fungal flora was less affected by the physical and chemical properties of the soils. The abundance of Fusarium community was in significant positive correlation with soil EC value. In the continuously cropping soils of watermelon, the soil micro-ecological environment was improved by fungicides treatment or appropriate bio-organic fertilizer and microbial agent treatment.
Key words: soil treatment;continuous cropping obstacle;microbial community;watermelon
據聯合國糧農組織(FAO)統計,2018年世界西瓜種植總面積3.24×106 hm2,總產量1.03×108 t。中國西瓜種植總面積1.50×106 hm2,總產量6.30×107 t。目前中國有2個西瓜主產區:中南產區和華東產區。中南產區包括河南、湖南等地,華東產區包括山東、安徽、江蘇等地。2018年江蘇省西瓜種植面積1×105 hm2,占全國西瓜種植面積的6.20%。設施栽培西瓜以其上市早、效益高的優勢深受農戶歡迎,生產面積逐年擴大。據統計, 2018年西瓜的設施栽培面積8.87×104 hm2,占西瓜栽培總面積的71.18%。
瓜類作物極易產生連作障礙,主要原因有:①土傳病蟲害頻繁發生。蔓枯病、枯萎病和根結線蟲病為常見三大病蟲害[1-2]。子囊菌亞門真菌瓜類球腔菌容易引發瓜類蔓枯病,表現為植株葉片、瓜蔓枯死和果實腐爛。尖孢鐮刀菌侵染植株根系引發的枯萎病,貫穿西瓜整個生育期,最嚴重時結果期整株發病死亡。南方根結線蟲侵染西瓜根系,造成根部形態扭曲,影響根系生理功能[3]。②土壤次生鹽漬化。西瓜種植需肥量大,但生長過程中對土壤中大量元素和微量元素吸收不均衡,而且西瓜種植密度低,大量施肥后無法吸收的養分殘存在土壤中。多年連作后土壤中鹽分積累,次生鹽漬化加重,引發西瓜生長發育障礙[4]。③自毒作用。西瓜根系分泌的苯甲酸、肉桂酸等自毒物質,對西瓜根系生長具有毒害作用,會抑制自身或同科作物的正常生長發育,長期積累在土壤中會造成連作障礙[5]。④土壤環境惡化。設施栽培中土壤長期被覆蓋,缺少雨水淋洗,土壤養分失衡,土壤中細菌、放線菌、真菌的種類和數量發生改變,各種酶活性也發生變化[6]。要治理連作障礙,實現西瓜的長期種植,首先要了解連作障礙形成的原因,然后運用生物生態防控措施,改善不良生產環境,為西瓜長期種植創造有利條件。所以,如何規避連作障礙是當前農業生產所面臨的重要課題。
治理西瓜連作障礙的方法主要有:①選擇抗病抗逆性強的品種,從根本上解決連作障礙的問題。但是抗性基因往往與不良性狀連鎖,提高抗性的同時可能會伴隨品質下降。目前蔬菜育種的一個重要方向就是利用分子生物學技術,打破基因連鎖,增強抗性基因表達,同時不影響果實品質。②利用砧木嫁接。西瓜連作區一般采用葫蘆或南瓜作為砧木。目前西瓜嫁接苗生產已經成為一項新興產業,農戶提供西瓜及砧木種子,由嫁接工廠代為育苗嫁接,專業化程度高,管理規范,成苗率高。③對土壤進行殺菌消毒,消滅病原菌,降解西瓜根系產生的自毒物質。一般多采用高溫悶棚配合化學藥劑的方式對設施內土壤消毒,能夠迅速殺滅土壤中的微生物、地下害蟲、雜草等。一般在春西瓜結束后的六七月份,清理田間瓜蔓和雜草,翻耕后上水漫灌,撒入石灰氮,并覆蓋地膜,關閉棚室。夏季晴天時,通過陽光曝曬,棚室內溫度可達50~70 ℃,可有效殺滅病原菌和地下害蟲,同時降解土壤中有毒物質。④施用生物菌劑。微生物菌劑與病原菌相互競爭,抑制病原菌擴張。同時有益微生物能夠分泌出廣譜抗菌物質,抑制或殺滅病原菌,從而達到防治作物病害的目的[7]。⑤配方施肥,合理施用肥料。西瓜在生長過程中長期從土壤中吸收相同的營養成分,導致土壤中某一種或某一類營養元素虧缺,而吸收較少的營養元素則日益累積,長此以往土壤養分失衡。測土配方施肥能夠有針對性地平衡土壤養分,對植株的健康生長有利。施肥的基本原則應該以有機肥為主、化肥為輔,適當添加微生物肥料[8]。
本研究擬從土壤改良的角度,采用生石灰、敵克松、根寶、枯草芽孢桿菌、噁霉靈對西瓜連作土壤進行處理,討論其對連作土壤理化性質及微生物群落的影響。為解決連作障礙問題提供科學依據。
1 材料與方法
1.1 試驗地點
試驗地點選在江蘇省宿遷市農業科學研究院運河灣試驗基地的鋼架大棚內。原始土壤為壤土,pH為7.89,肥力中等。2018年種植過西瓜,2019年春季開展試驗。供試西瓜品種為遷麗1號,株距55 cm,采用雙蔓整枝。
1.2 試驗設計
采用單因素隨機區組試驗設計,以未經處理的連作1年的土壤(F)為對照,設置生石灰(A)、敵克松(B)、根寶(C)、枯草芽孢桿菌(D)、甲霜噁霉靈(E)共5個土壤處理。原始土樣為空白對照,不種植西瓜。每處理重復3次,每小區10株。生石灰主要成分為氧化鈣,含量99%以上;敵克松由孚潤德公司生產,有效成分為70%敵磺鈉粉劑;根寶為國光農化股份有限公司生產的含氨基酸水溶肥,氨基酸含量≥100 g/L,鈣含量≥30 g/L;枯草芽孢桿菌為中國科學院植物保護研究所廊坊農藥中試廠生產的可濕性粉劑,枯草芽孢桿菌有效成分含量為1 g 1×1011個;甲霜噁霉靈為中國科學院植物保護研究所廊坊農藥中試廠生產的水劑,總有效成分含量3%,噁霉靈含量2.5%,甲霜靈含量0.5%。各處理的田間管理措施保持一致。
1.3 樣品采集
2019年6月15日,在每個小區隨機取5個采樣點,采集5~15 cm土層土樣,分別混勻每個處理的土樣,并去除雜質,分成2份。將第1份土樣過篩,采用干冰保存,用于微生物群落高通量分析。將第2份土樣風干粉碎后過篩,用于土壤理化性質分析和養分含量測定。
1.4 土壤養分含量測定及理化性質分析
銨態氮的測定采用KCl-靛酚藍比色法,有效鉀的測定采用HNO3-火焰光度計測定法,速效磷的測定采用NaHCO3-鉬銻抗比色法,pH值的測定采用電位法,EC值的測定采用電位法。
1.5 土壤微生物多樣性測定方法
1.5.1 測定流程概述 針對16 S V4-V5區,設計引物擴增后獲得420 bp左右片段。加接頭后使用NovaSeq平臺測序,獲得2×250 bp雙端測序數據。拼接后對所得較長序列進行16 S分析。
針對ITS區,設計引物擴增后得到310 bp左右片段。加接頭后使用NovaSeq平臺測序,獲得2×250 bp雙端測序數據。拼接后對所得較長序列進行ITS分析[9-11]。
1.5.2 數據分析流程 將測序原始數據拼接,去除干擾數據。將有效數據進行聚類分析,注釋代表序列的物種信息和相對豐度分布。并對所選序列進行比對,構建系統發生樹,探討不同土壤樣本之間群落結構的差異。最后結合環境因素分析多樣性指數和環境因子的相關性[12-14]。
1.6 數據處理
采用IBM SPSS Statistics 22軟件進行數據處理,采用單因素ANOVA方差分析和Pearson分析。
2 結果與分析
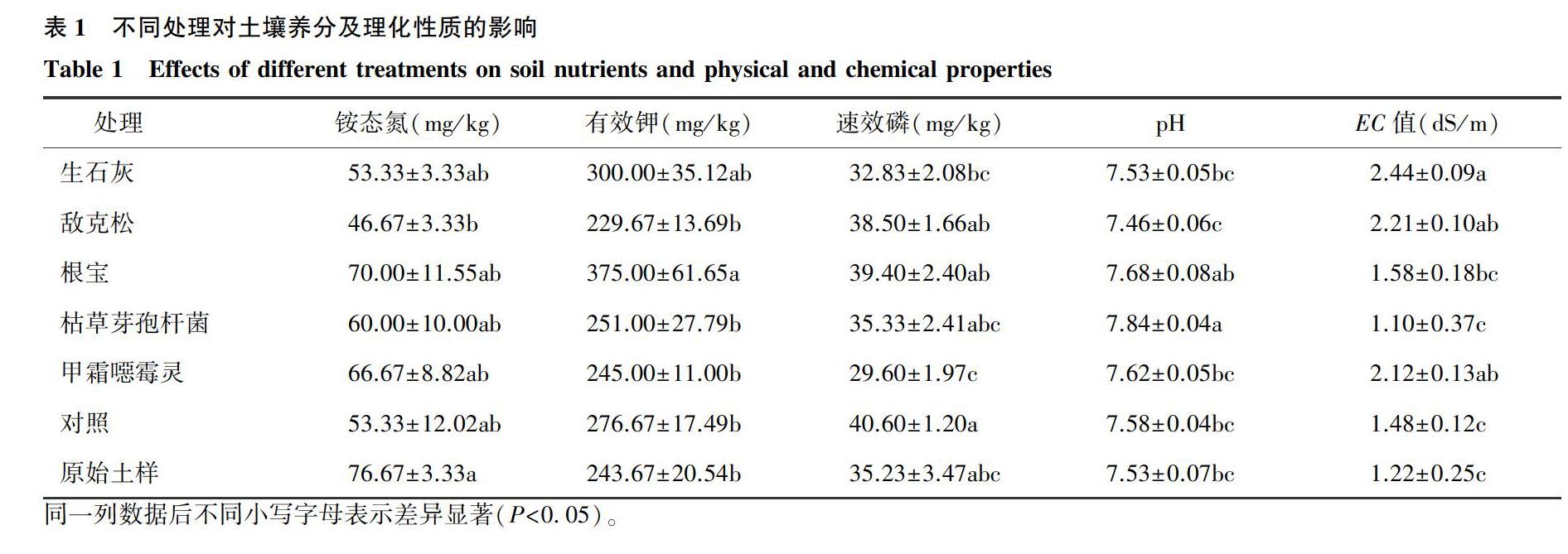
2.1 不同處理對土壤養分及理化性質的影響
由表1可以看出,原始土樣的銨態氮含量為76.67 mg/kg,顯著高于敵克松處理的46.67 mg/kg。有效鉀含量以根寶最高,與敵克松處理、枯草芽孢桿菌處理、甲霜噁霉靈處理、對照和原始土樣之間差異顯著。速效磷含量對照最高,為40.60 mg/kg,與敵克松處理、枯草芽孢桿菌處理、根寶處理和原始土樣差異不顯著;甲霜噁霉靈處理后土壤中速效磷含量最低,為29.60 mg/kg。僅有敵克松處理后的土壤為中性,pH值7.46,其余土壤均為堿性土,pH值超過7.50,其中枯草芽孢桿菌處理的土壤pH值最高,為7.84。由于連續種植,部分處理土壤發生鹽漬化,生石灰處理、敵克松處理和甲霜噁霉靈處理的土壤EC值超過2.00。根寶處理、枯草芽孢桿菌處理、對照和原始土樣的EC值低于2.00,其中枯草芽孢桿菌處理的效果最好,土壤EC值僅為1.10。
2.2 不同土壤處理對土壤微生物多樣性的影響
樣品稀釋曲線以測序量為橫軸,物種數為縱軸,反映了測序數據合理性和物種豐富度。曲線趨于平坦,說明測序量合理。由圖1可知,各處理曲線末端趨于平坦,說明取樣合理,足以反映土壤微生物組成。
2.2.1 不同土壤處理細菌屬水平主要物種相對豐度比較 基于分類單元的相對豐度和注釋信息,對樣品中絕對豐度排名前20的屬繪制物種相對豐度柱狀圖(圖2)。經過生石灰處理的土壤和原始土樣中叢毛單胞菌科桿菌屬(Curvibacter)、芽孢桿菌屬(Bacillus)和類諾卡氏菌屬(Nocardioides)菌群的物種相對豐度較高,其中生石灰處理的土壤中叢毛單胞菌科桿菌屬、芽孢桿菌屬和類諾卡氏菌屬菌群所占比例分別為6.29%、5.44%和4.13%,原始土樣中這3種菌群所占比例分別為17.15%、11.63%和6.52%。經過敵克松處理的土壤水小桿菌屬(Aquabacterium)、芽孢桿菌屬和叢毛單胞菌科桿菌屬菌群的相對豐度較高。經過根寶和甲霜噁霉靈處理的土壤叢毛單胞菌科桿菌屬、芽孢桿菌屬和水小桿菌屬菌群的相對豐度較高。枯草芽孢桿菌處理后,土壤中叢毛單胞菌科桿菌屬、芽孢桿菌屬、類諾卡氏菌屬和鞘氨醇單胞菌屬(Sphingomonas)菌群的相對豐度較高。對照土壤中叢毛單胞菌科桿菌屬、水小桿菌屬和芽孢桿菌屬菌群的相對豐度較高。原始土樣中相對豐度排名前20的細菌菌群相對豐度總和為54.98%,經過1年西瓜連作種植后,降低到31.65%~43.08%。由此可見,連作之后土壤中的細菌菌群相對豐度降低。經過枯草芽孢桿菌處理的土壤中芽孢桿菌屬菌群相對豐度提高。經過敵克松處理的土壤中水小桿菌屬菌群相對豐度明顯高于其他處理。
2.2.2 不同土壤處理真菌屬水平主要物種相對豐度比較 從圖3可以看出,生石灰處理后,土壤中紅菇屬(Russula)、鐮刀菌屬(Fusarium)和雙水母屬(Amphinema)菌群的相對豐度較高。敵克松處理后,土壤中紅菇屬、鐮刀菌屬、雙水母屬和曲霉屬(Aspergillus)菌群相對豐度較高。根寶處理后,土壤中曲霉屬、鐮刀菌屬、紅菇屬和蠟殼耳屬(Sebacina)菌群相對豐度較高。枯草芽孢桿菌處理后,土壤中紅菇屬、曲霉屬和鐮刀菌屬菌群相對豐度較高。甲霜噁霉靈處理和對照土壤中紅菇屬、曲霉屬、蠟殼耳屬和鐮刀菌屬菌群相對豐度較高。原始土樣中曲霉屬、紅菇屬和鐮刀菌屬菌群相對豐度較高。由此可見,連作提高了土壤中鐮刀菌屬真菌的比例。同時連作土壤中相對豐度排名前20的真菌菌群相對豐度明顯上升,均高于原始土樣。
2.3 不同處理土壤微生物多樣性指數
由表2可知,不同土壤處理之間細菌多樣性指數無顯著差異。原始土樣細菌群落豐富度指數、屬個數和譜系多樣性指數分別為1 836.75、1 461.00和107.07,其細菌群落相對豐度和多樣性均顯著低于其他處理。不同土壤處理之間的真菌多樣性指數無顯著差異。原始土樣真菌的屬個數、譜系多樣性指數、香農-威娜指數和辛普森多樣性指數分別為2 379.330 0、316.070 0、6.580 0和0.909 6,均顯著低于其他處理,表明其真菌群落的多樣性較低。
2.4 不同處理土壤養分含量和理化性質對土壤微生物群落組成的影響
由表3可知,土壤中芽孢桿菌屬菌群的相對豐度和銨態氮含量呈顯著正相關,和EC值呈顯著負相關。類諾卡氏菌屬菌群相對豐度與EC值呈極顯著負相關。特呂珀菌屬菌群的相對豐度與土壤pH值呈極顯著負相關,相關系數為-0.681;與EC值呈極顯著正相關。未識別菌群(EcFYyy-200)的相對豐度和土壤pH值呈極顯著正相關。遲鈍水桿型菌屬菌群的相對豐度與EC值呈極顯著正相關。未識別菌群(Subgroup 10)的相對豐度和土壤中的有效鉀含量呈顯著正相關。產蛋白酶中度嗜鹽菌屬菌群的相對豐度和土壤pH值呈顯著負相關。膨脹芽胞桿菌屬菌群的相對豐度和土壤pH值呈顯著負相關,和EC值呈顯著正相關。未識別菌群(Paenisporosarcina)的相對豐度和土壤pH值呈極顯著正相關;和EC值呈顯著負相關。擬綠膠藍細菌屬菌群的相對豐度與土壤pH值呈顯著正相關。未識別菌群(Gaiella)的相對豐度與土壤中有效鉀含量呈極顯著正相關。其他菌群的相對豐度與土壤EC值呈顯著正相關。與土壤銨態氮含量呈顯著正相關的細菌菌群有1個,與有效鉀含量呈顯著正相關的細菌菌群有2個,與土壤pH值具有顯著相關性的細菌菌群有6個,與EC值具有顯著相關性的細菌菌群有7個。速效磷含量的改變對土壤細菌菌群的相對豐度無影響。
相對細菌菌群而言,真菌菌群的相對豐度受土壤理化性質影響較小。曲霉屬菌群的相對豐度與土壤有效鉀含量呈顯著正相關。鐮刀菌屬菌群的相對豐度與土壤EC值呈顯著正相關。雙水母屬菌群的相對豐度與土壤銨態氮含量呈顯著負相關,與EC值呈極顯著正相關。被孢霉屬菌群的相對豐度與土壤EC值呈顯著正相關。粘蓋牛肝菌屬菌群的相對豐度與土壤銨態氮含量呈顯著負相關。毛殼菌屬菌群的相對豐度與土壤pH值呈極顯著正相關。與土壤銨態氮含量顯著負相關的真菌菌群有2個,與有效鉀含量顯著正相關的真菌菌群有1個,與土壤pH值極顯著正相關的真菌菌群有1個,與EC值具有顯著相關性的真菌菌群有3個。速效磷含量對土壤真菌菌群的相對豐度無影響。
3 討論
多種因素相互作用導致了土壤連作障礙,其中土壤微環境惡化和植物自毒作用兩方面的因素起主導作用[15-16]。土壤微生物多樣性研究主要集中在物種多樣性、遺傳多樣性、結構多樣性及功能多樣性4個方面。同種作物連續種植多年后,根系土壤微環境發生變化,土壤肥力降低,土壤中細菌菌群數量和相對豐度降低,真菌菌群數量和相對豐度增加,標志著土壤開始衰竭[17]。其他作物,比如葡萄,經過連作后土壤中細菌群落多樣性降低11.7%,真菌群落多樣性降低5.2%,微生物種類與構成發生了顯著變化[18]。本研究結果也表明,經過2年西瓜連作后,細菌群落的多樣性明顯降低,相對豐度排名前20的細菌菌群相對豐度總和顯著降低。而土壤中真菌菌群的相對豐度明顯上升。其次連作導致土壤微生物多樣性失調,微生物的碳代謝水平顯著下降[19-20]。最后連作導致土壤中有害菌群和根結線蟲增加。本研究結果表明,連作后土壤中鐮刀菌屬真菌的比例增加。也有相關研究結果表明,蘋果連作后,土壤中鐮刀菌的數量比對照提高了6倍,植株出現莖粗降低、株高下降的現象[21]。
土壤改良是解決連作障礙的方法之一。一是增施有機肥。合理配方施肥,減少化肥用量,可以改善土壤理化性狀,調節土壤微環境,緩解連作障礙。研究發現,番茄連作時增施有機肥可提高脲酶活性,降低過氧化氫酶活性,改善設施土壤微環境[22]。增施全水溶性有機肥后,連作甜瓜的株高、葉片數及根莖葉鮮質量均顯著提高,從而增加了甜瓜的產量[23]。本研究結果也表明,增施氨基酸水溶肥根寶后,土壤中養分綜合含量提高。二是添加土壤改良劑。研究結果表明,連續種植桃樹的土壤中施用生物炭,可提高有機質含量及蔗糖酶活性[24]。三是對土壤消毒。
常用的方法有日光曝曬、高溫悶棚和化學藥劑消毒等。本試驗安排的生石灰、敵克松和甲霜噁霉靈處理均基于此,但效果并不顯著。四是生物防治,增加有益微生物數量。研究結果表明,在番茄定植時采用解淀粉芽孢桿菌B1619處理土壤,番茄枯萎病菌種群數量比對照平均下降了43%[25]。本研究采用枯草芽孢桿菌處理土壤后,叢毛單胞菌科桿菌屬菌落相對豐度明顯下降。
微生物多樣性分析主要針對物種組成的豐富度和均勻度進行分析,反映微生物生態層次上的改變,包括種類、遺傳等以及微生物群落的穩定性[26]。微生物多樣性是評估土壤質量和生態系統的重要指標[27-31]。使用基于屬的絕對豐度及注釋信息,可有效評估樣本的物種注釋分辨率及復雜度。屬個數指數和菌種豐富度指數反映群落豐富度和樣品測序量。香農-威娜指數和辛普森指數反映群落多樣性和物種均勻度。譜系多樣性指數反映樣品中物種進化歷史過程中的差異。測序深度指數反映測序深度,即測序時樣品中細菌屬或真菌屬的覆蓋程度。本研究發現,不同土壤處理間細菌多樣性指數無顯著差異,原始土樣細菌菌群豐富度指數、屬個數和譜系多樣性指數分別為1 836.75、1 461.00和107.07,均低于其他處理。不同土壤處理之間的真菌多樣性指數無顯著差異。原始土樣真菌的屬個數、譜系多樣性指數、香農-威娜指數和辛普森指數均低于其他處理,表明其真菌群落的多樣性較低。
研究結果表明,土壤理化性質、養分含量與微生物群落組成關系密切[32-33]。吳朝暉等[34]研究發現,水稻土中的變形菌門群落相對豐度主要受有機質含量影響,而擬桿菌門群落則主要受速效磷含量影響。陳孟立等[35]研究發現,黃土丘陵地區土壤中細菌群落組成主要受土壤全氮和有機質含量影響。本研究結果表明,土壤中芽孢桿菌屬菌群相對豐度與銨態氮含量呈顯著正相關,與EC值呈顯著負相關。類諾卡氏菌屬菌群相對豐度與EC值呈極顯著負相關。相對細菌菌群而言,真菌菌群受土壤理化性質影響較小。曲霉屬菌群相對豐度與土壤有效鉀含量呈顯著正相關。鐮刀菌屬菌群相對豐度與土壤EC值呈顯著正相關。雙水母屬菌群相對豐度與土壤銨態氮含量呈顯著負相關,與EC值呈極顯著正相關。
參考文獻:
[1] 陳名蔚,王 峰,韓益飛,等.蔬菜連作障礙成因分析和防止技術初探[J].南方農業,2017,11(30):3-4.
[2] 姜 永.蔬菜生產連作障礙的發生與綜合防治措施[J].吉林蔬菜,2013(7):26-27.
[3] 唐麗雪,馮桂芳,丁原書,等.大棚蔬菜根結線蟲病害調查研究以及防治對策[J].科技視界,2016(7):52,79.
[4] 王光飛,高曉東,馬 艷,等.生物有機類復合調理劑在設施葉菜障礙土壤上的應用效果[J].中國土壤與肥料,2020(2):56-65.
[5] 孫 巖,劉學東,侯秀明,等.作物自毒作用研究和防治技術[J].上海蔬菜,2020(3):88-89.
[6] 王軍芳.設施蔬菜土壤環境惡化原因及防治對策[J].農業開發與裝備,2019(8):170-171.
[7] LI R F, XU Y. Fermentation optimization to improve production of antagonistic metabolites by Bacillus subtilis strain BS501a[J]. Journal of Central South University of Technology,2011(18): 1047-1053.
[8] 何世朋,梁 斌,武德軍,等.設施菜地番茄的養分需求規律研究[J/OL].華北農學報,2020,35(5)61-67[2020-10-12].http://kns.cnki.net/kcms/detail/13.1101.S.20200730.1329.002.html.
[9] ANDRE P M,ANDREA K B,JAKUB M T,et al. PANDAseq: paired-end assembler for illumina sequences[J]. BMC Bioinformatics, 2012,13:31-38.
[10]EDGAR R. Taxonomy annotation and guide tree errors in 16S rRNA databases.[J]. Peer J,2018,6(4):e5030.
[11]BRIAN D O,NICHOLAS H B,ADAM M P. Interactive metagenomic visualization in a Web browser[J]. BMC Bioinformatics,2011,12(1):385-392.
[12]DAVIDE B,RUBEN G O,PHILIPP C M,et al. Structure and function of the bacterial root microbiota in wild and domesticated barley[J]. Cell Host & Microbe,2015,17(3):392-403.
[13]ROBERT S,ROBERT E. Quality control and preprocessing of metagenomic datasets[J]. Bioinformatics,2011,27(6):863-864.
[14]NGUYEN M T,RANAMUKHAARACHCHI S L. Soil-borne antagonists for biological control of bacterial wilt disease caused by ralstonia solanacearum in tomato and pepper[J]. Journal of Plant Pathology,2010,92(2):395-405.
[15]甄文超,曹克強,胡同樂,等.作物再植病害的研究進展[J].河北農業大學學報,2001,24(4):98-103.
[16]李瓊芳.不同連作年限麥冬根際微生物區系動態研究[J].土壤通報,2006,37(3):563-565.
[17]李晶晶,續勇波.百合連作年限對設施土壤理化性質和生物學特性的影響[J].土壤通報,2019,50(5):1171-1177.
[18]李 坤,郭修武,孫英妮,等.葡萄連作對土壤細菌和真菌種群的影響[J].應用生態學報,2009,20(12):3109-3114.
[19]鄒春嬌,齊明芳,馬 建,等.Biolog-ECO解析黃瓜連作營養基質中微生物群落結構多樣性特征[J].中國農業科學,2016,49(5):942-951.
[20] JIE W , BAI L , YU W , et al. Analysis of interspecific relationships between Funneliformis mosseae and Fusarium oxysporum in the continuous cropping of soybean rhizosphere soil during the branching period[J]. Biocontrol Science and Technology,2015,25(9):1036-1051.
[21]張志敏,趙政陽,樊紅科,等.蘋果根區土壤鐮刀菌對再植砧木苗生長的影響[J].干旱地區農業研究,2009,27(2):204-207,217.
[22]劉中良,高俊杰,谷端銀,等.有機肥對設施番茄周年栽培土壤環境和產量的影響[J].應用生態學報,2020,31(3):929-934.
[23]沐 嬋,錢榮青,王海波,等.全水溶性有機肥對設施連作種植甜瓜產量及產值的影響[J].農業科技通訊,2020(8):126-128.
[24]張曉穎.生物質炭緩解桃連作障礙的效應研究[D].武漢:華中農業大學,2013.
[25]張 斌, 楊曉云, 陳志誼. 解淀粉芽孢桿菌生防菌B1619對設施番茄枯萎病的防治效果[C]//中國植物保護學會. 病蟲害綠色防控與農產品質量安全——中國植物保護學會2015年學術年會論文集.長春:中國農業科學技術出版社,2015.
[26]KENNEDY A C, SMITH K L. Soil microbial diversity and the sustainability of agricultural soils[J]. Plant and Soil,1995,170(1):75-86.
[27]DANIEL H B,THOMAS M S. Diversity and dynamics of microbial communities in soils from agro-ecosystems[J]. Environmental Microbiology,2003,5(6):441-521.
[28]徐勝濤,王攀磊,何 翔,等. 植物覆蓋對蕉園土壤質量和微生物多樣性的影響[J].南方農業學報,2020,51(3):496-504.
[29]張變華,靳東升,郜春花,等. 不同方法分析工礦復墾區不同植物根際微生物多樣性的比較[J]. 江蘇農業科學,2019,47(4):223-226.
[30]彭玉嬌, 崔學宇, 譚夢超,等. 不同立地條件沙田柚果園土壤微生物多樣性分析[J].南方農業學報,2020,51(5):1136-1144.
[31]林 峰,楊殿林,王華玲,等. 獼猴桃園生草對土壤微生物多樣性的影響[J].江蘇農業科學,2020,48(10):293-297.
[32]SAMANTA B C,BRUNO B L,FLAVIO A O,et al. Soil suppressiveness and its relations with the microbial community in a Brazilian subtropical agroecosystem under different management systems[J]. Soil Biology and Biochemistry,2016,96:191-197.
[33]葉 雯,李永春,喻衛武,等.不同種植年限香榧根際土壤微生物多樣性[J].應用生態學報,2018,29(11):3783-3792.
[34]吳朝暉,劉清術,孫繼民,等.基于高通量測序的超級稻不同生育期土壤細菌和古菌群落動態變化[J].農業現代化研究,2018,39(2):342-351.
[35]陳孟立,曾全超,黃懿梅,等.黃土丘陵區退耕還林還草對土壤細菌群落結構的影響[J].環境科學,2018,39(4):1824-1832.
(責任編輯:陳海霞)

