HCG11靶向miR-1297對(duì)肺癌細(xì)胞增殖、遷移、侵襲的影響及其機(jī)制
李亞明 潘雙 陳暉 劉松 張進(jìn)召
(西安醫(yī)學(xué)院第一附屬醫(yī)院 西安醫(yī)學(xué)院全科醫(yī)學(xué)院呼吸與危重癥醫(yī)學(xué)科,陜西 西安 710077)
肺癌是起源于支氣管上皮細(xì)胞或支氣管腺體的惡性腫瘤,其發(fā)病率和死亡率均居惡性腫瘤首位〔1〕。盡管肺癌的綜合診療技術(shù)不斷提高,但由于肺癌極易擴(kuò)散和轉(zhuǎn)移,對(duì)人類(lèi)的健康和生命已構(gòu)成嚴(yán)重威脅〔2,3〕。長(zhǎng)鏈非編碼RNA(LncRNA)是一類(lèi)長(zhǎng)度大于200個(gè)核苷酸的非編碼RNA,越來(lái)越多的研究證實(shí)LncRNA與惡性腫瘤的發(fā)生發(fā)展密切相關(guān)〔4,5〕。研究發(fā)現(xiàn),人類(lèi)白細(xì)胞抗原復(fù)合體(HCG)11在非小細(xì)胞肺癌(NSCLC)組織中表達(dá)下調(diào),HCG11的下調(diào)程度與存活時(shí)間顯著相關(guān),是NSCLC的新型生物標(biāo)志物和診斷靶標(biāo)〔6〕。此外,有研究指出HCG11的異常表達(dá)參與對(duì)肝癌和宮頸癌細(xì)胞的生物學(xué)行為調(diào)控〔7,8〕。但目前HCG11對(duì)肺癌細(xì)胞增殖遷移等生物行為的影響及其機(jī)制目前尚不清楚。本研究探究HCG11在肺癌轉(zhuǎn)移中的作用機(jī)制。
1 材料與方法
1.1實(shí)驗(yàn)材料 46例肺癌組織及與其配對(duì)的癌旁組織由西安醫(yī)學(xué)院第一附屬醫(yī)院于2016年1月至2018年1月收集。所有患者以前未經(jīng)過(guò)化療和放療。本研究在開(kāi)始前經(jīng)醫(yī)院倫理委員會(huì)批準(zhǔn),患者均簽訂知情同意書(shū)。肺癌細(xì)胞A549購(gòu)自美國(guó)ATCC,DMEM培養(yǎng)基、胎牛血清、青鏈霉素雙抗溶液、LipofectamineTM2000轉(zhuǎn)染試劑和Trizol試劑均購(gòu)自Invitrogen公司;四甲基偶氮唑藍(lán)(MTT)細(xì)胞增殖檢測(cè)試劑盒和Western印跡相關(guān)試劑均購(gòu)自中國(guó)碧云天公司;Transwell小室和基質(zhì)膠均購(gòu)自BD公司;pcDNA3.1、pcDNA3.1-HCG11、miR-NC、miR-1297 mimics、si-NC、si-HCG11、WT-HCG11和MUT-HCG11的構(gòu)建和測(cè)序均由上海生工公司提供;細(xì)胞周期蛋白(Cyclin)D1抗體、P21抗體、E-鈣黏附蛋白(E-cadherin)抗體和基質(zhì)金屬蛋白酶(MMP)-2抗體均購(gòu)自Abcam公司;辣根過(guò)氧化物酶(HRP)標(biāo)記的二抗購(gòu)自北京中杉金橋生物技術(shù)有限公司。
1.2方法
1.2.1細(xì)胞培養(yǎng)、轉(zhuǎn)染和實(shí)驗(yàn)分組 采用DMEM培養(yǎng)基(含有10%胎牛血清和1%青鏈霉素雙抗)于常規(guī)細(xì)胞培養(yǎng)箱(37℃、含5%CO2、濕度飽和)培養(yǎng)A549細(xì)胞。細(xì)胞轉(zhuǎn)染:將對(duì)數(shù)期的A549細(xì)胞按照每孔2×105個(gè)細(xì)胞的密度接種于6孔板,當(dāng)細(xì)胞融合度達(dá)到60%時(shí),用不含血清培養(yǎng)基同步化12 h后進(jìn)行轉(zhuǎn)染。將pcDNA3.1或pcDNA3.1-HCG11溶解于Opti-MEM培養(yǎng)基中室溫條件孵育5 min,同時(shí)另取LipofectamineTM2000加入到Opti-MEM培養(yǎng)基室溫孵育5 min,然后將兩者混合后室溫放置20 min,最后將含pcDNA3.1或pcDNA3.1-HCG11的混合物分別加入到A549細(xì)胞中,培養(yǎng)6 h后,更換為DMEM培養(yǎng)基繼續(xù)培養(yǎng)24、48、72 h后進(jìn)行后續(xù)實(shí)驗(yàn)。為進(jìn)一步證明HCG11是通過(guò)調(diào)控miR-1297表達(dá)進(jìn)而影響A549細(xì)胞的增殖和凋亡,將pcDNA3.1-HCG11和miR-1297 mimics同時(shí)轉(zhuǎn)染入A549細(xì)胞,檢測(cè)A549細(xì)胞的增殖和凋亡情況。實(shí)驗(yàn)分組如下:pcDNA3.1組(轉(zhuǎn)染pcDNA3.1)、pcDNA3.1-HCG11組(轉(zhuǎn)染pcDNA3.1-HCG11)、pcDNA3.1-HCG11+miR-NC組(同時(shí)轉(zhuǎn)染pcDNA3.1-HCG11和miR-NC)和pcDNA3.1-HCG11+ miR-1297組(同時(shí)轉(zhuǎn)染pcDNA3.1-HCG11和miR-1297 mimics)。
1.2.2實(shí)時(shí)熒光定量-聚合酶鏈反應(yīng)(qRT-PCR)檢測(cè) 利用Trizol試劑分別提取46例肺癌組織和與其配對(duì)的癌旁組織應(yīng)激各組A549細(xì)胞的總RNA。利用逆轉(zhuǎn)錄酶合成cDNA,并以cDNA為模板按照說(shuō)明書(shū)進(jìn)行qRT-PCR擴(kuò)增。用2-ΔΔCt法計(jì)算HCG11和miR-1297的相對(duì)表達(dá)量,分別以GAPDH和U6為內(nèi)參。引物序列如下:miR-1297上游引物:5′-ACACTCCAGCTGGGTTCAAGTAATTCAGG-3′,下游引物:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTC-3′,HCG11上游引物:5′-GCTCTATGCCATCCTGCTT-3′,下游引物:5′-TCCCATCTCCATCAACCC-3′,GAPDH上游引物:5′-TGTTCGTCATGGGTGTGAAC-3′,下游引物:5′-ATGGCATGGACTGTGGTCAT-3′,U6上游引物:5′-GATTTCTCCCTCATCGCTTACAG-3′,下游引物:5′-CTGCTTCATGATCGTTGTTGCTTG-3′。
1.2.3雙熒光素酶報(bào)告基因檢測(cè) 利用Starbase進(jìn)行靶基因預(yù)測(cè)發(fā)現(xiàn),HCG11與miR-1297存在連續(xù)結(jié)合位點(diǎn),猜測(cè)miR-1297是HCG11的靶基因,并利用雙熒光素酶報(bào)告基因檢測(cè)進(jìn)行驗(yàn)證。構(gòu)建野生型WT-HCG11和突變型MUT-HCG11的HCG11-3′UTR熒光素酶報(bào)告基因載體,利用LipofectamineTM2000將miR-1297模擬物和miR-NC分別與WT-HCG11或MUT-HCG11同時(shí)轉(zhuǎn)染入A549細(xì)胞,常規(guī)培養(yǎng)48 h后,利用雙熒光素酶報(bào)告基因檢測(cè)試劑盒測(cè)定各組細(xì)胞的熒光素酶活性。
1.2.4MTT比色法檢測(cè)細(xì)胞活力 分別取各組對(duì)數(shù)生長(zhǎng)期細(xì)胞,胰酶消化后接種(2×103個(gè)/孔)于96孔板,分別在24、48和72 h時(shí)加入MTT試劑(20 μl/孔)孵育4 h,棄去上清液后每孔再加入DMSO試劑(150 μl/孔),繼續(xù)孵育2 h至結(jié)晶完全溶解。全自動(dòng)酶標(biāo)儀檢測(cè)490 nm處各孔的OD值。
1.2.5Transwell法檢測(cè)細(xì)胞遷移和侵襲能力 侵襲實(shí)驗(yàn):取50 μl已稀釋的基質(zhì)膠包被于Transwell小室上室膜,凝固后備用。細(xì)胞轉(zhuǎn)染48 h后,用胰酶消化細(xì)胞,用DMEM培養(yǎng)基(不含血清)重懸細(xì)胞調(diào)整細(xì)胞濃度約為2×105/ml。上室加入100 μl的細(xì)胞懸液,下室加入DMEM培養(yǎng)基(含10%血清),于細(xì)胞培養(yǎng)箱常規(guī)培養(yǎng)24 h后,用棉簽擦去上室膜未穿膜的細(xì)胞,用甲醇固定下室膜30 min,0.5%的結(jié)晶紫染液染色10 min,洗去多余染液,倒置于顯微鏡下觀(guān)察下室室面的細(xì)胞個(gè)數(shù),隨機(jī)選取5個(gè)視野進(jìn)行拍照,計(jì)數(shù),取均值為細(xì)胞侵襲數(shù)目。遷移實(shí)驗(yàn)采用未包被基質(zhì)膠的Transwell小室,其他步驟同上。
1.2.6Western印跡檢測(cè) 采用RIPA裂解液提取各組A549細(xì)胞的總蛋白,用BCA試劑盒進(jìn)行定量,調(diào)整蛋白濃度。取適量蛋白樣品,上樣后進(jìn)行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE),電轉(zhuǎn)至聚偏氟乙烯(PVDF)膜后,用Western封閉液室溫封閉60 min,Western洗滌液洗膜后,加入已稀釋的相應(yīng)的Ⅰ抗4℃?zhèn)葦[搖床孵育過(guò)夜,Western洗滌液洗膜后,加入相應(yīng)的已稀釋的Ⅱ抗室溫條件孵育1 h,化學(xué)發(fā)光顯色后拍照,成像掃描分析系統(tǒng)測(cè)定目的條帶的灰度值。
1.3統(tǒng)計(jì)學(xué)方法 采用SPSS20.0軟件進(jìn)行t檢驗(yàn)、單因素方差分析。
2 結(jié) 果
2.1HCG11和miR-1297在肺癌組織和癌旁組織中的表達(dá) 與癌旁組織組比較,肺癌組織組HCG11的表達(dá)顯著下調(diào),miR-1297的表達(dá)顯著上調(diào)(均P<0.05)。見(jiàn)表1。

表1 HCG11、miR-1297在肺癌組織和癌旁 組織中的表達(dá)
2.2過(guò)表達(dá)HCG11對(duì)細(xì)胞A549增殖的影響 與pcDNA3.1組比較,pcDNA3.1-HCG11組A549細(xì)胞HCG11的表達(dá)顯著上調(diào)(P<0.05),表明成功構(gòu)建了過(guò)表達(dá)HCG11的A549細(xì)胞株。與pcDNA3.1組比較,pcDNA3.1-HCG11組A549細(xì)胞在24 h、48 h和72 h細(xì)胞活力顯著降低,促增殖蛋白CyclinD1的表達(dá)顯著降低,增殖抑制蛋白P21的表達(dá)顯著上調(diào)(P<0.05)。表明過(guò)表達(dá)HCG11可抑制A549細(xì)胞的增殖。見(jiàn)表2、圖1。

表2 過(guò)表達(dá)HCG11對(duì)細(xì)胞A549增殖的影響

圖1 過(guò)表達(dá)HCG11對(duì)細(xì)胞A549增殖蛋白表達(dá)的影響
2.3過(guò)表達(dá)HCG11對(duì)細(xì)胞A549遷移、侵襲的影響 與pcDNA3.1組相比,pcDNA3.1-HCG11組A549細(xì)胞遷移侵襲促進(jìn)蛋白MMP-2的表達(dá)顯著降低,遷移侵襲抑制E-cadherin的表達(dá)顯著升高,遷移侵襲細(xì)胞數(shù)目顯著減少(P<0.05)。見(jiàn)圖2、表3、圖3。

圖3 過(guò)表達(dá)HCG11對(duì)細(xì)胞A549遷移、侵襲的影響

表3 過(guò)表達(dá)HCG11對(duì)細(xì)胞A549遷移、侵襲的影響

圖2 過(guò)表達(dá)HCG11對(duì)細(xì)胞A549遷移、侵襲的 影響(結(jié)晶紫染色,×200)
表明過(guò)表達(dá)HCG11可抑制A549細(xì)胞的遷移和侵襲。
2.4HCG11靶向調(diào)控miR-1297的表達(dá) Starbase在線(xiàn)預(yù)測(cè)顯示,HCG11與miR-1297存在連續(xù)結(jié)合位點(diǎn),見(jiàn)圖4。當(dāng)上調(diào)miR-1297表達(dá)后,轉(zhuǎn)染W(wǎng)T-HCG11的3′UTR報(bào)告基因載體的A549細(xì)胞熒光素酶活性顯著降低(P<0.05),而轉(zhuǎn)染MUT-HCG11的3′UTR報(bào)告基因載體的A549細(xì)胞熒光素酶活性無(wú)顯著變化(P>0.05)。見(jiàn)表4。與pcDNA3.1組A549細(xì)胞miR-1297的表達(dá)(0.88±0.09)相比,pcDNA3.1-HCG11組(0.30±0.03)顯著降低;與si-NC組(0.89±0.09)相比,si-HCG11組(1.43±0.14)顯著升高(P<0.05)。表明miR-1297是HCG11的靶基因,miR-1297可靶向負(fù)性調(diào)控HCG11的表達(dá)。

圖4 HCG11靶向miR-1297
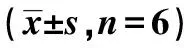
表4 雙熒光素酶報(bào)告實(shí)驗(yàn)
2.5過(guò)表達(dá)miR-1297能逆轉(zhuǎn)HCG11對(duì)細(xì)胞A549增殖的抑制作用 與pcDNA3.1組相比,與pcDNA3.1-HCG11+miR-NC比較,pcDNA3.1-HCG11+miR-1297組A549細(xì)胞miR-1297和Cyclin D1蛋白的表達(dá)顯著升高,P21蛋白的表達(dá)顯著降低,A549細(xì)胞在24 h、48 h和72 h細(xì)胞活力顯著增強(qiáng)(P<0.05)。見(jiàn)圖5、表5。表明過(guò)表達(dá)miR-1297可逆轉(zhuǎn)HCG11對(duì)A549細(xì)胞的增殖抑制作用。

1~2:pcDNA3.1-HCG11+miR-1297組,下圖同圖5 過(guò)表達(dá)miR-1297能逆轉(zhuǎn)HCG11對(duì)細(xì)胞A549 增殖蛋白表達(dá)的影響
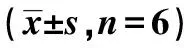
表5 過(guò)表達(dá)miR-1297能逆轉(zhuǎn)HCG11對(duì)細(xì)胞A549增殖的抑制作用
2.6過(guò)表達(dá)miR-1297能逆轉(zhuǎn)HCG11對(duì)細(xì)胞A549遷移、侵襲的抑制作用 與pcDNA3.1-HCG11+miR-NC組相比,pcDNA3.1-HCG11+miR-1297組A549細(xì)胞E-cadherin蛋白的表達(dá)顯著降低,MMP-2蛋白的表達(dá)顯著升高,遷移和侵襲細(xì)胞數(shù)目顯著增多(P<0.05)。見(jiàn)圖6、表6。表明過(guò)表達(dá)miR-1297可逆轉(zhuǎn)HCG11對(duì)A549細(xì)胞遷移和侵襲的抑制作用。

圖6 過(guò)表達(dá)miR-1297能逆轉(zhuǎn)HCG11對(duì)細(xì)胞A549遷移、 侵襲蛋白表達(dá)的影響
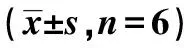
表6 過(guò)表達(dá)miR-1297能逆轉(zhuǎn)HCG11對(duì)細(xì)胞A549遷移、侵襲的抑制作用
3 討 論
肺癌是世界上最常見(jiàn)的實(shí)體腫瘤,NSCLC約占所有肺癌病例的80%,肺癌細(xì)胞的侵襲轉(zhuǎn)移是肺癌相關(guān)死亡的主要原因〔9,10〕。但是,對(duì)肺癌細(xì)胞的侵襲轉(zhuǎn)移的機(jī)制仍知之甚少,且目前尚無(wú)有效治療肺癌細(xì)胞侵襲轉(zhuǎn)移的有效方法。因此,了解肺癌細(xì)胞的侵襲轉(zhuǎn)移機(jī)制,尋找新的治療靶點(diǎn),對(duì)提高肺癌治療和改善患者預(yù)后具有重要意義。
LncRNA參與調(diào)控惡性腫瘤的發(fā)生發(fā)展已被證實(shí)〔11〕。Liu等〔12〕研究發(fā)現(xiàn),HCG11在乳腺癌中表達(dá)上調(diào),HCG11的異常表達(dá)與乳腺癌患者較差的總體生存率相關(guān);Xu等〔7〕研究發(fā)現(xiàn),HCG11在肝癌組織中也呈高表達(dá),敲減HCG11導(dǎo)致細(xì)胞活力、增殖和遷移能力下降;然而,Zhang等〔13〕研究發(fā)現(xiàn),HCG11在前列腺癌中表達(dá)下調(diào),Wang等〔14〕進(jìn)一步研究發(fā)現(xiàn)過(guò)表達(dá)HGC11通過(guò)下調(diào)miR-543表達(dá)抑制PI3K/AKT信號(hào)通路,進(jìn)而抑制前列腺癌細(xì)胞的增殖、遷移和侵襲,并誘導(dǎo)細(xì)胞凋亡。本研究通過(guò)qRT-PCR證實(shí)HGC11在肺癌組織中呈低表達(dá),這與常芬等〔6〕研究結(jié)果相一致。本研究結(jié)果表明HGC11在肺癌中發(fā)揮抑癌基因作用。HGC11下游靶基因眾多,意味著HGC11有多種調(diào)控通路。在直腸癌中,HGC11通過(guò)靶向下調(diào)miR-144-3p,進(jìn)而上調(diào)轉(zhuǎn)錄因子E盒結(jié)合鋅指蛋白(ZEB)1的表達(dá),促進(jìn)直腸癌的發(fā)生和轉(zhuǎn)移〔15〕;陳曉杰等〔16〕指出HGC11可能通過(guò)調(diào)控miR-590-3p表達(dá)進(jìn)而影響宮頸鱗狀細(xì)胞癌患者的預(yù)后發(fā)揮抑癌基因作用;HGC11還可直接作用于miR-4425,促進(jìn)腫瘤轉(zhuǎn)移相關(guān)基因(MTA)3表達(dá),進(jìn)而抑制膠質(zhì)瘤的生長(zhǎng)〔17〕。可見(jiàn)HGC11參與調(diào)控多種惡性腫瘤的生物學(xué)行為,但HGC11在肺癌中的分子機(jī)制尚不清楚。
miR-1297是基于不同的癌癥細(xì)胞而發(fā)揮癌基因或抑癌基因作用的微小RNA〔18〕。卜文瑾〔19〕研究發(fā)現(xiàn),miR-1297在肺癌細(xì)胞中表達(dá)上調(diào),抑制miR-1297表達(dá)細(xì)胞增殖率降低。本研究發(fā)現(xiàn)miR-1297是HGC11的潛在靶基因。因此,推測(cè)HGC11/miR-1297分子軸參與調(diào)控肺癌細(xì)胞的侵襲和轉(zhuǎn)移。本研究結(jié)果表明,HCG11通過(guò)靶向下調(diào)miR-1297表達(dá)從而抑制肺癌細(xì)胞的增殖、遷移和侵襲,遏制肺癌的惡性發(fā)展。
- 中國(guó)老年學(xué)雜志的其它文章
- 家庭陪護(hù)人員健康素養(yǎng)與老年冠心病患者生活質(zhì)量的相關(guān)性
- 三氯生通過(guò)ERK/NF-κB/MMP-2/-9途徑促進(jìn)卵巢癌細(xì)胞遷移和侵襲
- 人胎盤(pán)間充質(zhì)干細(xì)胞對(duì)急性肺損傷患者炎癥反應(yīng)的影響
- 淡豆豉提取物通過(guò)調(diào)控LncRNA miR155HG/miR-409-3p表達(dá)抑制肺癌細(xì)胞的增殖、遷移和侵襲
- 抑制miR-21-5p表達(dá)通過(guò)靶向FOXP2調(diào)控肺癌細(xì)胞增殖和凋亡
- 基于補(bǔ)體及凝血級(jí)聯(lián)通路及PI3K-AKT信號(hào)通路探究抵擋湯對(duì)急性出血性腦卒中大鼠蛋白組學(xué)的影響

