原發性肺淋巴瘤22例臨床與病理學相關特征分析
汪睿 陳文俊 徐凌 顧康生
淋巴瘤為源自淋巴組織以及淋巴結位置免疫系統惡性腫瘤,主要表現為局部腫塊或者進展性無壓痛淋巴結腫大,在我國每10萬人中約有2人患有淋巴瘤,而每10萬淋巴瘤患者中有近1.5人會因此失去生命[1]。肺淋巴瘤為機體其他位置淋巴瘤肺部浸潤導致,多為遠處淋巴瘤血行轉移或者縱隔淋巴結直接浸潤到肺部造成,所有淋巴瘤中有近25%~40%為肺淋巴瘤,依據病灶原發情況可以分為原發性肺淋巴瘤(primary pulmonary lymphoma,PLL)與繼發性肺淋巴瘤[2-3]。PLL僅占各種淋巴瘤的1%,病例數相對較少,因此其臨床病理以及特征資料相對缺乏,但是PLL病理類型以及位置不同患者臨床表現以及預后存在顯著差異,部分患者預后良好,但是有少量患者病情迅速進展,預后相對較差[4-5]。基于此,本研究收集2010年1月-2018年6月經病理組織診斷為PLL的22例病例,回顧性分析其相關臨床資料,以期為此類患者診斷以及針對性治療提供參考依據。
資料與方法
一、一般資料
選擇2010年1月-2018年6月在我院經病理組織診斷為PLL的22例病例,納入標準:① 免疫組化、影像學檢查、病理組織學證實患者病情;② 病灶開始出現在肺組織,未侵犯其他位置;③患者所有資料完整。排除標準:① 并發其他惡性腫瘤者;② 繼發性肺淋巴瘤;③ 并發其他肺部疾病者;④ 存在淋巴瘤病史者;⑤ 資料不全者。
二、 方法
1 血清指標測定
患者入院后收集晨起空腹靜脈血離心處理后獲得上清液,測定癌胚抗原、非小細胞癌相關抗原、糖類抗原153、神經元特異性烯醇化酶、糖類抗原199、糖類抗原125、乳酸脫氫酶以及C反應蛋白水平,測定均采用酶聯免疫吸附法,測定試劑盒均購自Elabscience公司。
2 病理檢查
患者均行肺部病理組織學檢查,經皮肺穿刺活組織、手術肺切除組織以及經支氣管鏡肺組織病理檢查分別有7例、12例以及3例。取得肺組織樣本應用濃度10%中性甲醛進行24h固定,取材后進行脫水、包埋、切片等處理,進行HE染色后在顯微鏡下進行觀察。應用En Vision二步法進行免疫組化染色:一抗選擇Bcl-2、CD138、波形蛋白、CD20、甲狀腺轉錄因子(TTF-1)、S-100、CD23、結蛋白、CD38、細胞角蛋白(CK)、CD79a、上皮細胞膜抗原(EMA)、CK7、Ki-67、Cyclin D1、TLE-1,均來自Dako公司,在4 ℃環境下孵育過夜,第2天將一抗棄去后應用二抗進行30min孵育,DBA顯色復染后封片。兩位專業資深病理醫師對染色結果進行分析,設定陰性以及陽性對照,將切片劃分為4個象限,分別在每個象限中隨機選擇100個細胞進行計數,仔細觀察病灶細胞,細胞選擇標準為:存在無重疊孤立、邊界完整以及雜交信號清晰細胞核。Bcl-2、CD138、CD20、CD23、CD38、CK、CD79a、CyclinD1、EMA、S-100均存在于細胞膜或者細胞質中,結蛋白、波形蛋白以及CK7則存在于細胞質,TTF-1、Ki-67以及TLE-1存在于細胞質,無抗原存在位置陽性染色不能判定為陽性[6]。
3 影像學檢查
15例患者行CT掃描,包括常規平掃以及增強掃描,5例直接進行增強掃描,2例進行高分辨率CT掃描。掃描檢查應用Briliance256層螺旋CT掃描儀(荷蘭飛利浦公司)。進行掃描時患者需要仰臥,雙上肢上舉,掃描范圍從肺尖到肺底,患者掃描時需要深吸氣屏氣,從頭側掃描到足側。在進行掃描之前需要行碘過敏試驗,引導患者呼吸,將80~85mL碘佛醇以3.5mL/s速度經由肘前靜脈注入,注入完成后30s、60s、90s進行掃描,縱隔窗、肺窗薄層重建均在層距以及層厚0.6mm下進行,掃描相關參數:準直、電流、旋轉時間、掃描時間、電壓以及視野分別為(96~128層)×0.625mm、125 mAs、0.27s/周、3~5s、130kV、300~450m。獲得影像學結果由2位經驗豐富影像科醫師分析影像學資料,分析內容包括病灶大小、數量、位置、密度以及形態,強化方式、征象以及CT值。
4 治療方法
患者接受放化療,CHOP(環磷酰胺、阿霉素、長春新堿、潑尼松)方案:在第1d以375mg/m2注入環磷酰胺、以50mg/m2注入阿霉素、以1.4mg/m2注入長春新堿;在第1~5d以100mg/(m2·d)注入潑尼松;21d為一個治療周期。FMD(順鉑,地塞米松,吉西他濱,培門冬酶)方案:在第1d、第8d,以1 000mg/(m2·d)注入吉西他濱;第1d以2 500IU/m2肌肉注射培門冬酶;第1~4d以25mg/(m2·d)注入順鉑;在第1~5d以12mg/(m2·d)注入地塞米松;21d為一個治療周期。SMILE(甲氨蝶呤、異環磷酰胺、左旋門冬酰胺酶、美司鈉、依托泊苷)方案:在第1d以2g/m2注入甲氨蝶呤;第2~4d以1 500mg/(m2·d)注入異環磷酰胺、以300mg/(m2·d)注入美司鈉、以100mg/(m2·d)注入依托泊苷,在第3~9d以6 000IU/(m2·d)注入左旋門冬酰胺酶;21d為一個治療周期。依據Cheson標準評估患者療效,將患者療效分為完全緩解、部分緩解、疾病穩定以及疾病進展[7]。
5 隨訪
依據電話、門診復查等方式進行隨訪,隨訪時間從患者病情確診開始,到患者死亡或者隨訪終末期截止。總生存期(overall survival,OS)為病情確診到死亡或者隨訪終末期時間,無進展生存期(progression-free survival,PFS)為從首次治療至第一次病情進展或者死亡時間。
三、統計學分析
本研究中數據應用SPSS 20.0軟件進行分析,計量資料以及計數資料分別表示為(均數±標準差)與例(%),數據采用描述性統計學分析。
結 果
一、臨床特點
22例患者其中13例男性,9例女性。分期Ⅰ,Ⅱ,Ⅲ,Ⅳ期均有患者,病理類型包含肺原發MALT,原發肺彌漫大B細胞淋巴瘤,原發肺B細胞及T細胞淋巴瘤。具體資料(見表1)。
二、臨床表現與血清指標變化分析
22例患者中臨床表現主要為咳嗽(90.91%)、發熱(81.82%)、胸部疼痛(68.18%)、體重減輕(54.55%)、胸悶(22.73%)以及氣促(13.64%)。與正常值比較,大部分患者血清指標,如癌胚抗原、細胞角蛋白19片段抗原21-1、糖類抗原153、神經元特異性烯醇化酶、糖類抗原199、乳酸脫氫酶水平正常,但是其中2例患者癌胚抗原CEA升高、5例患者細胞角蛋白-19片段輕度升高、4例患者糖類抗原153輕度升高、1例神經元特異性烯醇化酶輕度升高、1例糖類抗原199輕度升高、4例患者乳酸脫氫酶升高,而11例患者糖類抗原125升高,17例患者C反應蛋白水平升高(見表2)。

表2 22例患者臨床表現與血清指標水平分析
三、CT影像學結果分析
22例患者中單發以及多發病灶分別為9例以及13例,檢查出結節、網格樣影、結節、玻璃樣密度以及實變等病灶分別93個,其中右肺上葉、中葉、下葉病灶分別21個、16個、21個,左肺上葉、下葉病灶分別11個以及24個。8例出現實變影,具體表現為非節段性或者節段性肺部實變影,其中6例患者實變影為大葉性(圖1A),2例患者實變影為節段性;5例患者病灶內部可見明顯支氣管空氣征(圖1B),2例存在支氣管擴張;其增強掃描均顯示為不勻中等強化。9例患者可見腫塊影,病灶大小為2.9cm×3.1cm~8.5cm×7.3cm,顯示為卵圓狀或者圓形腫塊影(圖1C),其邊界顯示為淺分葉狀,密度相對較高,增強掃描也為不勻中等強化。4例可見結節影,大小不一,界線光滑、毛糙或者糢糊,密度不勻(圖1D),結節多在肺部小葉間隔或者肺小葉內部。其中2例可見磨玻璃樣密度影,主要存在于肺部下葉,顯示為肺部內部輕度密度影。
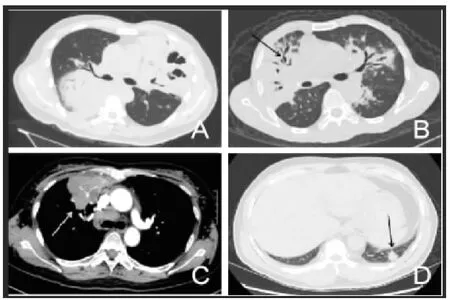
圖1 CT影像學表現
四、病理結果分析
腫塊顯示為不規則或者類圓形實性結節或者腫塊,直徑大小為2~5cm,切面未見壞死,質軟灰白,界線清楚,病灶內部存在大量淋巴細胞浸潤,顯示為多灶性或者片狀(見圖2)。

圖2 肺淋巴瘤鏡下病理檢查結果(×40)
五、免疫組化結果分析
10例MALT患者,組織標本免疫組化提示CD20和BCL-2強陽性,CD10和cyclinD1陰性,部分患者CD5, CD23, CD21少量或者灶性陽性,Ki67有兩例患者分別是30%和40%,其余患者≤5%(圖3A)。7例DLBCL患者,組織標本免疫組化提示腫瘤細胞CD20和CD79a強陽性,少量表達CD3,可能表達CD10,其中1例患者Ki-67高達80%(圖3B);其他未能分類的原發性肺B細胞淋巴瘤,共3例,組織標本免疫組化CD20均陽性;1例患者行ki-67檢查提示40%(圖3C);T細胞淋巴瘤2例,其中NK/T細胞淋巴瘤1例,組織標本免疫組化中CD30陽性,CD56陰性(圖3D)。
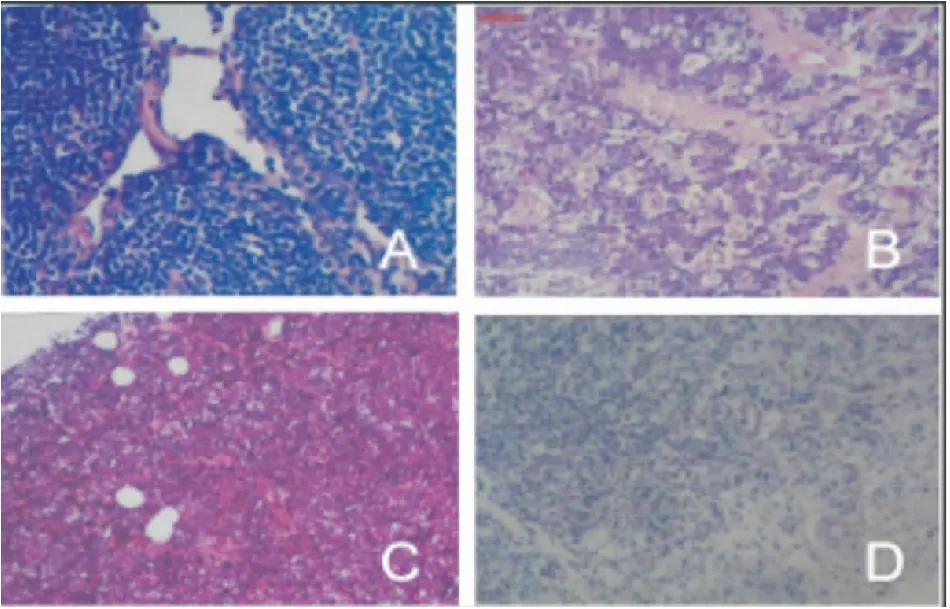
圖3 免疫組化結果(×100)
六、療效及隨訪結果
3例早期患者經手術治療聯合術后CHOP方案化療,隨訪至今未見疾病復發;1例Ⅳ期MALT患者經8程CHOP方案化療后疾病完全緩解,PFS為38月,疾病復發后行5程SMILE方案化療,最終疾病進展,OS為44月;1例Ⅳ期原發性肺T細胞淋巴瘤患者OS為2月,1例Ⅳ期NK/T細胞淋巴瘤患者OS為12月,其余早期和Ⅳ期患者經單純6至8程CHOP方案化療隨訪至今未見疾病復發或疾病穩定。
討 論
PLL在原發性肺部腫瘤中所占比例小于0.5%,在淋巴瘤中所占比例小于1%,在結外淋巴瘤中約占3%~4%,其常見于中位年齡60歲成人,在兒童中少見[3]。PLL中最常見腫瘤類型為起源于MALT低度惡性小B細胞淋巴瘤,所占比例為70.0%~85.0%,占肺腫瘤的0.5%[8]。PLL均未見典型癥狀,多表現為呼吸困難、咳嗽、咯痰等呼吸道癥狀,以及氣促、乏力、發熱、胸悶、體質量下降等非典型全身癥狀。包晨等[9]研究則認為肺淋巴瘤患者多顯示為胸痛、咳嗽以及咳痰等相關呼吸道癥狀,患者多存在全身淺表淋巴結腫大,有近50%患者存在特征性周期性發熱等癥狀,患者發病緩慢,病程相對較長。本研究中患者臨床表現主要為咳嗽(90.91%)、發熱(81.82%)、胸部疼痛(68.18%)、體重減輕(54.55%),臨床癥狀與相關研究[10]一致,但是各癥狀出現比例不同。另一樣研究中顯示PLL患者發病時間相對較短,僅存在痰中帶血、咳嗽以及咳痰等相關癥狀,C反應蛋白、白細胞水平均顯著上升,肺部彌散功能輕微損傷[11]。本研究中患者存在各種不同程度血清相關指標水平異常,如癌胚抗原上升,糖類抗原153上升,乳酸脫氫酶升高等,其進一步顯示此類患者未見顯著臨床癥狀。
本研究患者影像學CT檢查顯示患者多表現為實變影、腫塊影、結節影,少數患者存在磨玻璃樣密度影,實變影患者部分存在支氣管擴張,其主要原因為淋巴瘤組織浸潤導致支氣管附近實質損傷以及肺泡塌陷所致,邊界模糊結節影是此類患者又一相對典型CT表現,其出現主要因為附近組織為腫瘤病灶浸潤而使氣腔不完全充盈或者間質輕度變厚導致。由于不同病理患者病灶血供存在差異,因此患者增強掃描強化情況不同[12]。因為PLL的臨床癥狀及影像學表現與原發性肺癌非常相似,所以組織病理學為該病診斷金標準。本研究中MALT患者CD20和BCL-2顯示強陽性,CD10和cyclinD1則為陰性;DLBCL患者CD20和CD79a強陽性;其他未能分類的原發性肺B細胞淋巴瘤CD20顯示為陽性。另一項研究則認為MALT主要由構成比不同單核樣B細胞、小淋巴細胞以及中性細胞樣細胞,多存在漿細胞分化[13]。MALT淋巴瘤患者主要為肺內部病變,主要使支氣管黏膜下以及肺間質組織受到侵犯,細胞浸潤并逐漸向間質擴張,使附近濾泡被壓迫[14]。
MALT目前沒有標準治療方法,包括手術,放療,化療以及綜合治療,治療方案選擇和腫瘤分期、組織結構、臨床癥狀相關,術后是否需要放化療,取決于手術切緣有無殘留[15-17]。CHOP方案是此類患者最常用、且可耐受化療方案,利妥昔單抗用于治療CD20陽性MALT患者可以延長其生存并緩解其癥狀[18]。MALT是一種預后好惰性淋巴瘤,其中位生存時間在10年以上,但是影響預后因素尚不明確[19],本研究中1例IV期MALT患者PFS為38月,OS為44月,1例IV期原發性肺T細胞淋巴瘤患者OS為2月,1例IV期NK/T細胞淋巴瘤患者OS為12月,其余早期和IV期患者至隨訪終末期未見疾病復發或疾病穩定。原發性肺NK/T細胞淋巴瘤預后極差,目前病理報道中最長生存時間小于6個月,正確診斷和及時治療有益于患者預后,腫塊快速增大或者EBER(Epstein-Barr virus-encoded small RNA)陽性提示預后更差[20],與本研究中相關結論一致。目前原發性肺NK/T細胞淋巴瘤無標準治療方法,在已報道病例中70%患者行以CHOP為基礎化療和手術切除治療,但是由于多藥耐藥基因表達,其對化療并不敏感,腫瘤的復發率極高,皮膚及皮下組織是常見的轉移部位,因此患者預后相對較差[21]。
PLL臨床表現均未見典型癥狀,影像學表現多為實變影、腫塊影以及結節影等,患者診斷主要參照病理檢查結果,肺MALT淋巴瘤是PLL最常見類型,患者預后相對較好。本研究觀察疾病為肺原發性淋巴瘤,相對病例少見,國內類似報道均病例數較少。且此次入組均為作者所在醫院患者,本身病例數少,因此在文章中多為描述性分析。后期考慮聯合相關醫院,擴大患者數,以期對各個亞組及相關指標對比分析,同時延長隨訪時間,從而對臨床診療提供更多依據。

