65例小肝細胞癌的超聲造影圖像特征分析
韓瑩瑩,梅 琪,翟凌云,沙紅芳,徐祥勇,賀 靜,倪 娟,陳 穹,崔建巍,虞 梅
1.上海市徐匯區大華醫院超聲影像科,上海 200237;
2.上海市徐匯區大華醫院放射科,上海 200237;
3.上海市徐匯區大華醫院肝科,上海 200237
肝細胞癌(hepatocellular carcinoma,HCC)大多發生在慢性肝炎或肝硬化的基礎上,早期臨床缺乏特異性,臨床出現癥狀時影像學診斷多已到中晚期,常常錯過最佳手術治療時期,5年生存率較低[1]。HCC與肝組織的差異性供血是動態增強影像學檢查診斷HCC的主要依據,但HCC的發生、發展是一個漸變、復雜的過程[2-3]。在HCC發生、發展的早期,由于腫瘤血供尚未完全建立,在影像學上缺乏典型的表現而難以獲得準確的影像學診斷結果[3],而早期診斷HCC對于患者的預后預測有著極其重要的意義。本研究回顧并分析65例小HCC(small HCC,sHCC)的超聲造影(contrast-enhanced ultrasound,CEUS)資料,旨在評估CEUS在sHCC早期診斷中的應用價值。
1 資料和方法
1.1 研究對象
回顧并分析2010年12月—2019年12月于上海市徐匯區大華醫院行CEUS檢查并經穿刺或手術后病理學檢查證實的65例sHCC患者的資料,所有病灶直徑≤2 cm。其中男性49例,女性16例,年齡11~83歲,平均(61.08±13.24)歲,病灶最大直徑為0.8~2.0 cm,平均(1.47±0.38)cm。納入標準:所有患者均為慢性肝病患者,在定期隨訪中行CEUS檢查時發現肝內結節,并經穿刺或手術后病理學檢查確診為sHCC;術前均為單發直徑≤2 cm的病灶。排除標準:合并其他組織原發性重大疾病者;伴有嚴重胸腹水、黃疸者;多發病灶者。
1.2 儀器與方法
采用美國GE公司的Logiq E9彩色多普勒超聲診斷儀,使用腹部凸陣探頭,頻率為1~5 MHz。CEUS造影劑為意大利Bracco公司生產的聲諾維(SonoVue),用5 mL生理鹽水配制成微泡混懸液。根據患者體重抽取微泡混懸液1.5~2.5 mL經肘前靜脈團注,同時啟動計時器。以實時、動態視頻的形式儲存CEUS全過程,并作定性及定量分析。探頭置于感興趣區,清晰顯示目標病灶全貌及周圍肝臟組織,行常規超聲記錄存儲病灶的大小、形態、邊界、回聲和血流信號等情況;然后進入CEUS狀態,全程觀察病灶的增強形態、增強類型等。
1.3 圖像分析
肝CEUS時期分為動脈期(15~30 s)、門脈期(31~120 s)及延遲期(>121 s)[3]。sHCC的CEUS特征:典型增強模式為“快進快出”型,即動脈期病灶均勻或不均勻高增強,門靜脈期或延遲期消退為低增強[2-3];不典型增強模式為“快進同出或慢出”型,即動脈期快速增強、門脈期及延遲期無明顯減退。當CEUS表現為肝內病灶區等于或慢于肝實質增強,門脈期與延遲期呈等回聲與肝實質同步減退,則提示為肝良性結節[4]。
1.4 統計學處理
2 結 果
2.1 sHCC的直徑大小與超聲聲像圖表現分析
65例sHCC的超聲聲像圖表現分為3種(圖1~3):低回聲40例(61.54%)、等回聲14例(21.54%)及高回聲11例(16.92%),其中低回聲為sHCC的主要表現形式(表1)。經統計學分析,腫瘤的大小與超聲聲像圖表現無相關性,差異無統計學意義(P>0.05)。
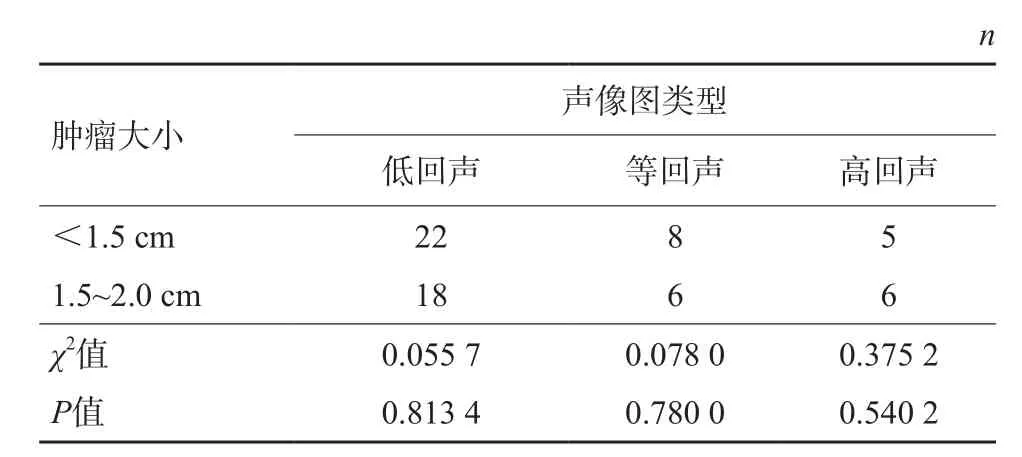
表1 sHCC大小與聲像圖類型分析
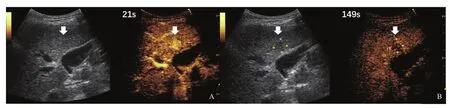
圖1 典型病例1(患者,女性,70歲,乙肝病史40多年)肝內等回聲CEUS表現
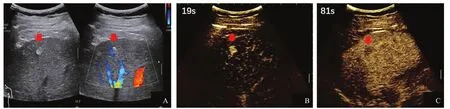
圖2 典型病例2(患者,男性,65歲,乙肝伴肝癌家族史)肝內高回聲CEUS表現
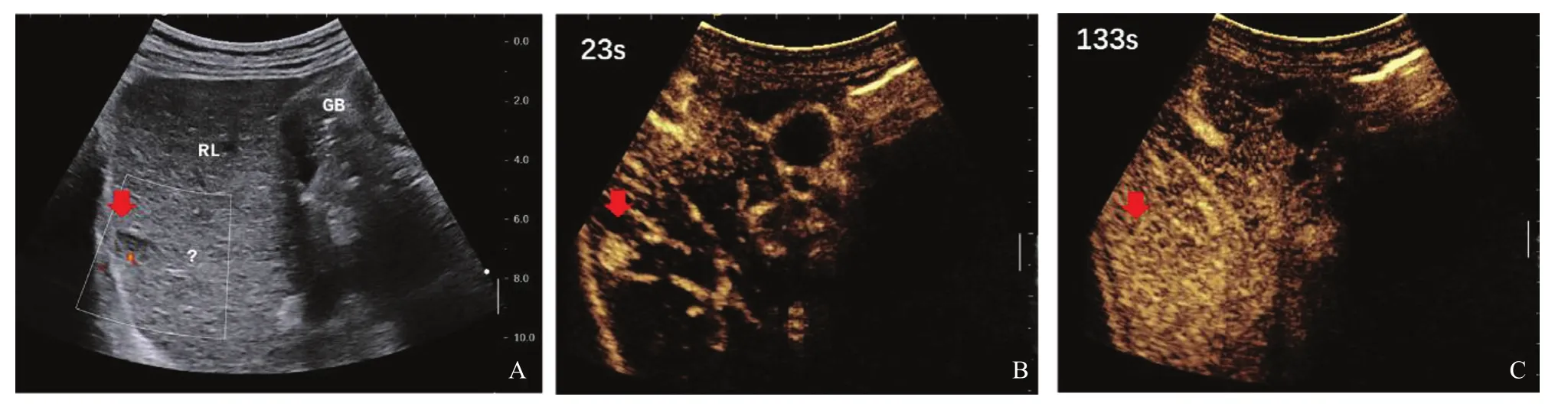
圖3 典型病例3(患者,男性,60歲,乙肝病史30多年)肝內低回聲CEUS表現
2.2 不同聲像圖sHCC病灶與CEUS增強模式的關系分析
65例sHCC中常規灰階超聲圖像上表現為低回聲40例、等回聲14例和高回聲11例。
經CEUS檢查后,不同回聲的病灶CEUS模式分布見表2,經統計學分析,不同聲像圖的病灶與CEUS增強模式無明顯的相關性。
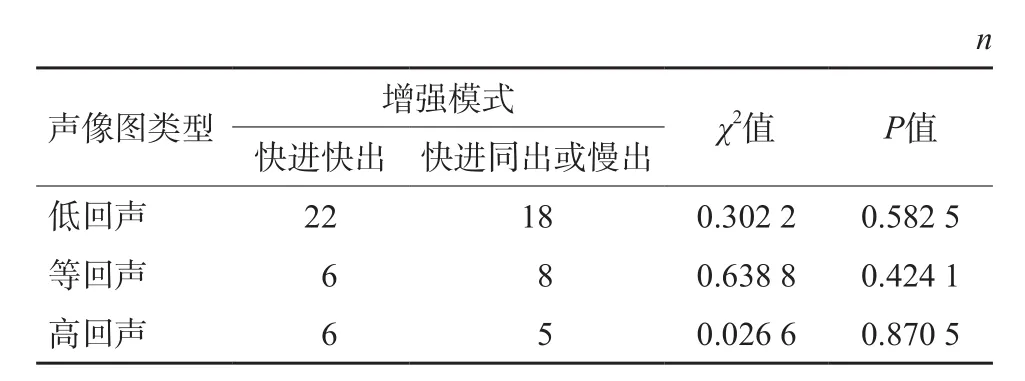
表2 sHCC不同聲像圖與CEUS增強模式的關系
2.3 sHCC的大小與CEUS增強模式相關性分析
65例sHCC中,34例表現為“快進快出”型(52.31%),其中<1.5 cm病灶占4例;31例表現為“快進同出或慢出”型,均發生在<1.5 cm病灶中(表3),兩者差異有統計學意義(P<0.01),即對于<1.5 cm的病灶,當CEUS表現為“快進同出或慢出”的模式時,高度提示惡性可能。

表3 sHCC大小與CEUS增強模式的關系
2.4 sHCC病灶大小與CEUS始增時間、消退時間及持續增強時間的關系分析
不同直徑的sHCC CEUS開始增強時間、消退時間、增強持續時間見表4。從統計表分析中可以看出,造影劑的消退時間、增強持續時間與病灶大小呈負相關(r=-0.34,圖4),即結節越小,造影劑消退時間越晚,CEUS增強持續時間越長。而病灶的CEUS增強開始時間與病灶大小沒有直接關系,差異無統計學意義(P=0.527)。
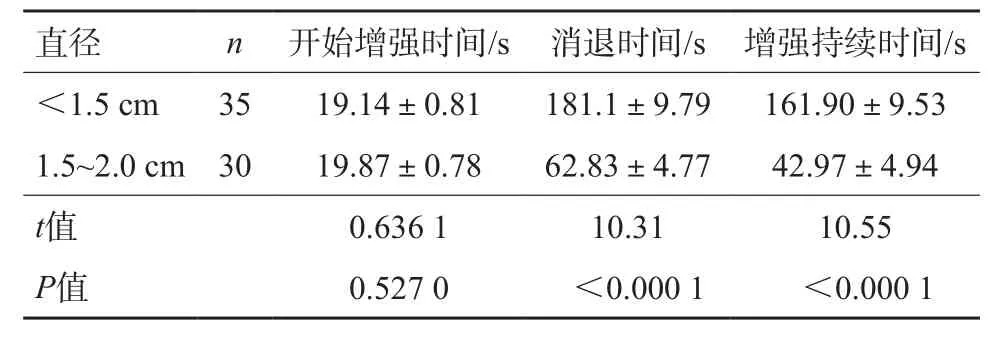
表4 sHCC的大小與CEUS開始增強時間、消退時間、增強持續時間的關系
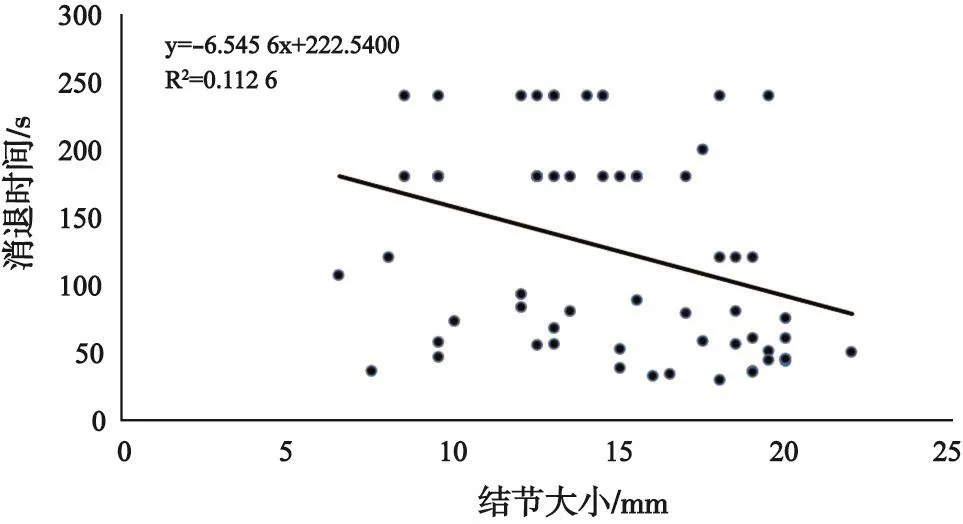
圖4 sHCC大小與CEUS消退時間的相關性分析
3 討 論
臨床上的sHCC多在肝硬化的基礎上形成,超聲檢查受粗糙的肝病背景的影響,很難鑒別毫米級大小的硬變結節,因肝硬化結節的多樣性和復雜性,致使普通超聲診斷小肝癌的準確度較低[4]。90%的sHCC以低回聲結節為主要表現,具有以下特點:圓形或橢圓形,細薄包膜,側壁回聲失落,后壁和后方回聲輕微增強,內部低回聲分布較均勻,其中心部位常具花蕊樣點狀增強;腫瘤內多見線狀、分支狀彩色血流穿入,多數可測及動脈流速曲線,阻力指數較高(>0.60)[5]。本組65例≤2.0 cm病灶二維聲像圖均不典型,表現為低回聲、等回聲及高回聲等3種形式,雖以低回聲居多(占61.54%),但結節周圍“聲暈”不明顯,周邊及內部血流信號稀少,常規超聲診斷準確度低于41%。本組中sHCC病灶最小直徑約8 mm表現為極低回聲,彩色多普勒超聲未顯示血流信號,而CEUS時病灶早期快速整體增強,門靜脈期及延遲期呈等增強,最終病理學檢查證實為sHCC Ⅱ級。研究[6]指出,CEUS鑒別診斷sHCC是基于其顯示病灶的血流動力學表現,適用于大多數的肝腫瘤,可能會漏診部分血供表現極不典型的肝癌病例。而本研究患者中部分血供不典型的病灶,依據CEUS動脈期高增強的特點,能有效提高sHCC的診斷準確度。
典型的肝癌表現為動脈期快速整體增強、門靜脈期和延遲期減退呈低回聲的動態改變,以此特征診斷肝癌具有較高的靈敏度和準確度[7-8]。本組65例sHCC中34例CEUS增強模式為“快進快出”型,31例CEUS增強模式為“快進同出或慢出”型。有研究[9]顯示,約90%的HCC患者其HCC的發展是多級路徑演變而成的:再生結節—低或高分化的不典型增生結節—不典型增生結節伴灶性癌變—高分化的HCC—中到低分化的HCC。多數研究[10]認為,肝癌發生、發展伴隨著其內血流動力學的一系列變化,隨著肝硬化病程的進展,腫瘤新生動脈血流逐漸增多,異型增生結節以不斷減少的肝動脈血流為特征,門靜脈血供可保留直至癌變階段。此外,小肝癌的瘤內血供類型還與瘤體分化程度密切相關。早期肝癌或分化程度較高的肝癌,CEUS增強模式多呈“快進慢出”型或呈“快進同出”型[11-12];本組31例“快進同出或慢出”型均為直徑<1.5 cm病灶,表明sHCC的CEUS增強模式與病灶的大小及分化程度有相關性。故不同分化程度的sHCC均表現為動脈期高增強,這些變化對于肝硬化基礎上的肝細胞結節的定性診斷至關重要。
《中國超聲造影臨床應用指南》[9]指出,HCC和其他原發腫瘤或肝臟轉移癌相比,HCC的廓清一般較晚,通常發生在注射造影劑60 s后,約25%的患者廓清甚至在180 s以后。對本組65例sHCC患者CEUS的回顧性分析顯示,病灶大小與CEUS開始增強時間無相關性,差異無統計學意義(P=0.527),平均CEUS增強時間為(19.48±4.52)s;病灶大小與CEUS消退時間及CEUS增強持續時間有密切相關性(P<0.000 1),65例患者廓清的平均時間為(126.52±74.42)s,其中35例<1.5 cm的病灶廓清平均時間為(181.1±9.79)s。不同直徑sHCC的CEUS消退時間差異有統計學意義,直徑<1.5 cm傾向于“快進同出或慢出”,>1.5 cm則傾向于“快進快出”,對臨床有一定的指導意義更有助于sHCC的早期診斷。
總之,CEUS具有良好的血流灌注顯像功能,能實時不間斷觀察肝內結節病灶增強特點,能實時動態觀察病灶與肝實質的血流灌注時相和灌注模式的變化規律,尤其是對于直徑≤2 cm的早期病灶,實時CEUS能捕捉增強過程中有助于診斷的所有細節,能顯著提高鑒別診斷肝內結節良惡性的準確度[13],對于慢性肝病的長期監控具有良好的應用前景。

