肝細胞條件性Eva1a/Tmem166基因敲除小鼠的表型分析
陳建宏 林 欣 馮金秋 丁鵬鵬 王苗苗 林 琳 劉 紅* 吳 靜
(1.首都醫科大學附屬北京世紀壇醫院消化內科,北京 100038; 2.北京大學人類疾病基因研究中心,北京 100083; 3.首都醫科大學附屬北京友誼醫院消化內科 國家消化系統疾病臨床醫學研究中心 北京市消化疾病中心 消化疾病癌前病變北京市重點實驗室,北京 100050)
細胞自噬是進化保守的對細胞內物質進行降解和再循環的重要過程,是一種基本的細胞應激調控機制[1]。自噬調控的異常參與腫瘤、神經退行性疾病、肝臟疾病、肥胖、糖尿病、心血管疾病、感染及自身免疫疾病等的發生、發展[2]。細胞自噬可通過多種途徑調節脂質代謝、胰島素抵抗、氧化應激、肝細胞損傷等,與非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)的發生、發展密切相關[3-4]。
Eva1a(eva-1 homolog A),也稱為Tmem166 (transmembrane protein 166),是具有自噬和凋亡雙調控作用的人類新分子[5],該基因進化保守,在人體多種正常組織呈現高表達,在癌癥組織中表達下調[6]。體內外研究發現Eva1a能夠誘導腫瘤細胞發生自噬和凋亡,抑制腫瘤細胞的生長[7]。分子機制研究[8]表明,Eva1a能夠定位于自噬體膜,與自噬關鍵分子(autophagy related protein 16 like protein 1,ATG16L1)相互作用,在ATG12-ATG5/ATG16L1介導隔離膜延伸中發揮重要作用。小鼠的神經干細胞特異敲除Eva1a可通過抑制自噬,從而抑制神經干細胞的自我復制及分化[9]。Eva1a在心肌細胞的特異敲除,導致自噬受損和凋亡增加,加重心肌纖維化及心肌重塑[10]。
Eva1a在肝臟中高表達,Lu等[11]研究證明C/EBPalpha 誘導的肝癌細胞自噬依賴于Eva1a的參與,Ren等[12]的研究顯示microRNA-125b 可以通過調控Eva1a誘導的自噬逆轉肝癌細胞對奧沙利鉑的耐藥性,最近的研究[13]顯示在肝細胞中滅活Eva1a能夠加重急性肝損傷。本研究構建了肝細胞Eva1a基因條件性敲除的小鼠模型,分析了該基因敲除對小鼠生理狀態下體質量、肝臟外觀與組織結構、肝指數、肝功能、糖脂代謝以及細胞自噬等表型的影響,為進一步研究Eva1a在NAFLD等肝臟疾病發生中的作用及分子機制提供了動物模型。
1 材料與方法
1.1 肝細胞條件性 Eva1a基因敲除小鼠的繁殖
以C57BL/6 為遺傳背景的Eva1a條件性基因敲除小鼠(Eva1aflox /+)由南京大學模式動物研究所構建,鼠肝細胞中表達Cre重組酶的Alb-Cre小鼠作為工具鼠,購自上海南方模式生物科技股份有限公司。
將Eva1aflox /+小鼠與Alb-Cre小鼠雜交,選取后代為Eva1aflox /+:Alb-Cre基因型的小鼠。Eva1aflox /+:Alb-Cre小鼠之間交配,選取后代為Eva1aflox/flox和Eva1aflox/flox:Alb-Cre基因型的小鼠。后續繁殖均為Eva1aflox/flox和Eva1aflox/flox:Alb-Cre交配,選取同窩Eva1aflox/flox為對照組,Eva1aflox/flox:Alb-Cre為肝細胞條件性Eva1a基因敲除小鼠進行后續的研究[13]。
小鼠飼養繁殖于北京大學醫學部,符合SPF級動物飼養標準級動物飼養標準。動物房溫度21 ℃,光-暗周期為12 h。所有小鼠自由采食和飲水,小鼠飼料、飲水、墊料均經高溫高壓滅菌處理。實驗所使用的所有動物均經過北京大學醫學部倫理委員會批準,實驗過程中對小鼠的處置按照中華人民共和國科學技術委員會頒布的《實驗動物管理條例》相關規定進行。
1.2 生長發育檢測
雌雄純合肝細胞條件性Eva1a基因敲除小鼠進行交配,觀察有無胚胎期致死現象。選取對照組與實驗組小鼠每組雌雄各5只,連續13個月監測小鼠體質量,每個月稱量1次,雌雄分別統計。13個月后處死小鼠,稱取體質量。取血清以及肝臟,觀察肝臟外觀差異。肝臟稱質量,測量肝指數。
1.3 血清學檢測
分別檢測雌雄小鼠隨機血糖和空腹血糖,檢測血清中總膽固醇、游離膽固醇、膽固醇酯、三酰甘油、高密度脂蛋白膽固醇(high density lipoprotein cholesterol, HDL-C)和低密度脂蛋白膽固醇(low density lipoprotein cholesterol, LDL-C)濃度,評估Eva1a基因肝細胞條件性敲除對糖脂代謝的影響。檢測丙氨酸氨基轉移酶(alanine aminotransferase, ALT)和門冬氨酸氨基轉移酶(aspartate aminotransferase, AST)濃度評估Eva1a基因敲除對肝細胞功能的影響。檢測試劑盒購自南京建成生物工程研究所以及北京普利萊基因技術有限公司的商品化試劑盒。
1.4 肝臟石蠟切片的制作以及組織學檢測
按照實驗室常規制作肝臟組織石蠟切片,蘇木精-伊紅(hematoxylin-eosin,HE)染色檢測肝臟組織結構;過碘酸希夫(periodic acid-schiff, PAS)染色檢測肝臟組織糖原分布;天狼星紅(Sirus red)染色檢測肝臟纖維化。
1.5 組織總蛋白提取和 Western blotting分析
在裝有肝組織的1.5 mL勻漿管中加入500 μL組織裂解液(RIPA內含蛋白酶和磷酸酶抑制劑Cocktail)勻漿2~3次,上清轉入新1.5 mL離心管,冰上放置30 min,4 ℃,16 000 r/min離心15 min,上清轉入新1.5 mL離心管并進行蛋白定量,每組蛋白取100~200 μg,加入蛋白上樣緩沖液,95 ℃煮10 min,進行15%(質量分數) SDS-丙烯酰胺膠電泳、轉膜、5%(質量分數)脫脂奶粉封閉;加入相應的一抗4 ℃過夜,TBST充分洗膜3次,然后加入相應的DyLight 680/800標記的二抗,室溫避光反應2 h,)TBST洗膜后使用Odyssey Infrared Imager儀器檢測信號。
1.6 組織RNA提取及反轉錄聚合酶鏈反應(reverse transcriptase polymerase chain reaction,RT-PCR)分析
取黃豆粒大小的小鼠組織放入1.5 mL勻漿管中,加入1 mL TRIzol,按照常規方法提取RNA,用反轉錄試劑盒合成cDNA 文庫,RT-PCR檢測Eva1a基因mRNA表達,以Eva1a-F:5′-GCCGCTCTGTACTTTGTC-3′和Eva1a-R:5′- TCTCCCTG ATCATTCGTT -3′為引物,擴增條件為95 ℃ 5 min→ 95 ℃ 30 s、58 ℃ 30 s、72 ℃ 30 s,擴增 25~35個循環→72 ℃ 7 min,PCR產物進行瓊脂糖電泳并分析,GAPDH為內參。
1.7 統計學方法
采用GraphPad Prism 5 統計軟件對數據進行處理分析。Eva1a-/-和Eva1a+/+小鼠體質量變化和血清ALT、AST濃度變化采用雙因素重復測量的方差分析,組間兩兩比較采用LSD方法。實驗組與對照組小鼠肝指數、隨機血糖、空腹血糖和脂代謝指標濃度比較采用t檢驗,以P<0.05 為差異有統計學意義。
2 結果
2.1 肝細胞條件性 Eva1a基因敲除小鼠的鑒定
RT-PCR檢測Eva1a+/+與Eva1a-/-小鼠肝臟、腦、心臟組織Eva1a基因mRNA表達,在Eva1a-/-小鼠肝臟中幾乎檢測不到Eva1a基因mRNA的表達,而在腦和心臟組織中Eva1a基因mRNA的表達沒有明顯變化(圖1A)。Western blotting法檢測小鼠肝組織Eva1a蛋白的表達,在Eva1a-/-小鼠肝臟中幾乎檢測不到Eva1a蛋白的表達(圖1B)。
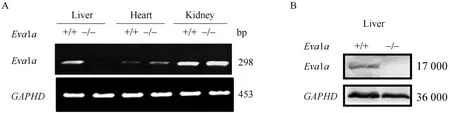
圖1 肝細胞條件性 Eva1a基因敲除小鼠的鑒定Fig. 1 Identification of hepatocyte-specific Eva1a gene knockout miceA: Eva1a mRNA was examined by RT-PCR; B: Eva1a protein was examined by Western blotting; RT-PCR: reverse transcriptase polymerase chain reaction.
2.2 肝細胞 Eva1a敲除對生理狀態下小鼠生長發育的影響
對肝細胞Eva1a敲除小鼠和野生型小鼠的長期觀察發現,Eva1a+/+與Eva1a-/-雄鼠的體質量差異無統計學意義(P>0.05),Eva1a-/-雌鼠的體質量較Eva1a+/+有所升高。在13個月后處死小鼠,發現無論雄性小鼠還是雌性小鼠,Eva1a+/+與Eva1a-/-肝臟的外觀并無明顯異常。測量肝指數發現Eva1a-/-雌鼠肝指數顯著降低(圖2)。
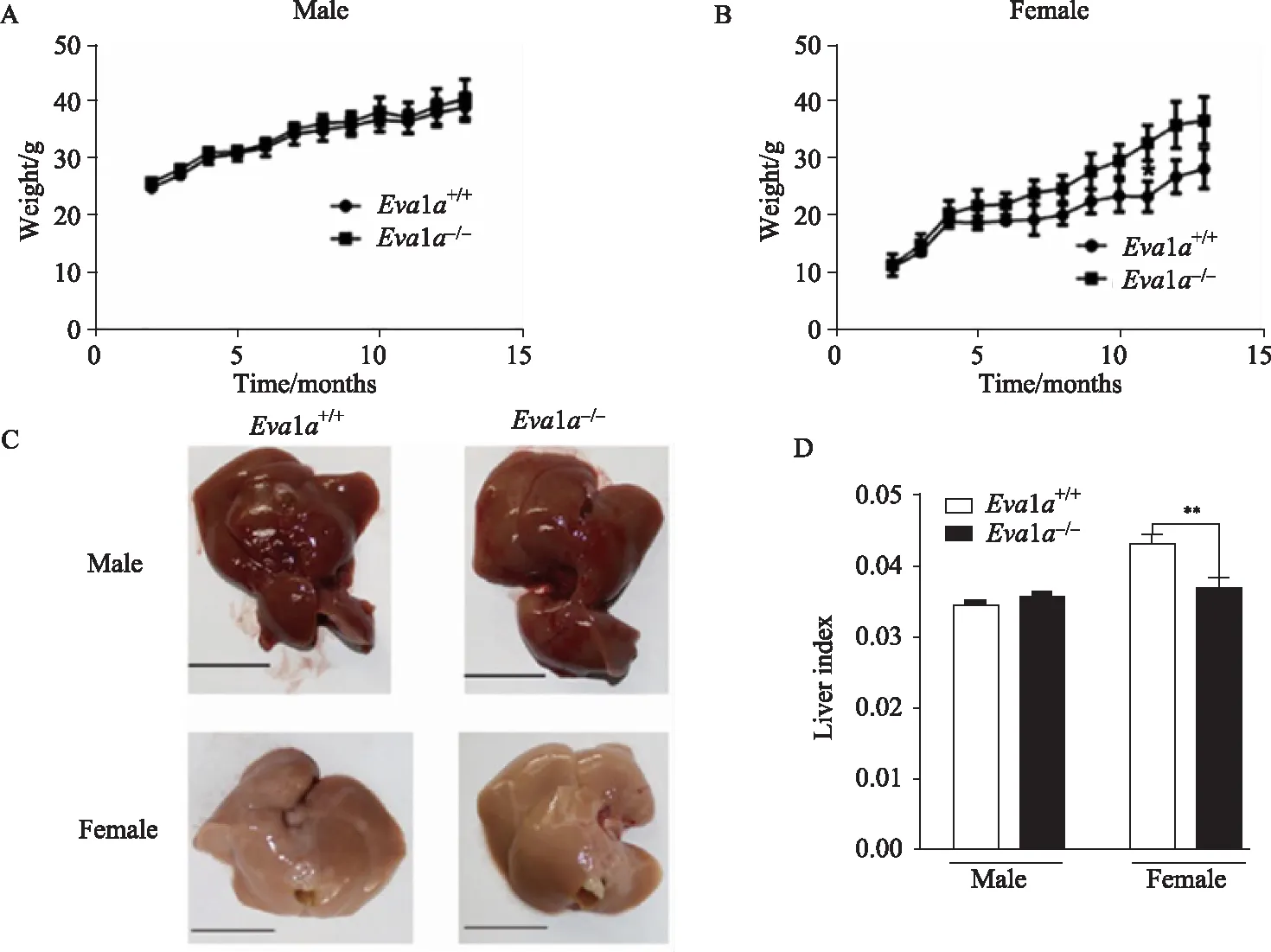
圖2 Eva1a+/+與 Eva1a-/-小鼠生長監測Fig.2 Growth monitoring of Eva1a+/+ and Eva1a-/- miceA: weight monitoring of male; B: weight monitoring of female; C: liver appearance; D: liver index; **P<0.001.
2.3 Eva1a敲除對小鼠肝功能及糖脂代謝指標的影響
在2個月、5個月和1年的Eva1a+/+與Eva1a-/-小鼠血清中ALT、AST濃度均在正常范圍內,差異無統計學意義(P>0.05)。Eva1a+/+與Eva1a-/-小鼠的隨機血糖和空腹血糖比較,兩組小鼠差異無統計學意義(P>0.05)。同時,檢測了小鼠的血清中脂質代謝指標,血清中總膽固醇、游離膽固醇、膽固醇酯、三酰甘油、HDL-C和LDL-C濃度均在正常范圍內,差異無統計學意義(圖3)。
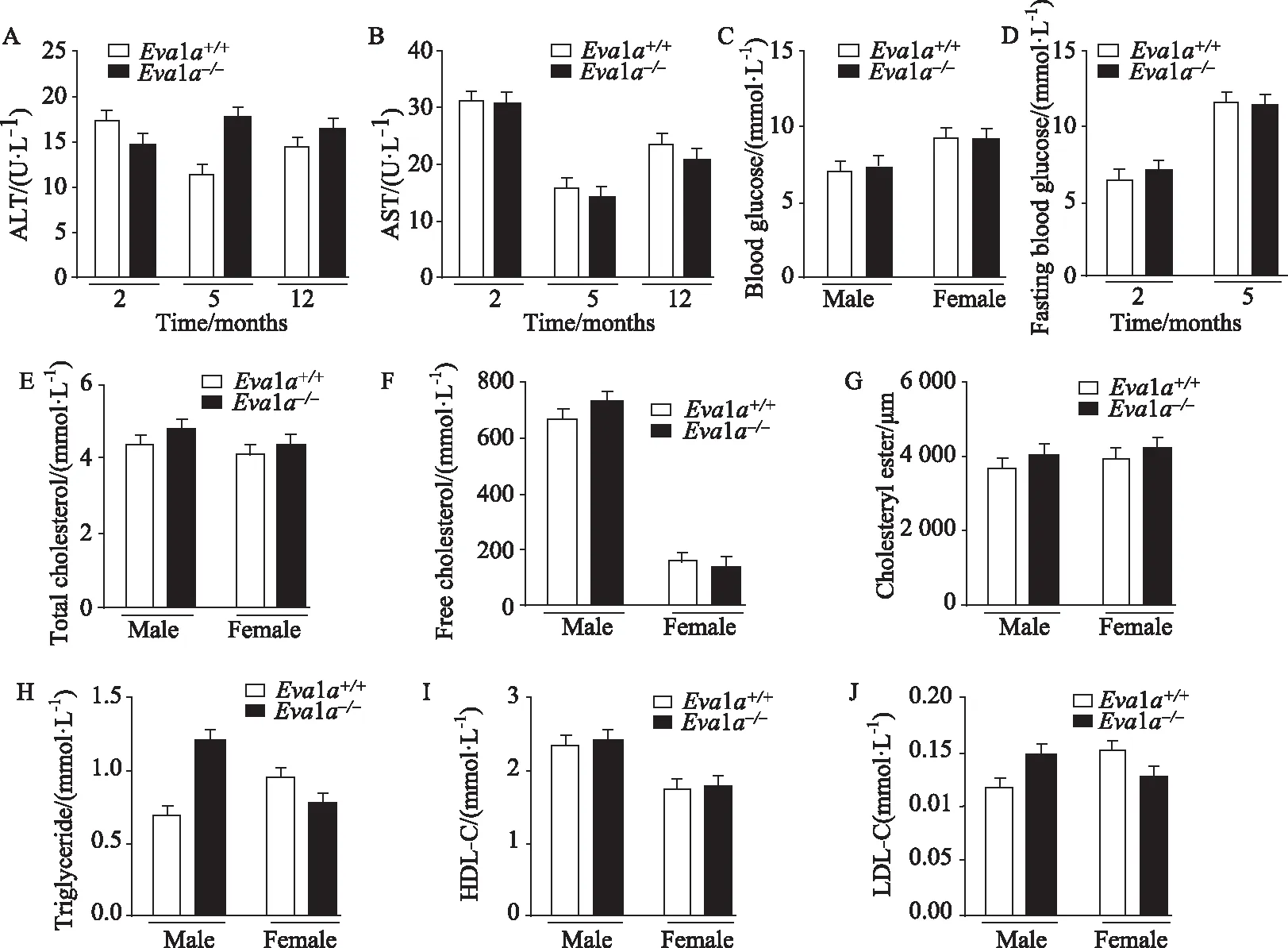
圖3 Eva1a+/+與 Eva1a-/-小鼠肝功能及糖脂代謝指標檢測Fig.3 Liver function, blood glucose and lipid detection of Eva1a+/+ and Eva1a-/- miceA: ALT; B: AST; C: blood glucose; D: fasting blood glucose; E: total cholesterol; F: free cholesterol; G: cholesteryl ester; H: triglyceride; I: HDL-C; J: LDL-C; ALT: alanine aminotransferase; AST: aspartate aminotransferase; HDL-C: high density lipoprotein cholesterol; LDL-C: low density lipoprotein cholesterol.
2.4 Eva1a敲除對小鼠肝組織結構、糖原以及膠原纖維分布的影響
對Eva1a+/+與Eva1a-/-小鼠肝臟的HE 染色發現,兩組小鼠肝臟組織結構均無明顯異常。PAS 染色主要用于檢測組織中的糖類,Eva1a+/+與Eva1a-/-小鼠糖原分布無明顯差異。天狼星紅染色可以將膠原染色結果發現Eva1a+/+與Eva1a-/-小鼠肝臟組織膠原纖維無顯著異常(圖4)。
2.5 Eva1a敲除對小鼠肝細胞自噬的影響
Western blotting實驗結果表明,與Eva1a+/+小鼠相比較,Eva1a-/-小鼠的LC3略有下調,SQSTM1/P62蛋白無明顯差異。發現無論MTOR信號通路以及LKB/AMPK信號,Eva1a+/+與Eva1a-/-小鼠均無明顯異常,在正常飼養條件下,Eva1a-/-小鼠的自噬沒有明顯的改變(圖5)。
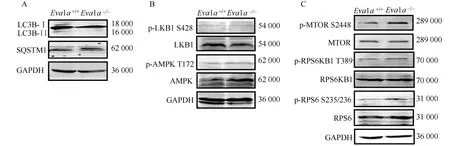
圖5 Eva1a+/+與 Eva1a-/-小鼠肝組織自噬表型以及信號通路Fig.5 Autophagy phenotype and signal pathway detection of Eva1a+/+ and Eva1a-/- miceA: LC3B and SQSTM1 detection by Western blotting; B: LKB/AMPK protein detection; C: MTOR/RPS6KB1/ PRS6 protein detection.
3 討論
Eva1a是北京大學人類疾病基因研究中心首次報道的與自噬與凋亡相關基因。分子機制的研究[8]證明Eva1a可以通過 C 端 與 ATG16L1 的 WD 結構域相互作用,促進自噬體的形成。進一步的研究[9-10]發現Eva1a在腦中能促進神經干細胞的生長和分化,促進神經系統的發育[9],在心臟中能影響心肌重塑[10]。最新研究[12]顯示Eva1a誘導的自噬在肝癌細胞的耐藥過程中發揮了重要作用。Eva1a在肝臟中高表達,本研究分析了Eva1a肝細胞條件性敲除對生理狀態下小鼠生長發育、肝功能、糖脂代謝、肝臟組織結構、及自噬方面的影響,結果顯示Eva1a基因敲除小鼠在體質量、行為、血清學指標、肝臟組織結構方面無明顯異常,Eva1a敲除對小鼠肝細胞自噬無顯著影響,這提示Eva1a可能對于肝臟的發育及功能不是必要的。 這與部分關鍵的自噬相關基因不同,例如Atg5、Atg7敲除小鼠肝臟會自發形成腫瘤[14],Vps34以及Rack1肝敲除小鼠出現肝臟腫脹[15]。Eva1a敲除對于肝臟基礎的自噬沒有明顯影響,這可能是由于Eva1a并不是自噬過程不可缺少的基因,可能起到輔助作用。
mTOR 通路是自噬調控中非常重要的信號通路。mTOR 通路的激活能抑制自噬, 其下游底物RPS6KB1-RPS6 能促進蛋白質合成。而mTOR上游通路包括PIK3C3/AKT和LKB1/AMPK等,能通過影響 mTOR 通路影響自噬。前期研究[7]表明Eva1a可能通過抑制mTOR信號通路促進自噬發生,而Eva1a敲除會通過Pik3c3-Akt-mTOR 通路影響神經系統發育[9],通過 mTOR 通路影響心肌重塑[10],因此本研究在肝組織中檢測了相關信號分子的表達, Western blotting 實驗結果表明,在正常飼養條件下,滅活Eva1a的小鼠肝細胞LKB1/AMPK以及mTOR通路相應分子的磷酸化水平沒有明顯變化。與在腦和心臟的結果并不一致,也許是不同的組織或細胞的反應不同所致。
隨著肥胖和代謝綜合征的流行,NAFLD 已成為我國第一大慢性肝病和健康體檢肝臟生物化學指標異常的首要原因。NAFLD 的發病機制復雜,現在多認同Day 和James 提出的“二次打擊”學說,即第一次打擊為高胰島素血癥和胰島素抵抗引起單純肝細胞脂肪變性;第二次打擊為氧化應激和脂質過氧化、炎性細胞因子釋放、線粒體功能障礙等因素誘導肝臟炎性反應、肝細胞變性壞死和肝纖維化、肝硬化的發生[4]。自噬在脂質過氧化、氧化應激及炎性反應等應激狀態中起到重要的調控作用[3,16]。高脂飲食可能通過PI3K-AKT 通路激活mTOR,激活的mTOR 導致TFEB 磷酸化后無法進入細胞核調控自噬及溶酶體基因的表達,降低肝細胞的自噬,抑制了脂滴的降解[4, 17-18],導致NAFLD的發生。生理狀態下Eva1a的功能可能會在胚胎發育過程中被其他基因代償,然而在應激狀態下,基因功能的缺失可能無法被完全代償,在接下來的工作中,將在Eva1a肝細胞條件性敲除鼠中通過高脂飲食誘導NAFLD模型,進一步探討應激狀態下Eva1a在NAFLD發生中的作用及分子機制。

