雙重血漿分子吸附系統治療過程中肝素抗凝效果的影響因素研究
孔 明 李 爽 耿 華,3 周 莉 徐曼曼 劉 靜 陳 煜*
(1. 首都醫科大學附屬北京佑安醫院肝病中心四科, 北京 100069; 2. 首都醫科大學附屬北京佑安醫院血液凈化中心, 北京 100069; 3. 河北中石油中心醫院感染科, 河北廊坊 065000)
近年來非生物型人工肝(non-biological artificial liver, NBAL)治療重癥肝病和肝衰竭在國內得到廣泛運用開展,其機制是基于肝細胞的強大再生能力,利用體外循環裝置清除血液中有害物質的同時補充必需成分,短時間內穩定機體內環境,暫時替代肝臟部分功能,為肝細胞的再生和肝功能的恢復創造條件,或作為肝移植前的橋接[1]。雙重血漿分子吸附系統(double plasma molecular adsorption system, DPMAS)是目前國內應用較為廣泛的一種NBAL治療模式,采用中性大孔樹脂(HA330-Ⅱ)和離子交換樹脂(BS330)兩種吸附劑聯合進行血漿吸附治療, 其中HA330-Ⅱ灌流器中的樹脂是相對廣譜性的吸附劑,可以吸附炎性介質等中大分子毒素;而BS330膽紅素吸附柱內的樹脂則是針對膽紅素的特異性吸附劑[2-3]。
肝素是目前NBAL治療中應用較普遍的抗凝劑,但目前肝素的劑量、應用方式仍以臨床醫生經驗給藥為主,尚無標準化方案[4-7]。肝素用量不足將導致管路凝血,影響治療順利進行;用量過大又會增加出血風險,甚至導致嚴重并發癥[8]。本研究回顧性分析首都醫科大學附屬北京佑安醫院198例次DPMAS治療過程中肝素抗凝的效果與安全性,并分析影響抗凝效果的因素,以期為臨床醫師提供參考。
1 對象與方法
1.1 研究對象
本研究為觀察性橫斷面研究,選取2018年4月至2020年12月于首都醫科大學附屬北京佑安醫院行DPMAS治療的患者為觀察對象。入選標準:需要且同意行DPMAS治療的肝病患者。排除標準:①存在活動性出血或彌漫性血管內凝血者;②對治療過程中所用血制品或藥品嚴重過敏者;③血流動力學不穩定者;④活動性的感染者。符合上述要求患者102例,共進行治療198次,平均年齡為(46.37±12.15)歲,其中男性81例。其中81例為肝衰竭患者,21例為高膽紅素血癥患者。
1.2 治療方式
入選患者均接受DPMAS治療,采用經右側頸內靜脈置入12F 20 cm雙腔中心靜脈導管建立血管通路。應用血液凈化機(DX-10, 中國健帆生物科技集團股份有限公司)、膜型血漿分離器(Plasmaflo-OP-O8W,日本旭化成公司)、一次性使用血液灌流器HA330-Ⅱ、一次性血漿膽紅素吸附器BS330進行DPMAS治療。給予0.9%(質量分數)氯化鈉注射液3 000 mL+普通肝素12 500 IU進行充分預充。治療開始時血流量一般從50~80 mL/min 逐漸增加至120~160 mL/min,分漿比20%~30%。DPMAS治療持續1.5~2.0 h。
1.3 抗凝方法
肝素首劑量于上機前由中心靜脈導管注射,肝素維持劑量由體外循環管路持續泵入,肝素的給藥方案依據患者治療前24 h內凝血酶原活動度(prothrombin activity, PTA)和血小板計數(platelet, PLT),具體給藥方案見表1。

表1 DPMAS治療過程中肝素給藥方案Tab.1 Heparin administration in the course of DPMAS
1.4 DPMAS治療過程中肝素抗凝效果觀察及分組
治療過程中,每半個小時記錄跨膜壓、靜脈壓及動脈壓,燈光輔助照射評估血漿分離器及靜脈壺凝血情況。根據治療過程中,患者的跨膜壓、靜脈壓及動脈壓情況,體外循環管路、濾器、靜脈壺凝血及機器報警情況,在治療過程中個體化追加肝素劑量。
治療后24 h內,觀察有無出血并發癥發生。根據常見出血部位和癥狀分為中心靜脈置管處滲血、皮膚出血點或瘀斑、口腔出血、鼻腔出血、消化道出血,其他出血等。
將存在以下情況的例次定義為抗凝不足:①在治療過程中跨膜壓、靜脈壓及動脈壓在短時間內突然上升;②跨膜壓、靜脈壓或動脈壓高于起始數值 30 mmHg(1 mmHg=0.133 kPa);③治療過程中機器頻繁發生凝血報警,體外循環管路及濾器中血液顏色變深,濾器中有血液呈線狀或血液分層及靜脈壺中出現明顯血凝塊。
將存在以下情況的例次定義為抗凝過量:①DPMAS結束前5~10 min活化部分凝血活酶時間(activated partial thromboplastin time, APTT)較治療前延長>2.5倍;②治療后24 h內,患者發生出血相關并發癥。
未出現上述情況的例次定義為抗凝良好。
1.5 觀察指標
收集患者性別、年齡、體質量等一般資料,其中體質量為根據臨床判斷的腹水嚴重程度減去一定量體質量進行校正后的數據(輕度5%,中度10%,重度15%,如果存在外周水腫再減5%)。觀察治療前及治療結束前5~10 min凝血指標,包括:APTT、凝血酶原時間(prothrombin time, PT)、PTA、抗凝血酶活性(antithrombin activity, AT);觀察治療前血常規及肝功能指標,包括:血紅蛋白(hemoglobin, Hb)、PLT、總膽紅素(total bilirubin, TBIL)、白蛋白(albumin, ALB)。
1.6 統計學方法
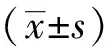
2 結果
2.1 肝素抗凝效果觀察
共198例次納入本研究,按照治療前患者PTA及PLT分別給予不同劑量肝素,詳見表1。根據DPMAS治療過程中肝素抗凝效果,觀察到抗凝良好組共118例次,抗凝不足組共11例次,抗凝過量組共69例次。
2.2 不同給藥劑量組肝素抗凝良好例次的比例
當PTA>30%、PLT≤325×109/L時,肝素抗凝效果良好例次的比例均>70%。肝素抗凝不足的例次主要集中在PTA>40%、PLT>325×109/L組,為80%。肝素抗凝過量的例次主要集中在PTA≤30%及PLT<125×109/L時,詳見表2。

表2 DPMAS治療中不同給藥劑量組不同肝素抗凝效果組占比 Tab.2 Proportion of different dosage groups and different heparin anticoagulant effect groups in DPMAS treatment (%)
2.3 3組患者基線臨床資料比較
3組患者性別、年齡、治療前TBIL、ALB無明顯差異。抗凝不良組患者體質量、Hb、PLT顯著高于抗凝良好組,差異有統計學意義(P<0.05);與抗凝良好組相比,抗凝過量組患者PTA、AT、Hb降低,PT、APTT升高,差異有統計學意義(P<0.05),詳見表3。
表3 三組患者基線臨床資料比較
Tab.3 Comparison of baseline clinical data among three groups

表3 三組患者基線臨床資料比較
ItemGood anticoagulation group(n=118)Insufficient anticoagulation group(n=11)Excessive anticoagulation group(n=69)PMale95(80.5)10(90.9)54(78.3)0.573Age/a46.84±11.8146.33±12.9648.23±13.280.626Weight/kg65.04±17.71 77.99±23.84?64.38±17.310.018PT/s26.60±8.8623.15±10.67 29.45±11.78?0.003PTA/%45.33±23.5348.57±26.93 34.23±18.02?0.011APTT/s49.03±14.0147.85±16.47 56.52±18.54?0.020AT/%24(16-44)22(18-44)15(12-20)?0.001Hb/(g·L-1) 102.36±19.47114.95±19.65? 91.19±21.43?0.000PLT/(×109·L-1)106.31±72.78 191.60±141.82?90.57±54.360.000TBIL/(μmol·L-1)395.11±186.1429.6±109.7429.6±109.70.598ALB/(g·L-1)28.74±3.9228.48±2.7930.29±4.300.063
*P<0.05 vs good anticoagulation group; PT: prothrombin time; PTA: prothrombin activity; APTT: activated partial thromboplastin time; AT: antithrombin activity; Hb: hemoglobin; PLT: platelet; TBIL: total bilirubin; ALB: albumin.
2.4 治療后出血相關不良反應情況
198例次患者均順利完成治療。治療后24 h內,觀察到9例次患者出現中心靜脈置管處滲血,1例次患者出現鼻腔出血,經對癥處理后均緩解。所有例次患者在治療后24 h內均未發生消化道出血等其他嚴重出血并發癥。所有例次患者均未發生肝素誘導的血小板減少癥。肝素過量組患者在治療結束后24 h APTT為(54.52±19.71)s,與治療前比較,差異無統計學意義(P>0.05)。
3 討論
肝素是體外循環應用最為廣泛的抗凝劑,但由于普通肝素的藥代動力學個體間差異較大,因此目前尚無精確的計算用量方法。2020年血液凈化標準操作規程推薦血漿吸附或血漿置換時肝素首劑0.5~1.0 mg/kg,維持劑量10~20 mg/h[9],在心臟手術抗凝中臨床一般采用3~4 mg/kg進行計算肝素給藥[10]。既往研究[11]顯示按照千克體質量給藥,達峰值時肝素血藥含量差異較大,可能與體內分布、蛋白結合率及代謝的個體差異有關,因此僅按照千克體質量給藥難以達到理想血藥濃度,應實行給藥劑量個體化。同時由于肝臟在機體正常凝血功能調節中起著重要作用,大多數與凝血功能相關的蛋白均在肝臟中合成,肝功能異常時導致促凝血因子和抗凝血因子均相對缺乏,這種凝血再平衡的狀態很容易被打破,出現出血或血栓形成[12-13],因此上述方案并不適用于肝病患者的人工肝治療。
肝素抗凝作用的最主要機制是與抗凝血酶Ⅲ(antithrombin,AT-Ⅲ)以及組織因子途徑抑制物(tissue factor pathway inhibitor,TFPI)結合,加速AT-Ⅲ滅活凝血因子的凝血效能,增強其對Xa因子和凝血酶的抑制作用[14]。次要的作用機制包括激活肝素輔助因子Ⅱ(heparin cofactor Ⅱ,HCⅡ)的抗凝血性質,直接滅活Ⅱa 因子,在嚴重抗凝血酶缺乏時,此機制發揮主要作用,但需要較高的肝素濃度[15]。
肝素與血小板之間的相互影響十分復雜。既往研究[16]認為肝素可以與凝血酶競爭性結合血小板表面的高親和力糖蛋白受體而阻斷凝血酶誘導的血小板聚集反應。但近來研究[17]顯示在肝素作用下,血小板可以分泌血小板因子Ⅳ與肝素形成復合物而限制肝素的抗凝作用。基于以上機制,本研究依據肝病患者人工肝治療前的PTA、PLT制定了治療過程中肝素給藥方案,觀察該方案在DPMAS治療過程中的安全性。
在該給藥方案下,198例次DPMAS治療均能夠順利完成,治療過程中無嚴重堵管導致治療中斷,治療后無消化道出血等嚴重不良反應,在治療結束后24 h 凝血指標恢復至治療前水平。但在治療過程中有34.85%例次出現治療結束前5~10 min APTT較治療前延長>2.5倍,根據研究[9]推薦血液凈化中APTT參考范圍,本方案可能存在肝素使用過量。其中肝素過量例次主要集中在PTA≤30%、PLT<125×109/L組,進一步分析顯示抗凝過量組患者凝血參數相關指標PT、APTT、AT相對抗凝良好組均惡化明顯,這提示對于PTA≤30%、PLT<125×109L的肝病患者,依照本方案給藥易出現肝素過量情況,出血并發癥發生風險高。但本研究中出血相關并發癥發生率為5.05%,并且無消化道出血等嚴重并發癥發生,與既往人工肝應用肝素抗凝相關報道[18-19]中結果基本一致。研究[20]顯示,不同實驗室不同試劑APTT值波動較大,同時由于凝血因子、激肽釋放酶、纖維蛋白原的缺乏,血小板減少、狼瘡抗凝物的存在、抗磷脂綜合征、高齡等因素均會使APTT延長,因此APTT目標范圍較基礎值延長1.5~2.5倍可能并不準確[21]。因此,本研究中肝素過量例次較多可能與APTT目標范圍設定不準確有關。
在本研究中,11例次在治療過程中出現跨膜壓、靜脈壓在短時間內突然上升、治療過程中機器頻繁發生凝血報警等情況需要追加肝素劑量,以保證后續治療順利完成。肝素抗凝不足的例次主要集中在PTA>40%、PLT>325×109/L組,與抗凝良好組相比,抗凝不良組患者體質量、Hb、PLT升高,差異有統計學意義(P<0.05)。這與指南[9]及相關研究[22-23]推薦肝素抗凝劑量以體質量為主要參考相符,但仍要考慮Hb、PLT等其他因素的影響。
目前在人工肝抗凝治療中,肝素、低分子肝素、無肝素、枸櫞酸局部抗凝等方式均有應用報道[19,23-24],但關于肝素抗凝劑量的研究相對較少。本研究依據患者治療前PTA、PLT經驗性給予不同劑量肝素抗凝,顯示當PTA>30%、PLT≤325×109/L時,該方案是可行的,無嚴重出血并發癥發生,但應考慮體質量、血紅蛋白對抗凝效果的影響。
本研究為初步探索性研究,后續研究將依據本研究結果進一步擴大樣本量、增加觀察指標對本研究結果進行補充,以期能將肝素方案調整到最佳劑量并進一步推廣應用。

