原子的波環結構和多米諾效應
方瑞士
(蕪湖市第四人民醫院,安徽蕪湖 241002)
0.引言
化學理論落后于實踐,這是公認的事實。無機化學中的電子配對成鍵,這種假說違反了電子繞核運動規則;有機化學中的電子云重疊成鍵,這種假說違反了電子相斥原理。另外,碳原子在無機化學中以電子配對成鍵,在有機化學中,又說它是以電子云重疊成鍵,相互矛盾,不能自圓其說。所以,它們都不可能真正解決分子結構問題。
原子波環結構中的環套環成鍵既不違反電子繞核運動規則,也不違反電子相斥原理。所以,它能完美解釋各種分子結構和化學反應[1]。本文對化學元素核外電子的運動狀態及分子成鍵的機理進行深入探索,提出新的分子結構成鍵理論,為化學基礎理論創新研究拋磚引玉。
1.原子和分子的波環結構
1.1 氫原子的波環結構
核磁共振的成功實現證明在化合物中的氫原子是一個小磁體,它的核外電子云是環形,而不是球形。或者說,在氫核的周圍是一個環形電子流。因為電子具有波的特性,所以,我們把這種環形電子流叫做電子波環,或簡稱為波環。氫的1s,2p,3d電子云只能在孤立的氫原子中存在。
1.2 多電子原子的波環結構
在多電子原子中,電子如何運動呢?同一能級的兩個電子在相互貼近且相互平行的兩個平面內進行繞核運動時所產生的斥力最大,在相互垂直相交的兩個平面內繞核運動所產生的斥力最小。所以,按照斥力最小原理,氦原子核外的兩個電子是在垂直相交的兩個平面內進行繞核運動。當有3,4,5,6,7,8個電子波環相交時,為保持各波環之間斥力相等,每兩個相鄰波環之間的夾角分別為60°,45°,36°,30°,25.7°,22.50°。
“路易斯結構”的八偶律與原子直徑大小無關,與電子之間的角度有關,這里,已經披露原子波環結構的存在,換句話說,每兩個相鄰波環之間的角度不小于22.5°。如圖 1 中(a),(b),(c)所示。
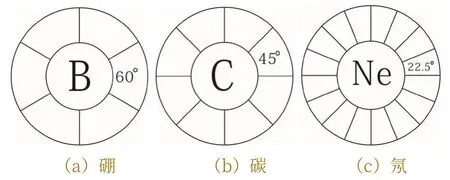
圖1 硼,碳和氖原子的波環結構
1.3 氫分子的波環結構
上面的分析表明,在多電子原子中,它們的電子云也是環形,而不是球形和啞鈴形,其電子也以波環的形式存在。關于共價鍵化合物的成鍵,首先,以氫原子為例,當兩個氫原子結合成分子時,無數波環與無數波環之間發生交鎖形成一個穩固的分子(即環套環)。相互交鎖后,波環的運動范圍受到限制,氫的電子云已不是球形。若一環不動,另一環只能繞該環運動。換言之,兩波環相交鎖,兩個半球殼之間的波環運動幾率密度增加。但是,它與電子云重疊成鍵在本質上是不同的。
為了描述的方便,將無數環簡化為一環,用符號“-R-”或“R-”代表波環,“R”代表元素。用符號“×”代表波環交鎖(環套環),即共價鍵。用符號“R→”代表波環嵌入(離子鍵)。氫分子波環結構式如圖2所示。
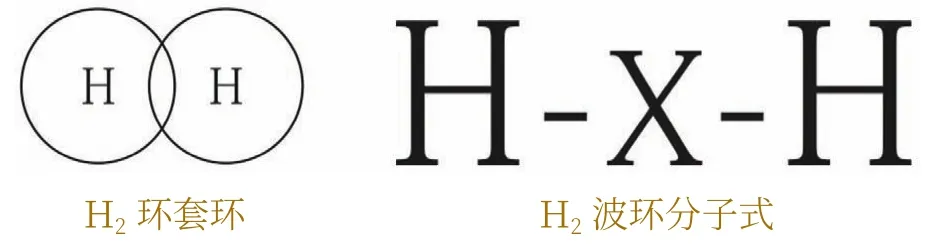
圖2 氫分子的波環簡化式
1.4 碳,甲烷和甲醇的波環結構式
下面,分析甲烷的正四面體結構。甲烷由一個碳原子和四個氫原子交鎖而成,碳原子外層有4個電子,即4個電子波環。按照波環之間斥力均衡的原則,碳的4個波環將球殼分為8等份,相鄰波環之間的夾角為45°。因為是4個波環,所以,碳原子本身不能形成正四面體結構,因為只有4個波環。
當碳原子與4個氫原子相交鎖時,4個氫原子之間為了保持斥力相等,必須保持距離相等。另一方面,它們各自與碳核之間的距離也是相等的。換言之,4個氫原子波環與碳原子交鎖時,既要保持相互之間的距離相等,也要保持與碳核之間的距離相等。為滿足這些條件,它們與碳原子鎖定的位置只能是正四面體的4個頂點。
下面,寫出碳、甲烷和甲醇的波環結構式,省去碳的符號C。如圖3(a),(b),(c)所示。
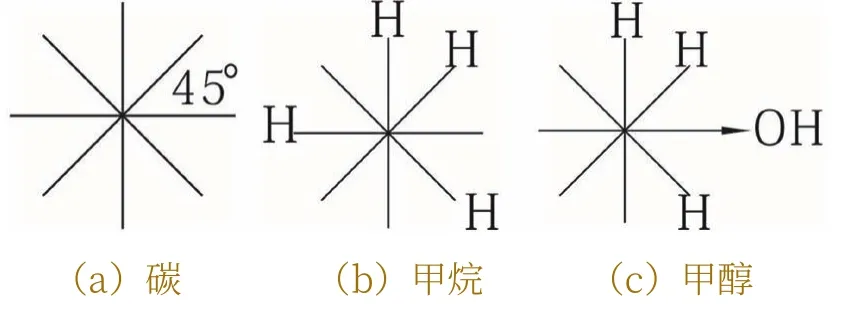
圖3 碳,甲烷和甲醇的波環結構式
1.5 苯的波環結構
關于苯分子穩定結構,用波環結構式也能作出令人滿意的解釋。苯由6個碳原子和6個氫原子相交鎖而成。每個碳原子只有1個波環與氫相交鎖,剩下3個波環則碳碳相互交鎖成環。如圖4、圖5所示。
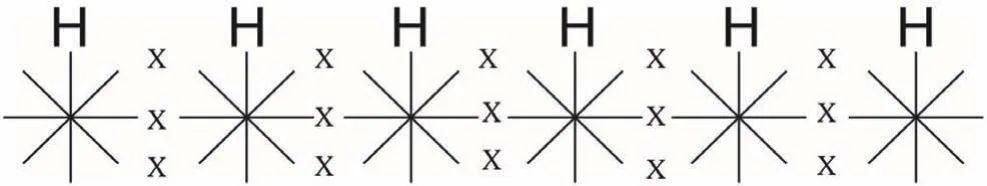
圖4 苯環斷成直鏈的波環結構式
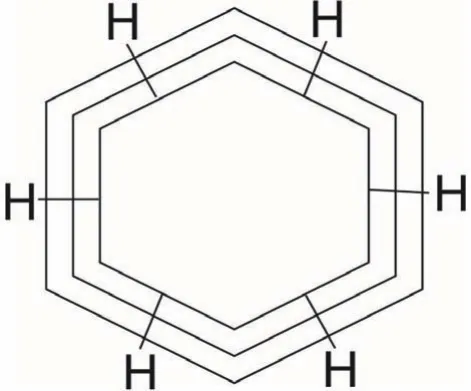
圖5 苯的波環分子式
苯環中,碳原子位于6邊形各邊的中央,并不位于6個角的頂點。碳碳之間各以3個波環相互交鎖,并不存在單鍵與雙鍵。而且,這3個波環的兩端都與相鄰碳原子相交鎖,所以,苯環是非常穩定的,不易被斷開。
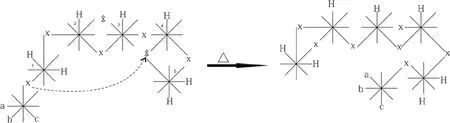
2.分析環化反應分子重排鍵遷移等的本質是多米諾效應
2.1 共扼二烯烴加成反應的本質是多米諾效應
在1,3-丁二烯與溴的波環反應式中,可以看出,共扼二烯烴加成反應的本質是多米諾效應。
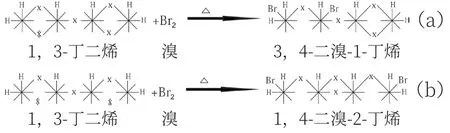
在(a)式中,只有一個雙鍵被斷開,形成3,4-二溴-1-丁烯。可以看到(溴與碳4)交鎖→(碳3與碳4一側雙鍵)斷開→(溴與碳3)交鎖,是一種多米諾效應現象。
在(b)式中,同側的兩個雙鍵都打開,形成1,4-二溴-2-丁烯。可以看到(溴與碳1)交鎖→(碳1與碳2一側雙鍵)斷開→(碳2與碳3形成雙鍵)交鎖→(碳3與碳4一側雙鍵)斷開→(溴與碳4)交鎖,也是一種多米諾現象。
2.2 環化反應遵循多米諾效應
舉例如下:
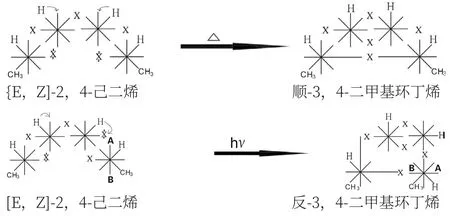
[E,Z]-2,4-己二烯加熱時,變成順-3,4-二甲基環丁烯;光照時變成反-3,4-二甲基環丁烯。從上面的波環反應式可以看到,在加熱時,[E,Z]-2,4-己二烯兩個雙鍵的同側各斷開一鍵,此外,還發現碳2與碳3上的氫向鄰位波環遷移,這是一般化學式無法顯示的。然后,碳1與碳4交鎖成環。碳2與碳3的波環交鎖成雙鍵,構成順-3,4-二甲基環丁烯。
在光照時,[E,Z]-2,4-己二烯的兩個雙鍵是對側交叉式各斷開一鍵,即碳1的內側鍵和碳4的外側鍵分別斷開,若碳1不動,碳4第一步順時針旋轉90°。使碳3和碳 4 之間的單鍵拉直,第二步,將碳4波環A-B的B 端與碳1交鎖成環。而碳2與碳3上的氫也同樣發生鄰位波環遷移,使碳2與碳3交鎖成雙鍵,構成反-3,4-二甲基環環丁烯。
因為光波的頻率是固定的,它只能使兩個頻率相同的電子波環斷開。而在兩個雙鍵中,只有兩個雙鍵對側的電子波環的頻率和方向是一致的。所以,光照時是兩個雙鍵的對側各斷開一鍵。加熱則無頻率和方向差別,故是同側各斷開一鍵。所以,二者的生成物有正反之分。從第一到第四個碳原子,可以看到雙鍵斷開→交鎖→斷開→交鎖的多米諾現象。
2.3 [2+2]環化加成反應遵循多米諾效應
在[2+2] 環化加成反應中,光照條件下兩分子面對面(對側雙鍵斷開)加成是允許的,而在加熱條件下是面對背(同側雙鍵斷開)加成,由于雙方脫勾的波環被隔開,并且波環的角度明顯錯位而不能加成。如(Z)-2-丁烯在光照條件下,兩分子面對面加成,生成1,2,3,4-四甲基環丁烷的兩種異構體。雙鍵斷開→交鎖→斷開→交鎖,是一種多米諾效應。
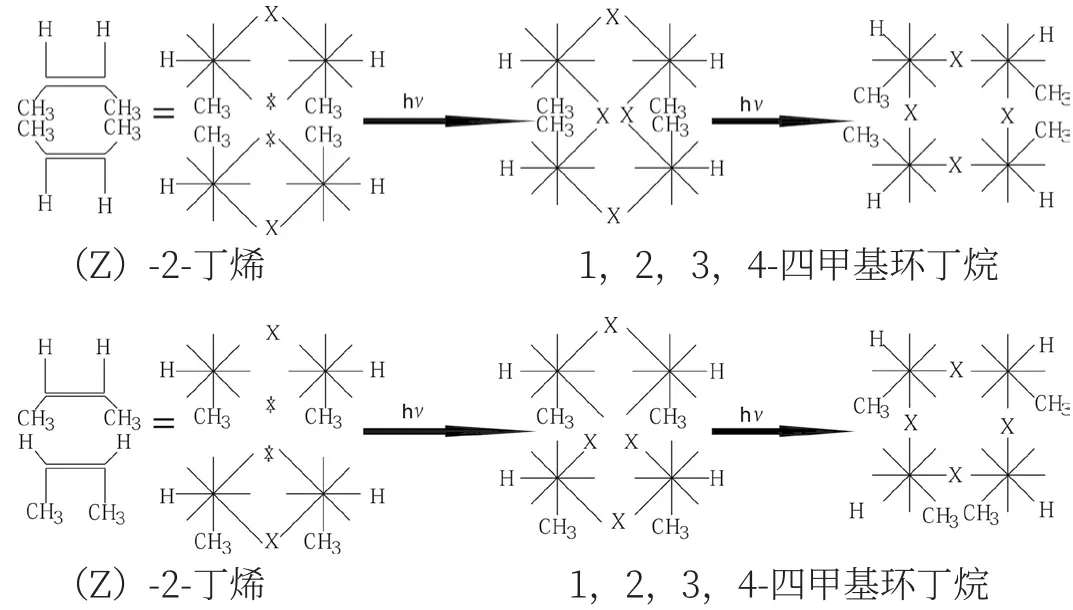
在加熱條件下,是同側(面對背)雙鍵斷開,脫勾波環被隔開,所以,不能交鎖成環。

2.4 [4+2]環化加成反應也遵循多米諾效應
如,在[4+2]環化加成反應中,前者在加熱條件下是同側雙鍵斷開,與后者面對背環化加成是允許的。而在光照條件下,前者是對側雙鍵交叉式各斷開一鍵,與后者面對面環化加成時,由于脫勾波環明顯錯位,其中,一側脫勾的雙鍵被隔開而不能環化加成。如,1,3-丁二烯與乙烯在加熱條件下環化加成是允許的:
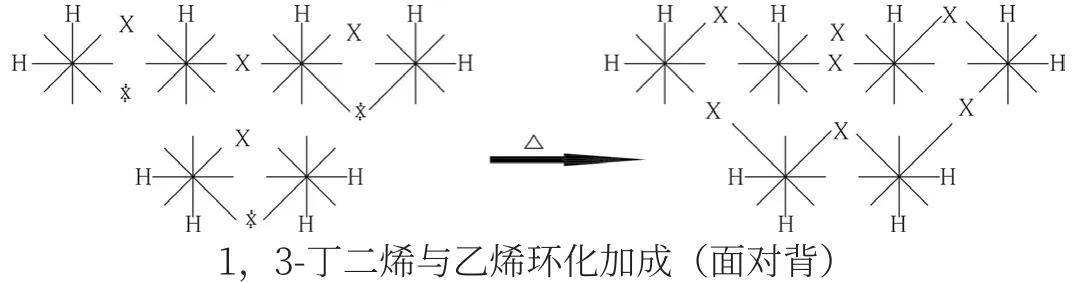
可以看到,6個碳原子之間,斷開→交鎖→斷開→交鎖,是一種多米諾效應。
在光照條件下,1,3-丁二烯一側脫勾的波環被隔開,不能與乙烯面對面交鎖成環:
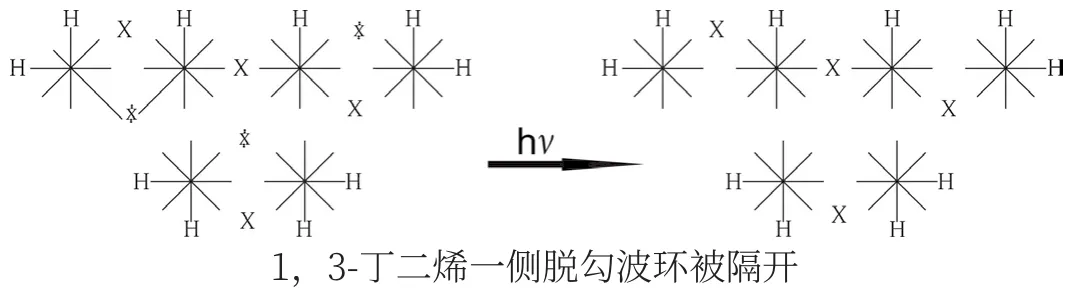
2.5 考普重排的本質是多米諾效應
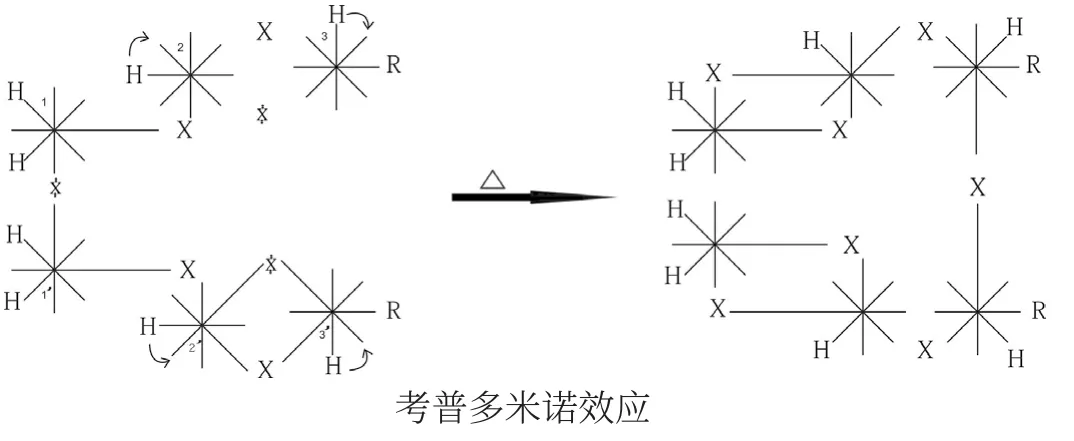
考普重排[3,3] σ 鍵遷移是假象:
當C1和C1’鍵斷開后,C2和C2’上的H向鄰位波環遷移,繼而使C3和C3’上的H 也向鄰位波環遷移。隨后C3和C3’交鎖成鍵。而C2-C1及C2’-C1’交鎖成雙鍵。從C1到C3,從C1’到C3’各碳原子之間遵循斷開→交鎖→斷開→交鎖之規律。
2.6 克萊森重排的本質也是多米諾效應
克萊森重排σ鍵遷移是假象:
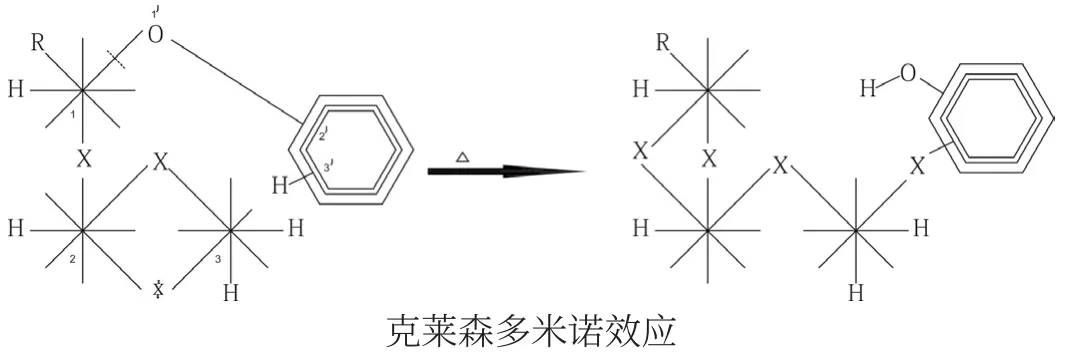
當C1和O之間的σ鍵斷開后,C1斷開的波環另一端與C2相交鎖,使C2和C3之間的雙鍵斷開,而C3斷開波環的另一端又與C3’相交鎖,迫使C3’上的H向O遷移,形成OH鍵。不過,此時的OH和OC鍵已由交鎖轉化為嵌入。由此看來,克萊森重排中各有關碳原子之間也遵循斷開→交鎖→斷開→交鎖之多米諾效應規律。
2.7 氫參加的[1,3] σ 鍵遷移是錯覺,它們的本質是多米諾效應
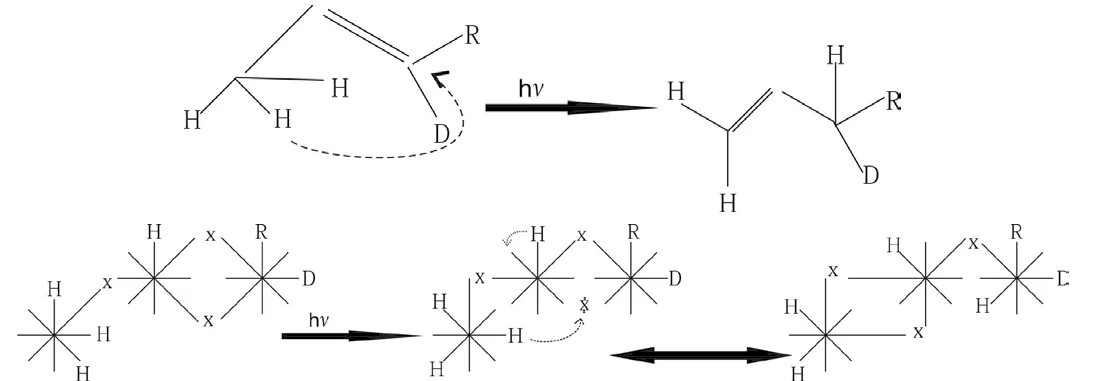
2.8 氫參加的[1,5] σ 鍵遷移是錯覺,他們的本質是多米諾效應
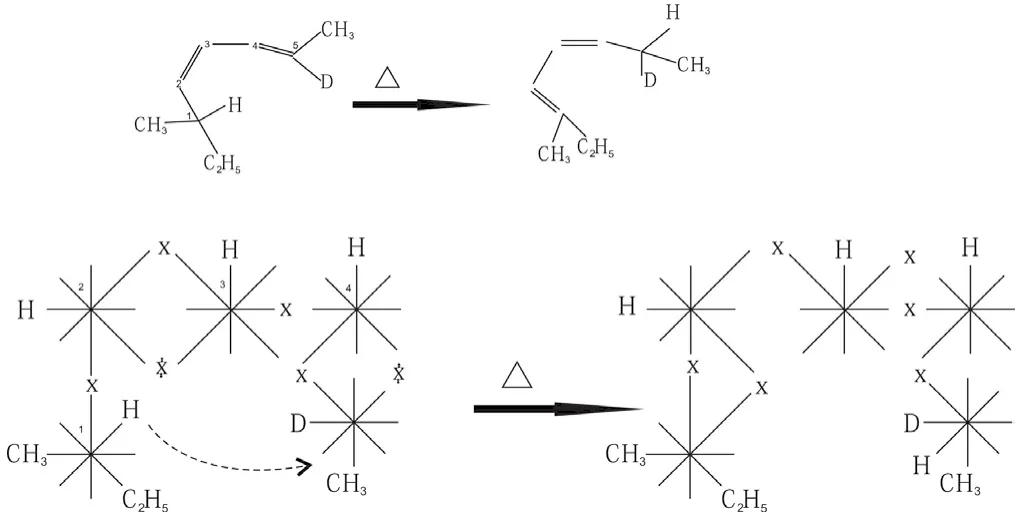
2.9 碳參加的[1,3]烷基 σ 鍵遷移是錯覺,它們的本質是多米諾效應
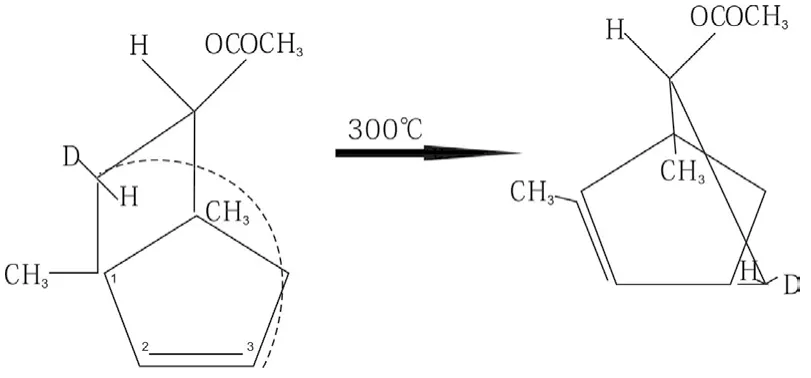
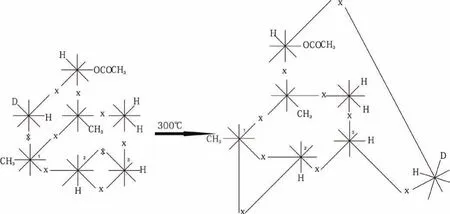
2.10 碳參加的[1,5] 烷基σ 鍵遷移是錯覺,它們的本質也是多米諾效應
3.總結與展望
原子的波環結構闡明了雙鍵和單鍵之間的演變過程,這一事實得出這樣的結論:含有雙鍵的化合物,如果雙鍵發生變化,這種變化一定遵循多米諾效應規律。人們可以運用多米諾效應規律去合成各種新的有機化合物。
長期以來,化學家們對于電環化反應,環化反應,環化加成反應,分子重排及σ鍵遷移等這類有機化學反應感到困惑,現有的化學理論,包括分子軌道對稱守恒理論并不能使上述各類化學反應得到完全合理的解釋。原子的波環結構不但合理地解釋了甲烷和苯的立體結構,而且,還十分完美地解釋了前面一系列難以解釋的有機化學反應,它們的本質都是多米諾效應。這絕不是巧合,也不可能有這么多具有規律性和統一性的巧合,恰恰論證了原子波環結構客觀存在的正確性。科學需要不斷地探索,原子波環結構的研究是初步的,還需要人們不斷地深入研究和探討。

