基于PG-SGA評分的個體化營養干預對食管癌根治術患者的影響
強利敏,法衛玲,陳 黎,蔡秋霞
(鄭州大學附屬洛陽中心醫院 河南洛陽471000)
食管癌是臨床常見消化道惡性腫瘤,其發病率和病死率均較高[1]。目前,根治性切除手術依然是治療食管癌的主要手段,但患者因長期進食困難、惡性腫瘤消耗,大多存在營養不良、免疫功能低下的情況,再加上手術應激反應的影響,不僅加重機體代謝分解及負氮平衡,還增加了術后并發癥發生風險,影響術后恢復[2-3]。因此,針對食管癌圍術期患者的營養干預至關重要。患者自評-主觀評定量表(PG-SGA)是臨床篩查營養風險的常用量表,陽性率高、操作性強[4]。為進一步了解患者營養狀況,提高食管癌患者術后免疫功能,促進術后康復,本研究采取基于PG-SGA評分的個體化營養干預方案,取得滿意效果。現報告如下。
1 資料與方法
1.1 臨床資料 選取2018年1月1日~2020年1月31日我院食管癌根治術患者180例作為研究對象。納入標準:年齡18~70歲;經病理檢查確診為食管癌,且符合食管癌根治術各項指征;術后不采取放化療等治療;知情同意。排除標準:術前嚴重營養不良[PG-SGA評分≥9分或體質指數(BMI)≤18.5]者;合并心、肝、腎功能嚴重不全者;合并其他惡性腫瘤者;伴有高血壓、糖尿病、冠心病等基礎疾病者;既往有貧血史或血液疾病者;嚴重精神疾病者;妊娠或哺乳期女性。采用隨機數字表法將患者分為觀察組和對照組各90例。觀察組男46例、女44例,年齡30~70(51.23±6.48)歲;BMI 19~24(22.16±3.49);臨床分期:I期28例,II期35例,III期27例。對照組男45例、女45例,年齡32~69(52.19±6.52)歲;BMI 19~24(22.35±3.38);臨床分期:I期26例,II期39例,III期25例。兩組性別、年齡、BMI、臨床分期等資料比較差異無統計學意義(P>0.05)。本研究經醫院倫理委員會審核。
1.2 方法
1.2.1 對照組 采取常規營養干預。術前給予常規飲食指導和營養健康教育。術后待生命體征平穩后給予早期腸內營養支持,即術后第1天輸注500 ml葡萄糖氯化鈉注射液,若無不良反應,則第2天通過鼻飼管泵入500 ml(20~30 ml/h)百普力,第3天增加至1000 ml(50~60 ml/h),第4~6天根據患者營養耐受情況和目標熱量125.52 kJ/kg增加至1500~2000 ml(80~100 ml/h),能量不足的部分通過靜脈輸注予以補充。之后逐漸過渡到流質飲食、半流質飲食,再到普通飲食。出院時由護士著重講解家庭飲食注意事項,并在出院后2周內進行電話訪問,了解患者的飲食情況。
1.2.2 觀察組 實施基于PG-SGA評分的個體化營養干預。①成立由主治醫師、營養師、專職護士、護士長組成的營養干預小組,主治醫師負責具體治療,營養師負責制定營養干預計劃,護士長負責統籌協調,護士負責營養干預方案的具體實施及反饋。②入院24 h內采用PG-SGA評估患者的營養狀況,根據PG-SGA評分制定個體化營養干預方案。PG-SGA評分0~1分提示營養狀況良好,給予飲食指導+營養教育;2~3 分提示輕度營養不良,給予飲食指導+藥物改善食欲;4~8分為中度營養不良,給予腸內營養制劑。③術后早期腸內營養支持方法同對照組。同時術后每周采用PG-SGA對患者的營養狀況進行復評,根據結果與患者、家屬、營養干預小組成員共同商討重新調整營養方案,必要時出院后給予術后家庭腸內營養補充。兩組術后并發癥均給予對癥處理,惡心嘔吐者給予鹽酸帕洛司瓊注射液止吐;腹瀉者給予蒙脫石散劑止瀉;便秘者給予開塞露潤腸;感染者給予抗生素治療。兩組干預時間均為1個月。
1.3 評價指標 ①比較兩組干預前后營養指標。于干預前后采集患者清晨空腹肘靜脈血5 ml,檢測血清蛋白(ALB)、血紅蛋白(Hb)、血清前白蛋白(PA)、血清總蛋白(TP)等指標。所用儀器為羅氏cobas 8000全自動生化分析儀。②比較兩組干預前后免疫功能指標。于干預前后采集患者空腹肘靜脈血2 ml,離心后取上清,用流式細胞儀BD FACSCanto 檢測淋巴細胞中CD3+、CD4+、CD8+的百分率,并計算CD4+/CD8+比值。③比較兩組并發癥發生率,包括惡心嘔吐、腹瀉、腸梗阻、吻合口瘺、感染等。④比較兩組首次排氣時間、胃管留置時間、術后住院時間。

2 結果
2.1 兩組干預前后營養指標比較 見表1。

表1 兩組干預前后營養指標比較
2.2 兩組干預前后免疫功能指標比較 見表2。
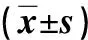
表2 兩組干預前后免疫功能指標比較
2.3 兩組并發癥發生率比較 見表3。

表3 兩組并發癥發生率比較(例)
2.4 兩組首次排氣時間、胃管放置時間、術后住院時間比較 見表4。

表4 兩組首次排氣時間、胃管放置時間、術后住院時間比較
3 討論
食管癌患者由于進食困難,一般在確診時即表現為營養不良,接受根治術治療患者營養不良問題更加嚴重[5]。臨床研究指出,患者營養不良不僅會影響手術效果,還會增加術后并發癥發生風險,術后早期腸內營養支持可有效改善營養狀況,促進腸蠕動,是重要的輔助治療手段[5]。相比患者營養風險篩查量表(NRS 2002),PG-SGA對于惡性腫瘤患者篩查陽性率更高,評估結果更詳細且易操作,能動態評估潛在的營養問題,以便及時采取相應營養方案[6]。本研究對食管癌根治術患者實施基于PG-SAG評分的個體化營養干預,以期增強患者免疫功能,促進術后恢復。
本研究結果顯示,觀察組干預后ALB、Hb、PA、TP水平高于對照組(P<0.05)。說明基于PG-SAG評分的個體化營養干預能改善患者的營養狀況。食管癌患者術前由于機體代謝異常、食欲不佳,存在不同程度的營養不良,根據PG-SGA評分結果對不同營養狀況患者進行個體化營養干預,可以有目的地改善患者的營養狀況,避免營養補充的盲目性。有研究顯示,患者術后第1天免疫功能下降,這不僅與患者原有的營養不良、手術應激反應有關,還與患者術后屏障功能減弱有關[7-9]。受手術應激和長時間禁食的影響,機體胃腸道的腸黏膜的屏障作用受限,使腸道菌群發生紊亂,從而導致免疫功能下降。本研究結果顯示,觀察組干預后CD3+、CD4+、CD4+/CD8+高于對照組(P<0.05),CD8+低于于對照組(P<0.05)。提示基于PG-SAG評分的個體化營養干預能增強患者免疫功能,與以往研究結果[10-11]一致。本研究個體化營養干預不僅在術前、術后根據PG-SAG評分給予腸內營養支持,而且在患者出院后繼續給予指導,持續動態監測使患者能夠及時得到腸內營養補充。腸道營養支持是模擬機體正常攝食的最佳方式,術后早期營養支持可抑制炎性反應,促進免疫功能恢復。
有研究顯示,消化道惡性腫瘤患者的營養狀況與生存質量、預后密切相關,惡心嘔吐、腹瀉、腸梗阻、吻合口瘺、感染等是食管癌患者術后常見并發癥,其中吻合口瘺是較嚴重的并發癥之一,會造成胸腔、縱膈感染,引發膿毒血癥、主動脈瘺等嚴重后果,是導致術后死亡的重要危險因素[12]。本研究結果顯示,觀察組術后并發癥發生率低于對照組(P<0.05)。PG-SAG從癥狀、飲食攝入情況、代謝、疾病等多個方面綜合評估患者的營養狀況,準確度較高,可降低術后并發癥發生風險。劉凱等[13]研究顯示,營養風險是惡性腫瘤術后并發癥的獨立危險因子,經過規范營養支持能降低并發癥發生率。臨床指出,食管癌根治術后復發轉移風險較高,大多數患者需要接受術后放化療,以延長生存時間,患者術后營養狀況越好則放化療耐受性越好,術后恢復越快[14]。本研究結果顯示,觀察組術后首次排氣時間、胃管放置時間、住院時間短于對照組(P<0.05)。提示基于PG-SAG評分的個體化營養干預通過動態營養評估,制定符合個人需求的營養方案對患者術后恢復有促進作用。
綜上所述,對食管癌根治術患者實施基于PG-SAG評分的個體化營養干預,可有效改善患者營養狀況,增強患者免疫功能,減少術后并發癥,促進患者術后康復。

