ATAC-Seq技術在間充質干細胞成脂分化早期研究中的應用
劉建云,江和,張杰,馬百成,吳萍,熊建軍,
(1.江西省系統生物醫學重點實驗室,江西 九江 332000;2.九江學院醫學院組織胚胎學與醫學遺傳學教研室,江西 九江 332000)
脂肪細胞由間充質干細胞(mesenchymal stem cells,MSCs)定向分化而來。脂肪生成的改變可能導致復雜疾病的發生,如骨質疏松癥、肥胖、糖尿病和其他脂肪代謝紊亂等[1]。應用成脂誘導劑(地塞米松聯合胰島素、吲哚美辛、3-異丁基-1-甲基黃嘌呤)是體外誘導hMSCs向成脂細胞分化的經典方法[2]。這一過程中涉及眾多基因的轉錄激活或抑制[3-4],但是其中的機制尚未完全明確。基于轉座酶和高通量測序的染色質分析(assay for transposaseaccessible chromatin using sequencing,ATAC-Seq)是近年來興起的用于研究染色質開放性的表觀遺傳學技術,通過獲得染色質上開放區域的位置和活躍的調控序列,在全基因組范圍內推測特定生理過程中可能參與的轉錄因子及其動態規律[5-6]。本研究以人源hMSCs成脂分化的早期過程(0~7 d)為研究目標,采用ATAC-Seq技術分析其中的染色質開放性變化,為進一步了解成脂分化的調控機制及尋找有效靶基因提供新的思路。
1 材料與方法
1.1 細胞培養和處理
人源性MSCs(hMSCs)由本實驗室保存。在37 ℃,5% CO2環境下培養,間隔48 h傳代。取第6代MSCs進行成脂誘導,誘導劑成分為DMEM培養液,內含10%胎牛血清,1 μmol地塞米松,10 μg/mL胰島素,200 μmol 吲哚美辛和 0.5 mmol 3-異丁基-1-甲基黃嘌呤[2]。成脂誘導劑分別刺激細胞0 d(MSC-0d)、3 d(AD-3d)、5 d(AD-5d)和7 d(AD-7d)。刺激完畢去上清,收集細胞,在4 ℃環境下以500g離心力離心5 min,留取沉淀細胞,隨后以50 μL冰冷PBS 洗滌細胞1次,去上清液,再以50 μL冰冷裂解緩沖液懸浮細胞,離心10 min;去上清液,迅速進入轉座反應。
1.2 轉座反應與純化
混合轉座反應體系50 μL(2.5 μL Nextera Tn5 Transposase、25 μL 2 × 反應緩沖液、22.5 μL無核酶水)在冰冷溫度懸浮細胞核,再置于37 ℃孵育30 min;隨后用Qiagen MinElute PCR純化試劑盒純化DNA用于PCR反應[7],反應體系為10 μL DNA、2.5 μL PCR引物1、2.5 μL Barcoded PCR 引物2、25 μL NEBNext High-Fidelity 2× PCR Master Mix、10 μL無核酶 水。反應條件為72 ℃延伸5 min;98 ℃ 變性30 s(1個循環);98 ℃變性10 s;63 ℃退火30 s;72 ℃延伸1 min(共5個循環);72 ℃延伸5 min;4 ℃冷卻。PCR產物再經Qiagen MinElute PCR純化試劑盒純化后進行Illumina HiSeq測序。
1.3 生物信息學分析
測序數據的質量控制使用Fast QC軟件。下機的原始數據經去接頭處理。BWA軟件將clean data比對到參考基因組hg38_genecode[8]。比對分析后得到的bam文件作為輸入文件,使用MACS2軟件進行Call Peak,篩選閾值為q< 0.05[9]。每個Peak 區域從5’端和3’端2個方向分別延伸200 bp 提取DNA序列,采用HOMER 軟件預測Motif,隨后將預測的motif與數據庫(HOMER、JASPAR)中已有的motif 數據進行匹配,鑒定相應的已知motif和相應的轉錄因子[10]。基因附近信號分布圖的分析使用 deeptools 軟件[11]。
利用DAVID(the Database for Annotation,Visualizationand Integrated Discovery)數據庫對染色質開放區域相關聯的基因進行基因本體論(gene ontology,GO)富集分析[12];基于京都基因與基因組 百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)數據庫對Peak鄰近基因 Pathway富集分析[13]。
2 結果
2.1 細胞染色質開放區域的鑒定
在成脂誘導劑刺激下,原代培養的hMSCs逐漸出現分化至14 d,成功分化為包含脂滴的脂肪細胞,見圖1。

圖1 油紅O對hMSC分化不同時間點細胞的染色 ×200Fig.1 Oil red O staining of hMSCs at different time points of differentiation ×200
測序原始數據經篩選后,采用BWA軟件比對,各組細胞(MSC-0d、AD-3d、AD-5d、AD-7d)的Reads比對率均高于95%;Reads信號在基因區域的分布主要在轉錄起始點(TSS)附近(圖2A)。使用MACS軟件對各組細胞Reads進行Call Peak,在MSC-0d組篩選出110 369個Reads顯著富集的區域(Peak),在AD-3d組篩選出68 327個Peak,在AD-5d組篩選出99 362個Peak,在AD-7d組篩選出77 712個Peak,表明hMSCs向成脂細胞分化的前3 d,轉錄活性區域明顯減少,隨后逐漸恢復(圖2B)。各組細胞的Peak分布在啟動子與轉錄起始點之間的比例大約為10%~20%,各組之間存在細微差異。在成脂誘導的第3天,位于啟動子與轉錄起始點染色質開放區域的比例最高(17.63%),而此時全基因組Reads信號反而最少(圖2C)。

圖2 細胞染色質開放區域的鑒定Fig.2 Identification of opening chromatin regions in each group of cells
2.2 染色質開放區域的motif分析
采用Homer軟件對4組細胞染色質開放區域的DNA序列進行motif分析,結果顯示,各組細胞中結合最多的motif均是亮氨酸拉鏈(basic leucine zipper,bZIP)轉錄因子家族的成員,如Fra1、Atf3、Fra2、JunB、BATF、AP-1等(結果未顯示)。隨后對AD-3d/MSC-0d、AD-5d/MSC-0d、AD-7d/MSC-0d組間差異motif分別進行分析,在AD-3d/MSC-0d組間,數量上調最為顯著的motif為CEBP、EBF2、NF1等;在AD-5d/MSC-0d組間,數量上調最為顯著的motif為CEBP、EBF2、RUNX1等;在AD-7d/MSC-0d組間,轉錄因子數量上調最為明顯的motif則為TEAD3、CEBP、RUNX1等(圖3A)。過氧化物酶體增殖物激活受體(peroxisome proliferatorsactivated receptors,PPARs)為調控成脂早期分化的關鍵轉錄因子,本研究重點追蹤了PPARγ結合motif排序的動態變化,結果顯示,PPARγ結合的motif在MSC-0d的富集排序為360位;在AD-3d和AD-5d,富集排序分別升至第161位和第170位;而在AD-7d,PPARγ的motif富集排序又降至350位(圖3B),表明成脂分化的第3~5天,PPARγ轉錄因子被顯著激活。
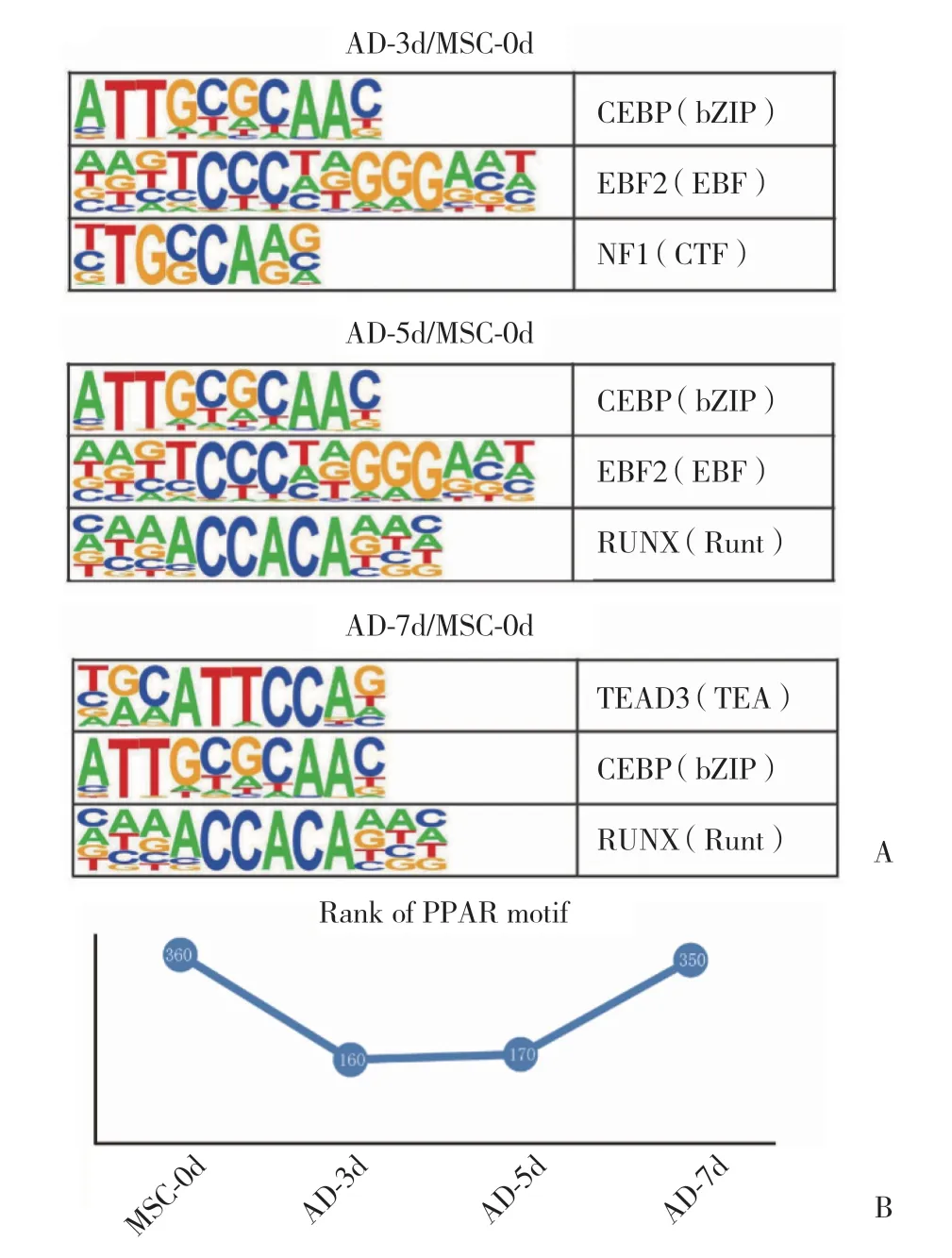
圖3 各組細胞間差異motif分析Fig.3 Motif analysis in each group
2.3 GO富集分析結果
MSC-0d、AD-3d、AD-5d和AD-7d 4組細胞染色質開放區域所關聯的基因的主要生物學過程(biological process,BP)并無統計學差異,大多涉及蛋白磷酸化、代謝等過程(結果未顯示)。通過對各組間差異染色質開放區域所關聯的基因進行GO分析,發現在AD-3d/MSC-0d組間,上調最為顯著的BP有細胞黏附,細胞外基質組織,Rho-GTPase活性的正性調控等;在AD-5d/MSC-0d組間,上調最為顯著的BP有細胞黏附,細胞外基質組織,細胞形態調控等;在AD-7d/MSC-0d組間,上調最為顯著的BP則是GTPase活性的正性調節,內皮細胞遷移的正性調節和血管生成等(圖4)。以上結果表明,成脂分化第7天,基因功能的變化與前5 d有明顯不同。

圖4 各組細胞間差異Peak鄰近基因GO富集分析Fig.4 GO enrichment analyses of peak adjacent gene differences in each group
2.4 Peak鄰近基因功能Pathway富集分析結果
Pathway富集分析結果顯示,MSC-0d、AD-3d、AD-5d和AD-7d 4組細胞染色質開放區域所關聯的Pathway并無明顯差別(結果未顯示)。而組間差異染色質開放區域所關聯Pathway有顯著變化。在AD-3d/MSC-0d組間,上調最為顯著的Pathway有Rap1信號通路,蛋白消化與吸收通路,PPARs信號通路,PI3K-Akt 信號通路等,而與脂肪酸代謝密切相關的脂肪酸代謝通路也顯著上調;在AD-5d/MSC-0d組間,上調較為顯著的Pathway有Rap1信號通路,黏附連接,PPARs信號通路等;在AD-7d/MSC-0d組間,上調較為顯著的Pathway有Rap1信號通路,黏附連接,黏著斑激酶通路等,而PPARs信號通路和脂肪酸代謝通路活性顯著下降,見圖5。

圖5 各組細胞間差異 Peak 鄰近基因Pathway 富集分析Fig.5 Pathway enrichment analysis of peak adjacent gene differences in each group
3 討論
脂肪細胞來源于hMSCs的分化,這一過程通常被劃分為2個階段:(1)MSCs定向分化為前脂肪細胞階段(決定期);(2)前脂肪細胞最終分化為成熟和功能性脂肪細胞(終末分化期)[14-15]。本項研究著重關注hMSCs成脂分化的早期階段,所以將觀察的染色質開放區的時間點定為誘導后的7 d之內。
“開放”和“封閉”染色質分別代表基因的轉錄激活和抑制狀態[16]。ATAC-Seq測序結果顯示,hMSCs有超過十萬個染色質開放區域,且信號密度在轉錄起始點附近最高,表明MSCs在體外培養條件下就具有較高的基因表達活性。成脂誘導劑作用第3天,染色質開放區域的數量發生顯著下降,但是信號趨向轉錄起始點集中,推測此階段的細胞功能可能被專一地錨定在譜系定向,而其余功能被弱化。成脂誘導的第5天和第7天,染色質開放區域的數量緩慢回升,提示轉錄因子活性增多,目前,這一動態變化尚未見報導。
motif分析反映活化轉錄因子活性的動態變化。在成脂分化的前5 d,motif的變動較為相似,最為明顯的有CEBP、EBF2、NF1等。CEBP家族是脂肪分化重要的調節因子[17],CEBPα,CEBPβ和CEBPδ促進脂肪生成,而CEBPγ則起抑制作用[18]。在此次測序分析中,沒有對各亞型進行細分,需要在下一步細胞實驗中予以驗證。值得關注的是,成脂分化第7天,發生顯著變化的motif是TEAD3而非CEBP。TEAD3是轉錄增強因子家族成員,有研究[19]顯示其也參與調控成脂分化,但作用機制尚不明確。以上結果表明,成脂分化不同時間點,調控細胞功能的轉錄因子有不同的側重點。本研究重點觀察PPARγ,因其是調控脂肪分化的重要的轉錄因子之一[20]。PPARγ的結合活性在經歷明顯升高后于第7天下降至正常水平,一方面表明前5 d可能為成脂定向分化的關鍵時期,另一方面也證實PPARγ是參與成脂分化的關鍵因子。
Peak鄰近基因GO富集分析顯示,成脂誘導劑作用的第3天和第5天,上調的基因功能與細胞黏附、血管生成、細胞外基質形成有關;第7天,新增的基因功能轉變為小分子GTPase活性、內皮細胞遷移等活動,提示細胞功能出現轉變。差異Pathway富集分析顯示,Rap1信號通路在成脂分化的前期都呈現顯著激活狀態,提示Rap1信號通路對于脂肪細胞分化可能具有重要的意義,值得進一步研究。此外,PPARγ信號通路在第3天和第5天中都呈現明顯激活狀態,與第7天不同,均提示分化第5~7天前后,細胞可能發揮不同的生理功能。
本研究分析了hMSCs成脂分化早期染色質開放區域的動態變化,下一步工作計劃聯合RNA-Seq數據和ChIP-Seq數據進行深入分析,為研究hMSCs定向分化的調控機制及骨質疏松癥的發病機制提供新的切入點。

